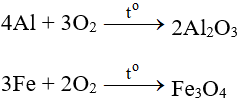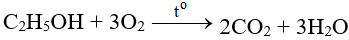FeS2 + O2 → Fe2O3 + SO2 | FeS2 ra Fe2O3 | FeS2 ra SO2
FeS2 + O2 → Fe2O3 + SO2 là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng FeS2 + O2 → Fe2O3 + SO2↑
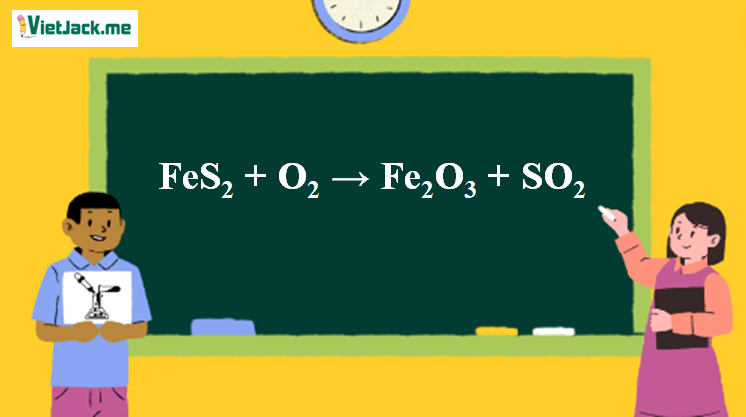
1. Phương trình đốt cháy quặng pirit
4FeS2 + 11O2 → 2Fe2O3 + 8SO2↑
2. Điều kiện phản ứng FeS2 ra SO2
Điều kiện: Nhiệt độ
3. Cách tiến hành phản ứng cho FeS2 + O2 → Fe2O3 + SO2
Đốt cháy quặng pirit ở nhiệt độ cao.
4. Hiện tượng Hóa học
Xuất hiện màu nâu đỏ của sắt (III) oxit Fe2O3.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của FeS2 (Quặng pirit)
- Trong phản ứng trên FeS2 là chất khử.
- FeS2 mang tính chất hoá học của muối thể hiện tính khử khi tác dụng với chất oxi hoá mạnh như axit hoặc O2.
5.2. Bản chất của O2 (Oxi)
Trong phản ứng trên O2 là chất oxi hoá.
6. Thông tin Pirit sắt FeS2
6.1. Sắt FeS2
Pirit sắt là khoáng vật của sắt có công thức là FeS2. Có ánh kim và sắc vàng đồng từ nhạt tới đậm đần. Khi va đập vào thép hay đá lửa, quặng pirit sắt tạo ra các tia lửa.
Công thức phân tử: FeS2
Công thức cấu tạo: S-Fe-S.
6.2. Tính chất vật lí và nhận biết
Là chất rắn, có ánh kim, có màu vàng đồng.
Không tan trong nước.
6.3. Tính chất hóa học FeS2
Mang tính chất hóa học của muối.
Thể hiện tính khử khi tác dụng với chất oxi hóa mạnh:
Tác dụng với axit:
FeS2 + 8HNO3 → 2H2O + 2H2SO4 + 5NO + Fe(NO3)3
FeS2 + 2HCl → FeCl2 + H2S + S
Tác dụng với oxi:
4FeS2 + 11O2 → 2Fe2O3+ 8SO2↑
6.4. Điều chế FeS2
Chủ yếu được tìm thấy trong tự nhiên dưới dạng quặng sắt.
7. Tính chất hóa học của O2
- Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
- Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
- Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
7.1. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ Au và Pt), cần có to tạo oxit:
7.2. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
7.3. Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
- Tác dụng với các chất hữu cơ:
8. Bài tập vận dụng liên quan
Câu 1. Cho các chất : FeS, FeS2 , FeO, Fe2O3. Chất chứa hàm lượng sắt lớn nhất là:
A. FeS
B. FeS2
C. FeO
D. Fe2O3
Lời giải:
Hàm lượng Fe trong FeO là lớn nhất:
%Fe = 5656+16.100=77,78%
Câu 2. Để nhận biết khí O2 và O3 ta sử dụng hóa chất nào sau đây?
A. Dung dịch KI và hồ tinh bột
B. Kim loại Fe
C. Đốt cháy cacbon
D. Tác dụng với SO2
Lời giải:
Câu 3. Dãy các chất nào sau đây tác dụng với dung dịch axit sunfuric loãng?
A. Fe2O3, CuO, Al2O3, MgO
B. Fe2O3, CuO, Al2O3, CO
C. P2O5, CuO, Al2O3, MgO
D. P2O5, CuO, SO3, MgO
Lời giải:
Câu 4. Oxit nào sau đây khi tác dụng với nước tạo ra dung dịch có pH > 7?
A. CO2
B. SO2
C. CaO
D. P2O5
Lời giải:
Câu 5. Để nhận biết 3 khí không màu: SO2, O2, H2 đựng trong 3 lọ mất nhãn ta dùng:
A . Giấy quỳ tím ẩm
B . Giấy quỳ tím ẩm và dùng que đóm cháy dở còn tàn đỏ
C . Than hồng trên que đóm
D . Dẫn các khí vào nước vôi trong
Lời giải:
Giấy quỳ tím ẩm thì nhận biết được SO2 do SO2 tan trong nước tạo dung dịch axit làm quỳ hóa đỏ
Dùng que đóm cháy dở còn tàn đỏ nhận biết được khí O2 vì Oxi là chất duy trì sự sống và sự cháy nên sẽ quan sát được hiện tượng là tàn đóm bùng cháy
Câu 6. Tại sao trong phòng thí nghiệm người ta lại sử dụng phương pháp đẩy nước
A. Oxi nặng hơn không khí
B. Oxi nhẹ hơn không khí
C. Oxi ít tan trong nước
D. Oxi tan nhiều trong nước
Lời giải:
Câu 7. Từ 1,6 tấn quặng pirit sắt có chứa 60% FeS2 có thể sản xuất được bao nhiêu tấn axit H2SO4? Biết hiệu suất của quá trình phản ứng là 90%. Kết quả gần nhất với đáp án nào sau đây?
A. 1,4 tấn
B. 1,5 tấn
C. 1,6 tấn
D. 1,5 tấn
Lời giải:
Sơ đồ phản ứng: FeS2 → 2SO2 → 2SO3 → 2H2SO4
120 196
1,6.60% = 0,96 tấn → 1,568 tấn
=> khối lượng axit sunfuric thực tế thu được = 1,568.90% = 1,2544 tấn = 1411,2 kg
Đáp án cần chọn là: A
Câu 8. Chất nào dưới đây phản ứng với Fe tạo thành hợp chất Fe(II)?
A. Cl2
B. dung dịch HNO3 loãng
C. dung dịch AgNO3 dư
D. dung dịch HCl đặc
Lời giải:
2Fe + 3Cl2 → 2FeCl3
Fe + 3HNO3→ 2Fe(NO3)3 + NO + 2H2O
Fe + 3AgNO3→ Fe(NO3)3 + Ag
Fe + 2HCl → FeCl2 + H2
Câu 9. Nung Fe(NO3)2 trong bình kín, không có không khí, thu được sản phẩm gồm
A. FeO, NO.
B. Fe2O3, NO2 và O2.
C. FeO, NO2 và O2.
D. FeO, NO và O2.
Lời giải:
Đáp án: B
Câu 10. Hòa tan một oxit sắt vào dung dịch H2SO4 loãng dư được dung dịch X.
Chia dung dịch X làm 2 phần bằng nhau:
- Phần 1: Cho một ít vụn Cu vào thấy tan ra và cho dung dịch có màu xanh
- Phần 2: Cho một vài giọt dung dịch KMnO4 vào thấy bị mất màu.
Oxit sắt là
A. FeO.
B. Fe3O4.
C. Fe2O3.
D. FeO hoặc Fe2O3.
Lời giải:
Cho Cu vào dung dịch thấy tan ra và có màu xanh chứng tỏ trong dung dịch có Fe3+: Cu + 2Fe3+ → 2Fe2+ + Cu2+
Cho KMnO4 vào thấy dung dịch bị mất màu → chứng tỏ dung dịch có cả Fe2+ (xảy ra phản ứng oxi hóa khử giữa Fe2+ và KMnO4 do Mn(+7) + 5e → Mn+2 và Fe+2 → Fe+3 + 1e
Câu 11. Hòa tan Fe3O4 vào dung dịch HCl được dung dịch X. Chia X làm 3 phần:
Thêm NaOH dư vào phần 1 được kết tủa Y. Lấy Y để ngoài không khí.
Cho bột Cu vào phần 2.
Sục Cl2 vào phần 3.
Trong các quá trình trên có số phản ứng oxi hoá - khử là
A. 2.
B. 3.
C. 4.
D. 5.
Lời giải:
Phương trình phản ứng
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
X gồm FeCl2 và FeCl3
Cho phần 1 tác dụng với dung dịch NaOH:
FeCl3 + 3NaOH → Fe(OH)3 ↓nâu đỏ + 3NaCl
FeCl2 + 2NaOH → Fe(OH)2↓trắng xanh + 2NaCl
Y gồm: Fe(OH)2 và Fe(OH)3.
Sau khi để Y ngoài không khí: 4Fe(OH)2↓trắng xanh + O2 + 2H2O → 4Fe(OH)3↓nâu đỏ
Cho phần 2 vào Cu: Cu + 2FeCl3 → 2FeCl2 + 2CuCl2
Cho phần 3 vào Cl2: 2FeCl2 + Cl2 → 2FeCl3.
Câu 12. Cách nào sau đây có thể dùng để điều chế FeO?
A. Dùng CO khử Fe2O3 ở 500°C.
B. Nhiệt phân Fe(OH)2 trong không khí.
C. Nhiệt phân Fe(NO3)2
D. Đốt cháy FeS trong oxi.
Lời giải:
Câu 13. Hòa tan hoàn toàn 2,8 gam hỗn hợp FeO, Fe2O3 và Fe3O4 cần vừa đủ V ml dung dịch HCl 1M , thu được dung dịch X. Cho từ từ dung dịch NaOH dư vào dung dịch X thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi thu được 3 gam chất rắn. Tính V ?
A. 87,5ml
B. 125ml
C. 62,5ml
D. 175ml
Lời giải:
FeO, Fe2O3, Fe3O4 +HCl→ FeCl2,
FeCl3 + NaOH, toC Fe2O3
Coi hỗn hợp ban đầu gồm Fe, O.
nFe = 2nFe2O3 = 0,0375 mol
⇒ nO = 28-0,0375.5616 = 0,04375
Bảo toàn nguyên tố O → nH2O = nO = 0,04375
Bảo toàn nguyên tố H: nHCl = 2nH2O = 0,0875 mol → V = 87,5 ml.
Câu 14. Dãy các chất nào sau đây tan trong nước?
A. Al2O3, CaO, P2O5, CuO, CO2
B. CuO, CaO, P2O5, CO, CO2
C. Na2O, CaO, P2O5, SO3, SO2
D. Fe2O3, BaO, SO2, SO3, SO2
Lời giải:
Câu 15. Dãy các chất tác dụng với lưu huỳnh đioxit là:
A. Na2O, CO2, NaOH, Ca(OH)2
B. CaO, K2O, KOH, Ca(OH)2
C. HCl, Na2O, Fe2O3, Fe(OH)3
D. Na2O, CuO, SO3, CO2
Lời giải:
Câu 16. Nhận xét nào sau đây không đúng về H2SO4?
A. H2SO4 tan tốt trong nước
B. Ở điều kiện thường H2SO4 là chất rắn.
C. H2SO4 có tính axit mạnh.
D. H2SO4 đặc có tính háo nước.
Lời giải:
Câu 17. Trong các phản ứng sau đây, hãy chọn câu kết luận không đúng về H2SO4:
A. H2SO4 đặc nguội bị thụ đông trong các kim loại Al, Fe, Cr
B. Khi tiếp xúc với H2SO4 đặc dễ gây bỏng nặng
C. H2SO4 đặc là chất háo nước
D. Khi pha loãng axit sunfuric đặc, chỉ được cho từ từ nước và axit
Lời giải:
Khi pha loãng dung dịch axit đặc, ta cần đổ từ từ axit vào nước, do axit H2SO4 đặc là một chất rất háo nước, nên nếu không cẩn thận và biết cách xử lý sẽ dễ dàng gây nên bỏng
Câu 18. Trong các thí nghiệm cho kim loại tác dụng với H2SO4 đặc nóng, sau phản ứng thường sinh ra một lượng lớn khí SO2 (khí này rất độc, ảnh hưởng đến đường hô hấp …). Vì vậy để bảo vệ sức khỏe của người làm thí nghiệm, ta xử lý khí SO2 bằng:
A. Bông tẩm giấm ăn
B. Bông tẩm xút
C. Bông tẩm muối ăn
D. Bông tẩm KMnO4
Lời giải:
Người ta sẽ sử dụng bông tẩm xút để ngăn cản SO2 bay ra ngoài gây độc cho người làm thí nghiệm
SO2 + Ca(OH)2 → CaSO3 + H2O
Câu 19. Khí CO2 có lẫn SO2. Trong các hóa chất sau:
(1) dung dịch NaOH;
(2) dung dịch Br2;
(3) dung dịch KMnO4;
(4) dung dịch Na2SO3;
(5) nước vôi trong;
(6) khí O2.
Có bao nhiêu hóa chất có thể sử dụng để loại bỏ khí SO2 ra khỏi CO2.
A. 4
B. 5
C. 3
D. 2
Lời giải:
Để loại khí SO2 ra khỏi khí CO2 thì cần xác định dung dịch nào tác dụng được với SO2 mà không tác dụng với CO2
Các hóa chất có thể dùng để loại khí SO2 ra khỏi CO2 là:
(2) dung dịch Br2;
(3) dung dịch KMnO4;
(4) dung dịch Na2SO3
Câu 20. Trong công nghiệp, từ khí SO2 và oxi, phản ứng hóa học tạo thành SO3 xảy ra ở điều kiện nào sau đây?
A. Nhiệt độ phòng.
B. Đun nóng đến 500oC.
C. Đun nóng đến 500oC và có mặt xúc tác V2O5.
D. Nhiệt độ phòng và có mặt chất xúc tác V2O5.
Lời giải:
Trong công nghiệp người ta sản xuất lưu huỳnh trioxit bằng cách oxi hóa lưu huỳnh đioxit
4FeS2 + 11O2→ 2Fe2O3 + 8SO2↑
2SO2+ O2 ⇆ 2SO3 (nhiệt độ xúc tác V2O5)
Xem thêm các phương trình hóa học khác:
FeS2 + HNO3 → Fe(NO3)3 + H2SO4 + NO + H2O
FeS2 + H2SO4 → Fe2(SO4)3 + SO2 + H2O
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)