S + HNO3 → H2SO4 + NO2 + H2O | S ra NO2
S + HNO3 → H2SO4 + NO2 + H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng S + HNO3 → H2SO4 + NO2 + H2O
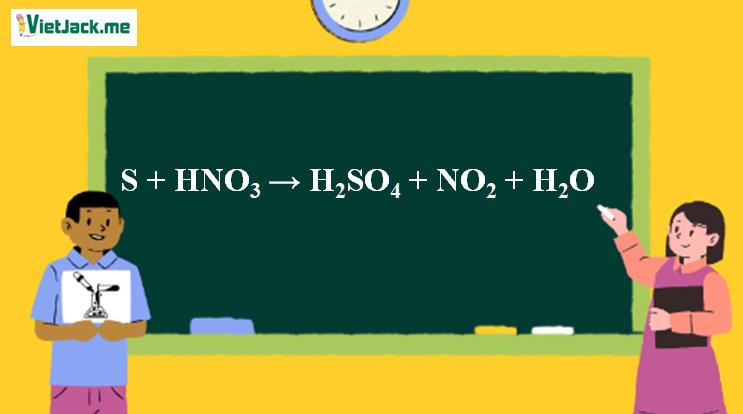
1. Phương trình S thể hiện tính khử
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
S thể hiện tính khử khi tác dụng có tính oxi hóa mạnh.
2. Điều kiện phản ứng xảy ra giữa S và HNO3
Nhiệt độ, HNO3 đặc.
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của S (Lưu huỳnh)
- Trong phản ứng trên S là chất khử.
- S thể hiện tính khử khi tác dụng với các chất có tính oxi hoá mạnh như H2SO4 đặc, HNO3 đặc, ...
3.2. Bản chất của HNO3 (Axit nitric)
- Trong phản ứng trên HNO3 là chất oxi hoá.
- HNO3 là một monoaxit mạnh, có tính oxi hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ.
4. Tính chất hóa học của lưu huỳnh
4.1. Tác dụng với kim loại và hidro
S thể hiện tính oxi hóa khi tác dụng với kim loại và hidro.
-
Tác dụng với hiđro:
H2 + S → H2S (350oC)
-
Tác dụng với kim loại (có to, tạo sản phẩm có số oxh thấp của kim loại).
Fe + S FeS
Zn + S ZnS
Hg + S HgS
(Thủy phân sunfua, phản ứng xảy ra ở nhiệt độ thường nên thường dùng S khử độc Hg)
Chú ý: Một số muối sunfua có màu đặc trưng: CuS, PbS, Ag2S (màu đen); MnS (màu hồng); CdS (màu vàng) → thường được dùng để nhận biết gốc sunfua.
- Muối sunfua được chia thành 3 loại:
+ Loại 1. Tan trong nước gồm Na2S, K2S, CaS và BaS, (NH4)2S.
+ Loại 2. Không tan trong nước nhưng tan trong axit mạnh gồm FeS, ZnS, ...
+ Loại 3. Không tan trong nước và không tan trong axit gồm CuS, PbS, HgS, Ag2S, ...
4.2. Tác dụng với phi kim và hợp chất
S thể hiện tính khử khi tác dụng với 1 số phi kim và 1 số hợp chất có tính oxi hóa.
-
Tác dụng với oxi:
S + O2 SO2
S + F2 SF6
-
Tác dụng với các chất có tính oxi hóa mạnh:
S + H2SO4 đặc 3SO2 + 2H2O
S + 4HNO3 đặc 2H2O + 4NO2 + SO2
5. Ứng dụng của S
Lưu huỳnh được sử dụng trong nhiều sản phẩm công nghiệp, ví dụ như: Ắc quy, bột giặt, lưu hóa cao su, thuốc diệt nấm và các phân bón photphat. Cụ thể, được lưu huỳnh được sử dụng để tạo nên độ trắng của giấy, làm chất bảo quản trong rượu vang và làm khô hoa quả. Do bản chất dễ cháy, lưu huỳnh còn được ứng dụng trong sản xuất các loại diêm, thuốc súng, thuốc nổ cũng như pháo hoa…
6. Tính chất hóa học của HNO3
- Axit nitric là một dung dịch nitrat hydro có công thức hóa học HNO3 . Đây là một axit khan, là một monoaxit mạnh, có tính oxy hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ, có hằng số cân bằng axit (pKa) = −2.
- Axit nitric là một monoproton chỉ có một sự phân ly nên trong dung dịch, nó bị điện ly hoàn toàn thành các ion nitrat NO3− và một proton hydrat, hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
- Axit nitric có tính chất của một axit bình thường nên nó làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
- Axit nitric tác dụng với kim loại: Tác dụng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO + H2O ( to)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
- Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
- Tác dụng với phi kim (các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nito dioxit nếu là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
- Tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
- Tác dụng với hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan trong HNO3, HgS không tác dụng với HNO3.
- Tác dụng với nhiều hợp chất hữu cơ: Axit nitric có khả năng phá hủy nhiều hợp chất hữu cơ, nên sẽ rất nguy hiểm nếu để axit này tiếp xúc với cơ thể người.
7. Bài tập vận dụng
Câu 1. Dẫn khí SO2 qua 200 ml dung dịch Ca(OH)2 xM thu được 21,7 g kết tủa, thêm tiếp dung dịch NaOH đến dư vào lại thu thêm 10,85 gam kết tủa nữa. Tính x
A. 0,75M
B. 1,5M
C. 0,5M
D. 0,25M
Lời giải:
Đáp án: A
Giải thích:
Thêm NaOH lại thu thêm kết tủa, chứng tỏ trong dung dịch tồn tại muối Ca(HSO3)2, mà vẫn có kết tủa
→ tồn tại 2 muối
n↓(1) = 21,7/217 = 0,1 mol
n↓(2) = 10,85/217 = 0,05 mol
Ca(OH)2 + SO2 → CaSO3 ↓+ H2O
0,1 0,1
Ca(OH)2 + 2SO2 → Ca(HSO3)2
0,05 ← 0,05
Ca(HSO3)2 + 2NaOH → CaSO3 ↓ + Na2SO3 + 2H2O
0,05 ← 0,05
nCa(OH)2 = 0,1 + 0,05 = 0,15 mol → a = = 0,75M
Cách 2: ∑n↓ = 0,1 + 0,05 = 0,15 mol
Ca(OH)2 → CaSO3
0,15 ← 0,15
→ a = 0,15/0,2 = 0,75M
Câu 2. Đung nóng 9,75 gam kali với một phi kim X dư thu được 13,75 gam muối. Hỏi X là phi kim nào sau đây?
A. Cl
B. Br
C. S
D. N
Lời giải:
Đáp án: C
Câu 3. Chỉ ra câu trả lời không đúng về khả năng phản ứng của lưu huỳnh?
A. S vừa có tính oxi hoá vừa có tính khử.
B. Hg phản ứng với S ngay nhiệt độ thường.
C. Ở nhiệt độ thích hợp, S tác dụng với hầu hết các phi kim và thể hiện tính oxi hóa.
D. Ở nhiệt độ cao, S tác dụng với nhiều kim loại và thể hiện tính oxi hoá.
Lời giải:
Đáp án: C
Giải thích:
Câu không đúng là: Ở nhiệt độ thích hợp, S tác dụng với hầu hết các phi kim và thể hiện tính oxi hóa.
Vì S phản ứng với oxi thể hiện tính khử: S + O2 → SO2 (nhiệt độ)
Câu 4. Lưu huỳnh tác dụng với axit sunfuric đặc, nóng: S + 2H2SO4 → 3SO2 + 2H2O. Trong phản ứng này, tỉ lệ số nguyên tử lưu huỳnh bị khử : số nguyên tử lưu huỳnh bị oxi hóa là
A. 1 : 2
B. 1 : 3
C .3 : 1
D. 2 : 1
Lời giải:
Đáp án: D
Giải thích:
S + 2H2SO4 → 3SO2 + 2H2O
S là chất khử, H2SO4 là chất oxi hóa
=> tỉ lệ số nguyên tử lưu huỳnh bị khử : số nguyên tử lưu huỳnh bị oxi hóa là 2 : 1
Câu 5. Hơi thủy ngân rất độc, do đó phải thu hồi thủy ngân rơi vãi bằng cách
A. Nhỏ nước brom lên giọt thủy ngân.
B. Nhỏ nước ozon lên giọt thủy ngân.
C. Rắc bột lưu huỳnh lên giọt thủy ngân.
D. Rắc bột photpho lên giọt thủy ngân.
Lời giải:
Đáp án: C
Giải thích:
Hơi thủy ngân rất độc, do đó phải thu hồi thủy ngân rơi vãi bằng cách rắc bột lưu huỳnh lên giọt thủy ngân.
Câu 6. Tính chất vật lí nào sau đây không phải của lưu huỳnh
A. chất rắn màu vàng, giòn
B. không tan trong nước
C. có nhiệt độ nóng chảy thấp hơn nhiệt độ sôi của nước
D. tan nhiều trong benzen, ancol etylic
Lời giải:
Đáp án: D
Câu 7. Hơi thủy ngân rất dộc, bởi vậy khi làm vỡ nhiệt kế thủy ngân thì chất bột được dùng để rắc lên thủy ngân rồi gom lại là
A. vôi sống.
B. cát.
C. muối ăn.
D. lưu huỳnh.
Lời giải:
Đáp án: D
Giải thích:
Thủy ngân tác dụng với lưu huỳnh ngay tại điều kiện thường:
Hg + S → HgS ↓
Do đó khi làm vỡ nhiệt kế thuỷ ngân thì chất bột được dùng để rắc lên thuỷ ngân rồi gom lại là lưu huỳnh.
Câu 8. Đun nóng 4,8 gam bột Mg với 9,6 gam bột lưu huỳnh (trong điều kiện không có không khí), thu được chất rắn X. Cho toàn bộ X vào lượng dư dung dịch HCl, thu được V lít khí (đktc). Giá trị của V là
A. 2,24
B. 3,36
C. 4,48
D. 6,72
Lời giải:
Đáp án: C
Giải thích:
Phương trình hóa học
Mg + S MgS
nMg = 4,8/24 = 0,2 (mol);
nS = 9,6/32 = 0,3 (mol)
Xét tỉ lệ số mol ⇒ S dư; lượng chất các chất trong bài tính theo số mol của Mg
nMg = nMgS = 0,2 (mol)
Phương trình hóa học
MgS + 2HCl → MgCl2 + H2S ↑
⇒ V = 0,2.22,4 = 4,48 (lít)
Câu 9. Cho 11 gam hỗn hợp bột sắt và bột nhôm tác dụng với bột lưu huỳnh trong điều kiện không có không khí) thấy có 12,8 gam lưu huỳnh tham gia phản ứng. Khối lượng sắt có trong 11 gam hỗn hợp đầu là
A. 5,6 gam.
B. 11,2 gam.
C. 2,8 gam.
D. 8,4 gam.
Lời giải:
Đáp án: A
Giải thích:
nS = 12,8/32 = 0,4 (mol)
⇒ mhh = mFe + mAl
Bảo toàn electron: 2nFe+ 3nAl = 2nS
⇒ 56nFe + 27nAl = 11 ; 2nFe + 3nAl = 2.0,4)
⇒ nFe = 0,1 nAl = 0,2) ⇒ mFe = 0,1.56 = 5,6 (gam)
Câu 10. Đun nóng 9,6 gam bột Mg với 9,6 gam bột lưu huỳnh trong điều kiện không có không khí, thu được hỗn hợp rắn A. Hòa tan hoàn toàn A vào dung dịch HCl dư, thu được hỗn hợp khí B. Xác định khối lượng mol khí B
A. 9
B. 13
C. 26
D. 5
Lời giải:
Đáp án: C
Giải thích:
Phương trình hóa học
Mg + S → MgS
MgS + 2HCl → MgCl2 + H2S
Mg + 2HCl → MgCl2 + H2
nMg = 0,4 (mol); nS = 0,3 (mol)
nH2S = nMgS = nS = 0,3 mol;
nH2 = nMg (dư)= 0,4 – 0,3 = 0,1 (mol)
=> MY = (0,3.34 + 0,1.2)/(0,3 + 0,1) = 26
Câu 11. Hấp thụ 3,36 lít khí SO2 (đktc) vào 200 ml dung dịch KOH xM. Tính a biết sau phản ứng chỉ thu được muối trung hòa.
A. 0,75M
B. 1,5M
C. 0,5M
D. 0,25M
Lời giải:
Đáp án: A
Giải thích:
Vì đề cho chỉ tạo muối trung hòa nên chỉ xảy ra phản ứng
SO2 + 2KOH → K2SO3 + H2O
0,15 → 0,3
nSO2 = 0,15 mol ,
VKOH= 200 ml = 0,2 lít
→ a = CMKOH= 0,15/0,2 = 0,75M
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
