BaO + H2O → Ba(OH)2 | BaO ra Ba(OH)2
BaO + H2O → Ba(OH)2 là phản ứng hóa hợp. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng BaO + H2O → Ba(OH)2
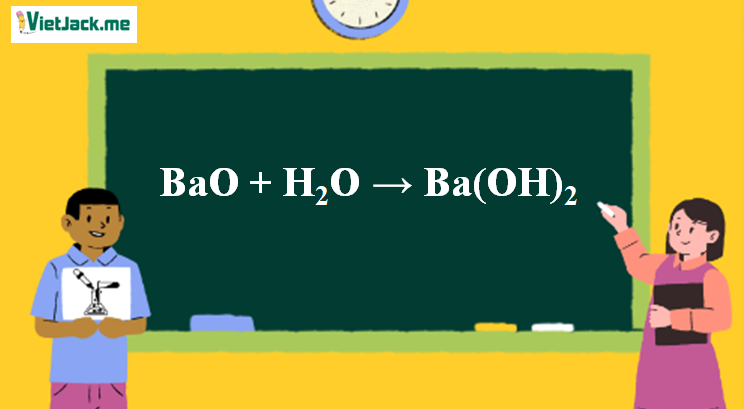
1. Phương trình phản ứng BaO và H2O
BaO + H2O → Ba(OH)2
2. Điều kiện phản ứng xảy ra giữa BaO và H2O
Nhiệt độ phòng
3. Bản chất của BaO (Bari oxit) trong phản ứng
BaO mang đầy đủ tính chất hoá học của oxit bazo nên tác dụng được với muối.
4. Tính chất của BaO
4.1. Tính chất vật lí & nhận biết
- Tính chất vật lý: là chất rắn có màu trắng, nhiệt độ nóng chảy 1923oC, khả năng hút ấm mạnh.
- Nhận biết: Đem hòa tan bari oxit vào nước, tan tốt trong nước, tỏa nhiệt mạnh
BaO + H2O → Ba(OH)2
4.2. Tính chất hóa học
Mang đầy đủ tính chất hóa học của oxit bazơ.
Tác dụng với nước:
BaO + H2O → Ba(OH)2
Tác dụng với axit:
BaO + 2HCl → BaCl2 + H2O
BaO + H2SO4 → BaSO4 + H2O
Tác dụng với oxit axit:
BaO + CO2 → BaCO3
5. Ứng dụng của BaO
- BaO được dùng trong vật liệu gốm nhóm trợ chảy. Nó có thể kết hợp với một số loại oxit khác tạo ra một số màu độc đáo; như kết hợp với đồng cho màu ngọc lam nổi tiếng.
- Oxit bari còn được nhiều người biết đến vì nó có thể cho mặt men "xỉn" mịn.
6. Tính chất hóa học của H2O
6.1. Nước tác dụng với kim loại
Ở điều kiện thường, nước có thể phản ứng với các kim loại mạnh như Li, Ca, Na, K, Ba,… để tạo thành dung dịch Bazo và khí Hidro.
H2O + Kim loại → Bazơ + H2↑
2M + 2nH2O → 2M(OH)n + nH2↑
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Ca + 2H2O → Ca(OH)2 + H2
Ba + 2H2O → Ba(OH)2 + H2
Đặc biệt, một số kim loại trung bình như Mg, Zn, Al, Fe,…phản ứng được với hơi nước ở nhiệt độ cao tạo ra oxit kim loại và hidro. Bên cạnh đó, kim loại Mg tan rất chậm trong nước nóng.
6.2. Nước tác dụng với oxit bazo
Nước tác dụng với một số oxit bazo như Na2O, CaO , K2O,… tạo thành dung dịch bazo tương ứng. Dung dịch bazo làm cho quỳ tím hóa xanh.
H2O + Oxit bazơ → Bazơ
Na2O + H2O → 2NaOH
Li2O + H2O→ 2LiOH
K2O + H2O→ 2KOH
CaO + H2O → Ca(OH)2
6.3. Nước tác dụng với oxit axit
Nước tác dụng với oxit axit tạo thành axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ.
H2O + Oxit axit → Axit
CO2 + H2O → H2CO3
SO2 + H2O → H2SO3
P2O5 + 3H2O → 2H3PO4
SO3 + H2O → H2SO4
N2O5 + H2O → 2HNO3
Câu 1. Sục khí SO2 vào cốc đựng nước cất, cho quỳ tím vào dung dịch thu được, quỳ tím sẽ:
A. chuyển màu đỏ.
B. chuyển màu xanh.
C. chuyển màu vàng.
D. mất màu.
Lời giải:
Đáp án: A
Câu 2. Dãy các chất nào sau đây tan trong nước?
A. CaO, BaO, Al2O3, CuO
B. CuO, Al2O3, K2O, Na2O
C. Na2O, CO2, SO3, K2O
D. CO2, CuO, Na2O, FeO
Lời giải:
Đáp án: C
Câu 3. Cặp chất tác dụng với nhau sẽ tạo ra khí lưu huỳnh đioxit là:
A. CaCO3 và HCl
B. Na2SO3 và H2SO4
C. CuCl2 và KOH
D. K2CO3 và HNO3
Lời giải:
Đáp án: B
Câu 4. Hòa tan 2,4 gam oxit của một kim loại hóa trị II vào 21,9 gam dung dịch HCl 10% thì vừa đủ. Oxit đó là:
A. CuO
B. CaO
C. MgO
D. FeO
Lời giải:
Đáp án: A
Câu 5. Dãy các chất tác dụng với lưu huỳnh đioxit là:
A. Na2O, CO2, NaOH, Ca(OH)2
B. CaO, K2O, KOH, Ca(OH)2
C. HCl, Na2O, Fe2O3, Fe(OH)3
D. Na2O, CuO, SO3, CO2
Lời giải:
Đáp án: B
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
