Fe2(SO4)3 + NaOH → Na2SO4 + Fe(OH)3↓ | Fe2(SO4)3 ra Fe(OH)3 | NaOH ra Na2SO4 | NaOH ra Fe(OH)3
Fe2(SO4)3 + NaOH → Na2SO4 + Fe(OH)3↓ là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Fe2(SO4)3 + NaOH → Na2SO4 + Fe(OH)3
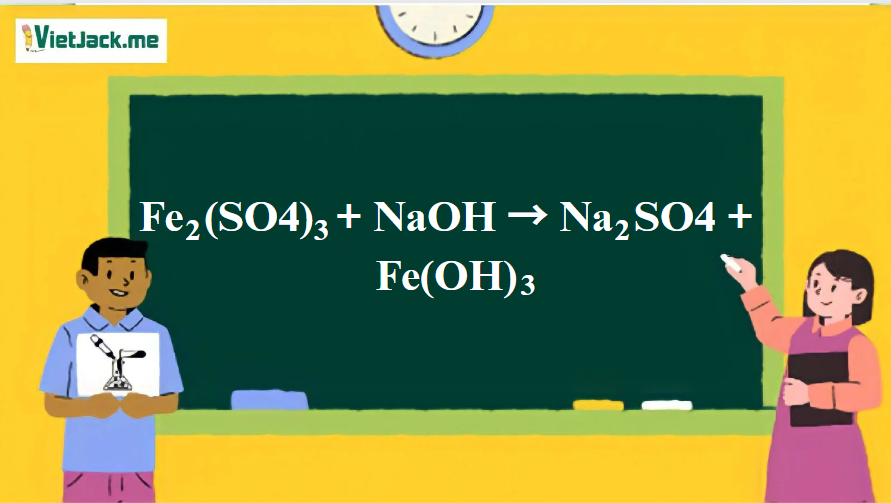
1. Phương trình phản ứng giữa Fe2(SO4)3 và NaOH
Fe2(SO4)3 + 6NaOH → 3Na2SO4 + 2Fe(OH)3↓
2. Điều kiện phản ứng
- Nhiệt độ phòng.
3. Cách thực hiện phản ứng
- Cho Fe2(SO4)3 tác dụng với dung dịch NaOH
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của Fe2(SO4)3
- Trong phản ứng trên, Fe2(SO4)3 có đầy đủ tính chất của muối, tác dụng với dung dịch kiềm
4.2. Bản chất của NaOH
- NaOH tác dụng với dung dịch muối sẽ tạo thành muối mới và bazơ mới.
5 Tính chất hóa học của Fe2(SO4)3
Fe2(SO4)3 thuộc nhóm muối axit nên nó có các tính chất hóa học như sau:
5.1 Tính oxy hóa: Fe2(SO4)3 dễ bị khử về muối sắt II hoặc kim loại sắt.
Fe3+ + 1e → Fe2+
Fe3+ + 3e → Fe
Fe + Fe2(SO4)3 → 3FeSO4
3Zn + Fe2(SO4)3 → Fe + 3ZnSO
5.2 Phản ứng với dung dịch kiềm
Fe2(SO4)3 + 3Ba(OH)2 → 3BaSO4 ↓(trắng) + 2Fe(OH)3 ↓(nâu đỏ)
NaOH + Fe2(SO4)3 → 3Na2SO4 + Fe(OH)3
6. Tính chất vật lý của Fe2(SO4)3
- Tan tốt trong nước, cho dung dịch có màu vàng nhạt.
- Thường tồn tại ở dạng tinh thể.
- Nóng chảy ở 480độC.
Nhận biết: Sử dụng dung dịch Ba(OH)2, thu được kết tủa màu nâu đỏ và kết tủa trắng.
Fe2(SO4)3 + 3Ba(OH)2 → 3BaSO4 ↓(trắng) + 2Fe(OH)3 ↓(nâu đỏ).
7. Tính chất hóa học của NaOH
7.1 Làm đổi màu chất chỉ thị
Dung dịch NaOH làm quỳ tím chuyển thành màu xanh.
Dung dịch NaOH làm phenolphthalein không màu chuyển sang màu đỏ, đổi màu methyl da cam thành màu vàng.
7.2 Natri hidroxit tác dụng với oxit axit
Khi tác dụng với axit và oxit axit trung bình, yếu thì tùy theo tỉ lệ mol các chất tham gia mà muối thu được có thể là muối axit, muối trung hòa hay cả hai.
Phản ứng với oxit axit: NO2, SO2, CO2...
Ví dụ:
2NaOH + SO2 → Na2SO3 + H2O
NaOH + SO2→ NaHSO3
2NaOH + 2NO2→ H2O + NaNO2 + NaNO3 (tạo 2 muối )
NaOH + CO2 → NaHCO3
2NaOH + CO2→ Na2CO3 + H2O
3NaOH + P2O5 → Na3PO4↓ + 3H2O
NaOH + SiO2 → Na2SiO3
Phản ứng với SiO2 là phản ứng ăn mòn thủy tinh vì thế khi nấu chảy NaOH, người ta dùng các dụng cụ bằng sắt, niken hay bạc mà không dùng thủy tinh để chứa NaOH.
7.3 Natri hidroxit tác dụng với axit
Là một bazơ mạnh nên tính chất đặc trưng của NaOH là tác dụng với axit tạo thành muối tan và nước. Phản ứng này còn gọi là phản ứng trung hòa.
Ví dụ:
NaOH + HCl → NaCl+ H2O
NaOH + HNO3→ NaNO3+ H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
3NaOH + H3PO4→ Na3PO4 + 3H2O
2NaOH + H2CO3 → Na2CO3 + 2H2O
7.4 Natri hidroxit tác dụng với muối
Natri hidroxit tác dụng với dung dịch muối tạo thành muối mới và bazơ mới.
Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
Ví dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2⏐↓
NaOH + MgSO4→ Mg(OH)2 + Na2SO4
2NaOH + MgCl2 → 2NaCl + Mg(OH)2
FeCl3 + 3NaOH → Fe(OH)3+ 3NaCl
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
2NaOH + FeSO4 → Na2SO4 + Fe(OH)2↓ nâu đỏ
7.5 Natri hidroxit tác dụng với một số phi kim như Si, C, P, S, Halogen
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
C + NaOH nóng chảy → 2Na + 2Na2CO3 + 3H2↑
4P trắng + 3NaOH + 3H2O → PH3↑ + 3NaH2PO2
Cl2+ 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6NaOH → NaCl + NaClO3 + 3H2O
7.6 Dung dịch NaOH có khả năng hoà tan một hợp chất của kim loại lưỡng tính Al, Zn, Be Sn Pb
Ví dụ: Al, Al2O3, Al(OH)3
2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2↑
2NaOH + Al2O3→ 2NaAlO2 + H2O
NaOH + Al(OH)3→ NaAlO2 + 2H2O
Chất được tạo ra trong dung dịch có thể chứa ion Na[Al(OH)4], hoặc có thể viết
Al(OH)3 + NaOH → Na[Al(OH)4]
Tương tự, NaOH có thể tác dụng với kim loại Be, Zn, Sb, Pb, Cr và oxit và hiđroxit tương ứng của chúng.
8. Hiện tượng nhận biết phản ứng
- Xuất hiện kết tủa đỏ nâu Fe(OH)3 trong dung dịch
9. Ví dụ minh họa
Ví dụ 1: Xác định hiện tượng đúng khi đốt dây thép trong oxi.
A. Thấy xuất hiện muội than màu đen.
B. Dây thép cháy sáng mạnh.
C. Dây thép cháy sáng mạnh tạo thành những tia sáng bắn tóe ra đồng thời có các hạt màu nâu sinh ra.
D. Dây thép cháy sáng lên rồi tắt ngay.
Hướng dẫn giải
Đáp án : C
Ví dụ 2: Cho kim loại X tác dụng với S nung nóng thu được chất Y. Cho Y tác dụng với dung dịch HCl thu được khí Z có mùi trứng thối. X là kim loại nào?
A. Cu B. Fe C. Pb D. Ag
Hướng dẫn giải
Fe + S → FeS;
FeS + HCl → FeCl2 + H2S
Đáp án : B
Ví dụ 3: Phản ứng nào sau đây tạo ra sản phẩm là muối sắt (II) sunfua
A. Sắt (II)clorua tác dụng với dung dịch hidrosunfua.
B. Sắt tác dụng với dung dịch natrisunfua.
C. Sắt tác dụng với đồng sunfua nung nóng.
D. Sắt tác dụng với bột lưu huỳnh nung nóng.
Hướng dẫn giải
Fe không phản ứng với Na2S; CuS
FeCl2 không phản ứng với H2S
Đáp án : D
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
