Mg + HNO3 → Mg(NO3)2 + NO + H2O | Mg ra Mg(NO3)2
Mg + HNO3 → Mg(NO3)2 + NO + H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Mg + HNO3 → Mg(NO3)2 + NO + H2O
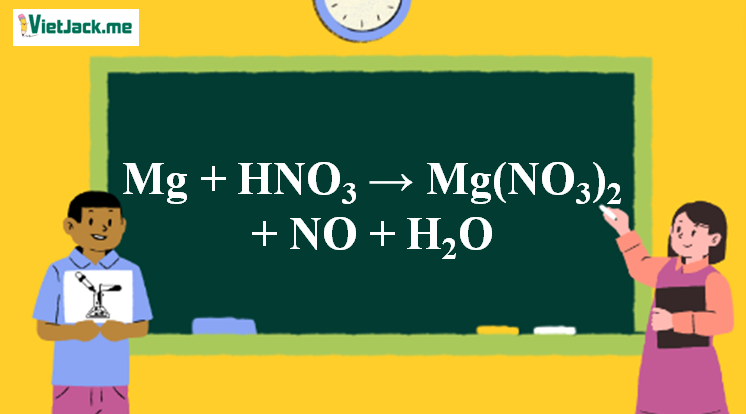
1. Phương trình phản ứng Mg tác dụng HNO3 loãng
3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O
2. Cân bằng phương trình Mg + HNO3→ Mg(NO3)2 + NO + H2O bằng phương pháp cân bằng electron
Mg0 + HN+5O3 → Mg+2(NO3)2 + N+2O ↑ + H2O
|
3x 2x |
Mg → Mg+2 + 2e N+5 + 3e → N+2 |
3Mg + 2HNO3 → 3Mg(NO3)2 + 2NO + H2O
Sau đó thêm 6 gốc NO3- (trong đó N không thay đổi số oxi hóa) nghĩa là tất cả có 8HNO3
Cuối cùng ta có:
3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O
Các bước cân bằng phản ứng oxi hoá - khử theo phương pháp thăng bằng electron
Bước 1: Xác định số oxi hoá của những nguyên tố thay đổi số oxi hoá.
Bước 2: Viết quá trình oxi hoá và quá trình khử, cân bằng mỗi quá trình:
+ Dấu "+e" đặt bên có số oxi hoá lớn.
+ Số e = số oxi hoá lớn - số oxi hoá bé.
+ Nhân cả quá trình với chỉ số của nguyên tố thay đổi số oxi hoá nếu chỉ số khác 1 (với các đơn chất có thể chấp nhận giữ nguyên chỉ số).
Bước 3. Tìm hệ số thích hợp sao cho tổng số e cho bằng tổng số e nhận:
+ Tìm bội chung nhỏ nhất của số e nhường và nhận.
+ Lấy bội chung nhỏ nhất chia cho số e ở từng quá trình được hệ số.
Bước 4. Đặt hệ số của chất oxi hoá và chất khử vào sơ đồ phản ứng và kiểm tra lại.
3. Phương trình ion thu gọn của Mg + HNO3 loãng
Phương trình ion:
3Mg + 8H+ + 5NO3- → 3Mg2+ + 3NO3- + 2NO + 4H2O
Phương trình ion thu gọn:
3Mg + 8H+ + 5NO3− → 3Mg2+ + NO + 4H2O
4. Điều kiện phản ứng Mg tác dụng với dung dịch HNO3 loãng
Điều kiện: Không có
5. Cách tiến hành phản ứng cho Mg tác dụng với dung dịch HNO3 loãng
Cho miếng Mg tác dụng với dung dịch axit nitric HNO3 loãng.
6. Hiện tượng hóa học
Hiện tượng sau phản ứng thoát ra khí không màu NO hóa nâu trong không khí.
7. Bản chất của các chất tham gia phản ứng
7.1. Bản chất của Mg (Magie)
- Trong phản ứng trên Mg là chất khử.
- Mg là chất khử mạnh tác dụng với axit HCl, HNO3, H2SO4,..
7.2. Bản chất của HNO3 (Axit nitric)
- Trong phản ứng trên HNO3 là chất oxi hoá.
- Đây là một monoaxit mạnh, có tính oxi hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ.
8. Thông tin thêm: Axit Nitric tác dụng với kim loại
Axit nitric tác dụng với kim loại trừ Au và Pt tạo muối và nhiều sản phẩm oxi hóa khác nhau như NO2, NO, N2O ,N2, NH4NO3
Sản phẩm khử của N+5 sinh ra tùy thuộc vào độ mạnh yếu của kim loại và nồng độ của dung dịch axit, thông thường thì:
Dung dịch HNO3 đặc tác dụng với kim loại → NO2;
Dung dịch HNO3 loãng tác dụng với kim loại khử yếu (như: Cu, Pb, Ag,..) → NO;
Dung dịch HNO3 loãng tác dụng với kim loại mạnh (như: Al, Mg, Zn,...) thì N bị khử xuống mức
càng sâu → (N2, N2O, NH4NO3).
Cách phân biệt các khí sản phẩm sinh ra
N2O là khí gây cười
N2 không duy trì sự sống, sự cháy
NO2 có màu nâu đỏ
NO khí không màu nhưng bị oxit hóa thành NO2 màu nâu đỏ
NH4NO3 không sinh ra ở dạng khí, khi cho kiềm vào kim loại thấy có mùi khai amoniac NH3
NH4NO3 + NaOH → NaNO3 + NH3 + H2O
9. Mở rộng kiến thức về Mg
9.1. Tính chất vật lí và nhận biết
Tính chất vật lí:
- Magiê là kim loại tương đối cứng, màu trắng bạc, nhẹ.
- Mg có khối lượng riêng là 1,737 (g/cm3); có nhiệt độ nóng chảy là 6480C và sôi ở 10950C.
Nhận biết:
Đốt cháy các hợp chất của Canxi, cho ngọn lửa màu da cam.
9.2. Tính chất hóa học
Magie là chất khử mạnh:
Mg → Mg2+ + 2e
a. Tác dụng với phi kim
Lưu ý:
Do Mg có ái lực lớn với oxi: 2Mg + CO2 → MgO. Vì vậy không dùng tuyết cacbonic để dập tắt đám cháy Mg.
b. Tác dụng với axit
- Với dung dịch HCl và H2SO4 loãng:
Mg + H2SO4 → MgSO4 + H2
- Với dung dịch HNO3:
4Mg + 10 HNO3 → 4 Mg(NO3)2 + NH4NO3 + 3 H2O
c. Tác dụng với nước
Ở nhiệt độ thường, Mg hầu như không tác dụng với nước. Mg phản ứng chậm với nước nóng (do tạo thành hidroxit khó tan).
Mg + 2H2O → Mg(OH)2 + H2
9.3. Trạng thái tự nhiên
- 24Mg là đồng vị ổn định có ứng dụng trong địa chất học, tương tự như 26Al. 24Mg là sản phẩm phân rã của 26Al, có chu kỳ bán rã 717.000 năm.
- Magiê được tìm thấy trong hơn 60 khoáng chất, nhưng chỉ có đôlômit, magnesit, bruxit, cacnalit, bột tan, và ôlivin là có giá trị thương mại.
9.4. Điều chế
Điện phân nóng chảy muối magie clorua.
9.5. Ứng dụng
Magie giúp giảm đau nửa đầu.
Magie giúp giảm huyết áp.
Magie giúp ngăn ngừa bệnh tiểu đường.
Magie giúp điều trị táo bón.
Magie được sử dụng để điều trị viêm loét dạ dày.
10. Tính chất hóa học của HNO3
- Axit nitric là một dung dịch nitrat hydro có công thức hóa học HNO3 . Đây là một axit khan, là một monoaxit mạnh, có tính oxy hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ, có hằng số cân bằng axit (pKa) = −2.
- Axit nitric là một monoproton chỉ có một sự phân ly nên trong dung dịch, nó bị điện ly hoàn toàn thành các ion nitrat NO3− và một proton hydrat, hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
- Axit nitric có tính chất của một axit bình thường nên nó làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
- Axit nitric tác dụng với kim loại: Tác dụng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO + H2O ( to)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
- Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
- Tác dụng với phi kim (các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nito dioxit nếu là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
- Tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
- Tác dụng với hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan trong HNO3, HgS không tác dụng với HNO3.
- Tác dụng với nhiều hợp chất hữu cơ: Axit nitric có khả năng phá hủy nhiều hợp chất hữu cơ, nên sẽ rất nguy hiểm nếu để axit này tiếp xúc với cơ thể người.
11. Bài tập vận dụng liên quan
Câu 1. Nhận định nào sau đây là sai?
A. HNO3 phản ứng với tất cả bazơ.
B. HNO3 (loãng, đặc, nóng) phản ứng với hầu hết kim loại trừ Au, Pt.
C. Tất cả các muối amoni khi nhiệt phân đều tạo khí amoniac.
D. Hỗn hợp muối nitrat và hợp chất hữu cơ nóng chảy có thể bốc cháy.
Lời giải:
C sai vì muối amoni chứa gốc axit có tính oxi hóa như NH4NO3 hay NH4NO2 khi nhiệt phân cho ra N2O; N2.
Câu 2. Nhận định nào sau đây đúng về tính chất hóa học axit nitric?
A. HNO3 là axit yếu nhưng có tính oxi hóa rất mạnh.
B. HNO3 là axit mạnh vừa có tính oxi hóa, vừa có tính khử.
C. HNO3 là axit mạnh có tính oxi hóa mạnh ở mọi nồng độ.
D. HNO3 là axit mạnh, tính oxi hóa mạnh oxi hóa được cả kim loại vàng.
Lời giải:
A sai vì HNO3 là axit mạnh và có tính oxi hóa rất mạnh.
B sai HNO3 là axit mạnh nhưng chỉ có tính oxi hóa.
C đúng HNO3 là axit mạnh có tính oxi hóa mạnh ở mọi nồng độ.
D sai vì HNO3 là axit mạnh, tính oxi hóa mạnh nhưng không oxi hóa được kim loại vàng.
Câu 3. Hòa tan hoàn toàn 3,6 gam Mg vào dung dịch HNO3 loãng sau phản ứng thu được khí không màu hóa nâu trong không khí (sản phẩm khử duy nhất). Tính thể tích khí thu được ở đktc là:
| A. 2,24 | B. 4,48 | C. 3,36 | D. 8,96 |
Lời giải:
nMg = 0,15 mol
Khí không màu hóa nâu trong không khí là NO
Mg0→ Mg2+ + 2e
N+5 + 3e → N+2
Bảo toàn electron:
2.nMg= 3.nNO
=> nNO =0,1 mol => V = 0,1.22,4 = 2,24 lít
Câu 4. Chọn phát biểu đúng:
A. Dung dịch K2CO3 có tính kiềm mạnh, đổi màu quỳ tím thành xanh
B. Dung dịch K2CO3 có môi trường trung tính có K2CO3 là muối axit.
C. Dung dịch chứa K2CO3 có môi trường axit do K2CO3 là muối của axit yếu.
D. K2CO3 dễ bị phân hủy khi đun nóng.
Lời giải:
A đúng vì Dung dịch K2CO3 có tính kiềm mạnh, đổi màu quỳ tím thành xanh
B sai vì Dung dịch K2CO3 được tạo nên từ bazo mạnh là KOH và axit yếu là H2CO3 do đó có có môi trường bazo, K2CO3 không phải mua axit
C Sai
D Sai vì K2CO3 không bị phân hủy khi đun nóng.
Câu 5. Dãy chất nào dưới đây không phản ứng với HNO3 đặc nguội
A. Zn, Al, Cu
B. Cu, Fe, Al
C. Fe, Cr, Al
D. Ag, Cu, Fe
Lời giải:
Dãy chất không phản ứng với HNO3 đặc nguội là: Fe, Cr, Al
Loại A vì Zn và Cu phản ứng với HNO3 đặc nguội
Loại B vì Cu phản ứng với HNO3 đặc nguội
C. Fe, Cr, Al không phản ứng được với HNO3 đặc nguội
Loại D vì Ag, Cu phản ứng với HNO3 đặc nguội
Câu 6. Cho m gam Mg vào dung dịch chứa 9,75 gam FeCl3. Sau khi phản ứng xảy ra hoàn toàn thu được 1,68 gam chất rắn. Giá trị của m là :
A. 2,88.
B. 2,16.
C. 4,32.
D. 1,04.
Lời giải:
Mg + 2Fe3+ → Mg2+ + 2Fe2+ (1)
Mg + Fe2+ → Mg2+ + Fe (2)
Ta nhận thấy: 1,68 < 0,06.56 = 3,36
=> Sau phản ứng dung dịch muối chưa phản ứng hết
nFe sinh ra sau phản ứng = = 0,03 (mol)
(2) nFe = nMg = 0,03 (mol)
(1) nMg = nFeCl3 = 0,03 (mol)
=> nMg = 0,03 + 0,03 = 0,06 (mol)
=> mMg = 0,06 . 24 = 1,44 gam.
Câu 7. Trong một cốc nước có chứa 0,03 mol Na+; 0,01 mol Ca2+; 0,01 mol Mg2+; 0,04 mol HCO3-; 0,01 mol Cl-; 0,01 mol SO42-. Nước trong cốc thuộc loại
A. Nước cứng có tính cứng tạm thời
B. Nước cứng có tính cứng toàn phần
C. Nước cứng có tính cứng vĩnh cửu
D. Nước mềm
Lời giải:
Đun nóng dung dịch:
2HCO3- → CO32- + CO2+ H2O
0,04 → 0,02 (mol)
Ta thấy Ca2+ và Mg2+ bị kết tủa hết:
Ca2+ + CO32- → CaCO3↓
0,01 → 0,01
Mg2+ + CO32- → MgCO3 ↓
0,01 → 0,01
Vậy nước cứng bị mất tính cứng khi đun nóng nên là nước cứng tạm thời.
Câu 8. Hỗn hợp X gồm 2 kim loại A và B thuộc phân nhóm chính nhóm II, ở 2 chu kỳ liên tiếp. Cho 2,56 gam X tan hoàn toàn trong dung dịch HCl dư thu được 2,24 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng, khối lượng muối khan thu được là
A. 6,02 gam
B. 6,11 gam
C. 9,66 gam
D. 3,01 gam
Lời giải:
Phương trình phản ứng: R + 2HCl → RCl2 + H2
Ta có nHCl = 2nH2 = 0,2 mol
mmuối = mkim loại + mCl- = 2,56 + 0,2. 35,5 = 9,66 gam.
Câu 9. Cho 0,896 lít CO2 hấp thụ hết vào 200 ml dung dịch chứa hỗn hợp NaOH 0,06M và Ba(OH)2 0,12M thu được m gam kết tủa. Giá trị m là:
A. 1,182.
B. 0,788.
C. 2,36.
D. 3,94
Lời giải:
nCO2= 0,04 mol; nOH- = 0,06 mol
Có: 1 < nOH/nCO2 = 1,5<2
=>Tạo 2 muối là CO3(2-) (x mol) và HCO3(-) (y mol)
Ta có:
x + y = 0,042 (1)
x + y = 0,06 (2)
Giải hệ phương trình (1), (2)
<=> x = y = 0,02
=>nBaCO3= nCO3(2-)= 0,02 mol
=>mBaCO3= 3,94 g
Câu 10. Cho các phát biểu sau:
(a). Trong phân tử HNO3 nguyên tử N có hoá trị V, số oxi hoá +5
(b để làm khô khí NH3 có lẫn hơi nước ta dẫn khí qua bình đựng vôi sống (CaO)
(c) HNO3 tinh khiết là chất lỏng, không màu, bốc khói mạnh trong không khí ẩm
(d) dung dịch HNO3 để lâu thường ngả sang màu nâu là do dung dịch HNO3 có hoà tan một lượng nhỏ khí NO2
Số phát biểu đúng:
A. 1
B. 3
C. 4
D. 2
Lời giải:
(b) Để làm khô khí NH3 có lẫn hơi nước ta dẫn khí qua bình đựng vôi sống (CaO) ;
(b) HNO3 tinh khiết là chất lỏng, không màu, bốc khói mạnh trong không khí ẩm;
(d) dung dịch HNO3 để lâu thường ngả sang màu nâu là do dung dịch HNO3 có hoà tan một lượng nhỏ khí NO2.
Câu 11. Cho từng chất: Fe, FeO, Fe(OH)2, Fe(OH)3, Fe3O4, Fe2O3, Fe(NO3)2, Fe(NO3)3, FeSO4, Fe2(SO4)3, FeCO3 lần lượt phản ứng với HNO3 đặc, nóng. Số phản ứng thuộc loại phản ứng oxi hoá - khử là
A. 8.
B. 5.
C. 7.
D. 6.
Lời giải:
Các chất có phản ứng oxi hóa- khử là: Fe, FeO, Fe(OH)2, Fe3O4, Fe(NO3)2, FeSO4, FeCO3.
Fe + 6HNO3 → Fe(NO3)3+ 3NO2 ↑ + 3H2O
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
Fe(OH)2 + 4HNO3 → Fe(NO3)3 + NO2 + 3H2O
Fe3O4+ 10HNO3 → 3Fe(NO3)3 + NO2 + 5H2O
Fe(NO3)2 + 2HNO3→ Fe(NO3)3 + NO2 + H2O
FeSO4 + 4HNO3 → Fe(NO3)3+ H2SO4+ NO2 + H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + CO2 + NO2 + 2H2O
Câu 12. Cho 1,38 g hổn hợp Al, Fe tác dụng với dung dịch hổn hợp H2SO4 đặc và HNO3 đặc, đun nóng thu được hổn hợp khí gồm 0,063 mol NO2 và 0,021 mol SO2. Nếu cho hổn hợp kim loại trên tác dụng với dung dịch HCl có dư thì số mol khí H2 sinh ra là bao nhiêu?
A. 0,035 mol
B. 0,045 mol
C. 0,04 mol
D. 0,042 mol
Lời giải:
Gọi số mol Al, Fe trong hỗn hợp là x, y
mhh = 27x + 56y = 1,38 (g) (1)
Al0 → Al+3 + 3e N+5 + 1e → N+4
x → 3x 0,063 ← 0,063
Fe0 → Fe+3 + 3e S+6 + 2e → S+4
y → 3y 0,042 ← 0,021
Áp dụng bảo toàn e: 3x + 3y = 0,063 + 0,042 = 0,105 (mol) (2)
Từ (1) và (2) → x = 0,02; y = 0,015
+) Hỗn hợp kim loại + HCl dư:
Al0 → Al+3 + 3e 2H+ + 2e → H2
0,02 → 0,06 0,09 → 0,045
Fe0 → Fe+2 + 2e
0,015 → 0,03
ne nhường= 0,06 + 0,03 = 0,09 => nH2 = = 0,045 mol
Câu 13. Các tính chất hoá học của HNO3 là:
A. tính axit mạnh, tính oxi hóa mạnh và tính khử mạnh.
B. tính axit mạnh, tính oxi hóa mạnh và bị phân huỷ.
C. tính oxi hóa mạnh, tính axit mạnh và tính bazơ mạnh.
D. tính oxi hóa mạnh, tính axit yếu và bị phân huỷ.
Lời giải:
Các tính chất hoá học của HNO3 là : tính axit mạnh, tính oxi hóa mạnh và bị phân huỷ.
Câu 14. Dung dịch nào dưới đây khi phản ứng hoàn toàn với dung dịch NaOH dư, thu được kết tủa trắng?
A. Ca(HCO3)2.
B. FeCl3.
C. AlCl3.
D. H2SO4.
Lời giải:
A đúng vì Ca(HCO3)2+ 2NaOH → CaCO3↓ trắng + Na2CO3 + 2H2O
B sai vì Fe(OH)3 kết tủa nâu đỏ: FeCl3+ 3NaOH → Fe(OH)3 ↓ + 3NaCl
C sai vì không thu được kết tủa: Al3+ + 4OH- dư → AlO2- + 2H2O
D sai vì không có kết tủa: H2SO4 + 2NaOH → Na2SO4 + H2O
Xem thêm các phương trình hóa học khác:
Mg + HNO3 → Mg(NO3)2 + NH4NO3 + H2O
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)