Zn + H2SO4 loãng → ZnSO4 + H2 l Zn ra ZnSO4
Zn + H2SO4 loãng → ZnSO4 + H2 là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Zn + H2SO4 loãng → ZnSO4 + H2
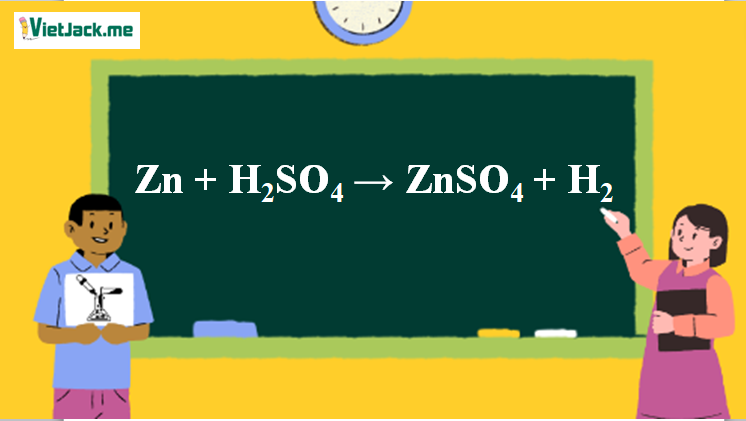
1. Phương trình Zn tác dụng H2SO4 loãng
Zn + H2SO4 → ZnSO4 + H2
2. Điều kiện phản ứng xảy ra phản ứng Zn tác dụng H2SO4 loãng
Nhiệt độ thường, H2SO4 loãng.
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của Zn (Kẽm)
- Trong phản ứng trên Zn là chất khử.
- Zn là kim loại hoạt động có tính khử mạnh tác dụng được với các dung dịch axit.
3.2. Bản chất của H2SO4 (Axit sunfuric)
- Trong phản ứng trên H2SO4 là chất oxi hoá.
- Trong H2SO4 thì S có mức oxi hoá +6 cao nhất nên H2SO4 đặc có tính axit mạnh, oxi hoá mạnh và háo nước.
4. Tính chất hóa học của H2SO4 loãng
4.1. Làm đổi màu quỳ tím thành đỏ
4.2. Axit sunfuric loãng tác dụng với kim loại
Axit sunfuric loãng có khả năng tác dụng với kim loại đứng trước hidro trong dãy hoạt động hóa học của kim loại
Tác dụng với kim loại (Al, Fe, Zn, Mg,…) → muối sunfat + khí hidro
Ví dụ:
Fe + H2SO4 (loãng) → FeSO4 + H2
Mg + H2SO4 → MgSO4 + H2
4.3. Axit sunfuric loãng tác dụng với bazơ
Tác dụng với bazơ → muối sunfat + nước
Thí dụ:
H2SO4 + Fe(OH)2 → FeSO4 + 2H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
4.4. Axit sunfuric loãng tác dụng với oxit bazơ
Tác dụng với oxit bazơ → muối sunfat + nước
Ví dụ:
BaO + H2SO4 → BaSO4 + H2O
H2SO4 + MgO → MgSO4 + H2O
H2SO4 + CuO → CuSO4 + H2O
4.5. Axit sunfuric loãng tác dụng với muối
Tác dụng với muối → muối (mới) + axit(mới)
BaCl2 + H2SO4 → BaSO4 + HCl
H2SO4 + Na2CO3 → Na2SO4 + CO2 + H2O
5. Tính chất hoá học của Zn
Kẽm là kim loại hoạt động có tính khử mạnh Zn → Zn2+ + 2e
5.1. Tác dụng với phi kim
Zn tác dụng trực tiếp với nhiều phi kim.
2Zn + O2 → 2ZnO
Zn + Cl2 → ZnCl2
5.2. Tác dụng với axit
- Với các dung dịch axit HCl, H2SO4 loãng:
Zn + 2HCl → ZnCl2 + H2
- Với dung dịch HNO3, H2SO4 đặc:
Zn + 4HNO3 đ → Zn(NO3)2 + 2NO2 + 2H2O
5.3. Tác dụng với H2O
Phản ứng này hầu như không xảy ra vì trên bề mặt của kẽm có màng oxit bảo vệ.
5.4. Tác dụng với bazơ
Kẽm tác dụng với dung dịch bazơ mạnh: NaOH, KOH, Ca(OH)2....
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
5.5. Điều chế
Kẽm là nguyên tố được sử dụng phổ biến thứ 4, sau sắt, đồng, nhôm. Khoảng 70% lượng kẽm hiện nay đến từ việc khai thác quặng kẽm, phần còn lại sẽ từ hoạt động tái chế. 95% kẽm khai thác từ quặng sulfit. Trên thế giới các mỏ quặng kẽm tập trung nhiều tại Trung Quốc, Peru và Australia.
Quặng kẽm sẽ được nghiền nhỏ và trải qua nhiều công đoạn xử lý, tinh chế để thu được kim loại kẽm tinh khiết:
Chuyển kẽm sulfit thành kẽm oxit: 2 ZnS + 3 O2 → 2 ZnO + 2 SO2.
Khử kẽm oxit với cacbon hoặc CO ở 950 °C tạo kim loại kẽm ở dạng hơi. Hơi kẽm được thu hồi trong bình ngưng tụ:
2 ZnO + C → 2 Zn + CO2
2 ZnO + 2 CO → 2 Zn + 2 CO2.
Ngoài ra có thể khử ZnO bằng phương pháp sử dụng dung dịch H2SO4 sau đó điện phân thu kẽm kim loại:
ZnO + H2SO4 → ZnSO4 + H2O
2 ZnSO4 + 2 H2O → 2 Zn + 2 H2SO4 + O2
6. Bài tập vận dụng liên quan
Câu 1. Tính chất nào sau đây không là tính chất của H2SO4 đặc, nguội
A. Tan trong nước, tỏa nhiệt.
B. Làm hóa than đường, vải, giấy.
C. Hòa tan được kim loại Al, Fe, Cr.
D. Háo nước.
Lời giải:
Câu 2. Dãy chất nào dưới đây gồm các chất tác dụng được với dung dịch H2SO4 loãng?
A. Fe, Cu(OH)2, MgO và P2O5
B. Ag, Cu(OH)2, Na2O và K2CO3
C. Mg, ZnO, Ba(OH)2, CaCO3
D. Cu, ZnO, NaOH, CaCO3
Lời giải:
Dãy chất nào dưới đây gồm các chất tác dụng được với dung dịch H2SO4 loãng?
Loại A. vì H2SO4 loãng không tác dụng với oxit axit P2O5
Loại B. vì H2SO4 loãng không tác dụng với Ag
C. Mg, ZnO, Ba(OH)2, CaCO3
Loại D vì H2SO4 loãng không tác dụng với Cu
Câu 3. Để pha loãng H2SO4 đặc một cách an toàn người ta tiến hành:
A. rót từ từ axit vào nước và khuấy đều
B. rót nhanh axit vào nước và khuấy đều
C. rót từ từ nước vào axit và khuấy đều
D. rót nhanh nước vào axit và khuấy đều
Lời giải:
Để pha loãng H2SO4 đặc một cách an toàn người ta tiến hành: rót từ từ axit vào nước và khuấy đều
Câu 4. Cho 6,5 gam Zn tác dụng với dung dịch H2SO4 loãng dư , thu được dung dịch X và khí H2 (đktc). Tính thể tích khí H2 thu được thể tích là bao nhiêu?
A. 2,24 lit
B. 4,48 lít
C. 3,36 lít
D. 1,12 lít
Lời giải:
Số mol kẽm phản ứng:
nZn = = = 0,1 (mol)
Phương trình hóa học
Zn + H2SO4→ ZnSO4 + H2
0,1 → 0,1 → 0,1 (mol)
Thể tích khí H2 thu được là:
VH2 = nH2.22,4 = 0,1.22,4 = 2,24 (l)
Câu 5. Thả một mẫu kẽm vào dung dịch axit H2SO4 loãng thấy xuất hiện, hiện tượng gì?
A. Có khí không màu thoát ra
B. Có khí có màu thoát ra, và viên kẽm tan dần
C. Có khí không màu thoát ra và mẩu kẽm tan dần
D. Mẫu kẽm tan dần
Lời giải:
Chất rắn màu xám sẫm Kẽm (Zn) tan dần, thu được dung dịch trong suốt và có bọt khí thoát ra (H2)
Phương trình hóa học:
Zn + H2SO4 → ZnSO4 + H2↑
Câu 6. Cho m gam kẽm tác dụng với dd HCl dư thu được 2,24 lít khí H2 (đktc). Tính m?
A. 6,5 gam
B. 13 gam
C. 8,7 gam
D. 9,75 gam
Lời giải:
Ta có:
nH2 = = 0,1 (mol)
Phương trình phản ứng xảy ra
Zn + 2HCl → ZnCl2+ H2
Theo phương trình phản ứng: nZn= nH2 = 0,1 (mol)
=> mZn = 0,1 . 65 = 6,5 g
Câu 7. X là một hợp chất của Zn thường được dùng trong y học, với tác dụng làm thuốc giảm đau dây thần kinh, chữa bệnh eczema, bệnh ngứa,.... Chất X là
A. Zn(NO3)2.
B. ZnSO4.
C. ZnO.
D. Zn(OH)2.
Lời giải:
Câu 8. Cho dãy các chất: Cr(OH)3, Al2(SO4)3, Mg(OH)2, Zn(OH)2, MgO, CrO3. Số chất trong dãy có tính chất lưỡng tính là
A. 5.
B. 2.
C. 3.
D. 4.
Lời giải:
Câu 9. Các chất trong dãy nào sau đây vừa có tính oxi hóa vừa có tính khử?
A. CrO3, FeO, CrCl3, Cu2O.
B. Fe2O3, Cu2O, CrO, FeCl2.
C. Fe2O3, Cu2O, Cr2O3, FeCl2.
D. Fe3O4, Cu2O, CrO, FeCl2.
Câu 10. Cho 2,24 gam bột Fe vào 200 ml dung dịch hỗn hợp gồm có AgNO3 0,1M và Cu(NO3)2 0,5M, khuấy đều tới phản ứng hoàn toàn, thu được chất rắn A và dung dịch B. Tính số gam chất rắn A.
A. 4,08 gam
B. 8,16 gam
C. 2,04 gam
D. 6,12 gam
Lời giải:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag (1)
0,01 ← 0,02 → 0,01→ 0,02 (mol)
Fe + Cu(NO3)2 → Cu + Fe(NO3)2 (2)
0,03 ← 0,03 → 0,03 → 0,03 (mol)
nAgNO3= 0,02 (mol);
nFe = 0,04 (mol);
nCu(NO3)2 = 0,1(mol)
nFe phản ứng (1)= 0,01(mol); nFe pư (2) = 0,04 - 0,01 = 0,03 (mol)
nCu(NO3)2 dư= 0,1 - 0,03 = 0,07 (mol)
Chất rắn A gồm: 0,02 mol Ag và 0,03 mol Cu
⇒ mA = 0,02.108 + 0,03.64 = 4,08 (gam)
Câu 11. Cho 15,6 gam hỗn hợp Mg, Al tác dụng hết với dung dịch HCl dư sau phản ứng thấy khối lượng dung dịch tăng thêm 14 gam. Tính số mol HCl đã tham gia phản ứng.
A. 0,8 mol
B. 0,4 mol
C. 1,6 mol
D. 0,25 mol
Lời giải:
Kim loại + HCl → muối + H2
Mg + 2HCl → MgCl2 + H2
2Al + 6HCl → 2AlCl3 + H2
Ta có: mdung dịch tăng= mkim loại– mkhí thoát ra
⇒ mH2= 15,6 - 14 = 1,6 (gam) ⇒ nH2= 0,8 (mol)
Áp dụng bảo toàn nguyên tử H: nHCl = 2.nH2 = 1,6 (mol).
Câu 12. Cho hỗn hợp A gồm Fe(NO3)2 và ZnO vào dung dịch H2SO4 loãng (dư) thu được dung dịch B. Cho dung dịch KOH loãng (dư) vào B thu được kết tủa là
A. Fe(OH)3 và Zn(OH)2.
B. Fe(OH)3.
C. Fe(OH)2 và Zn(OH)2.
D. Fe(OH)2.
Lời giải:
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
ZnO + 2H+ → Zn2+ + H2O
Fe3+ + 3OH- → Fe(OH)3 ↓
Zn2+ + 2OH- → Zn(OH)2 ↓
Zn(OH)2 ↓ + 2OH- → ZnO22- + 2H2O
Sau phản ứng chỉ thu được kết tủa là Fe(OH)3
Câu 13. Cho luồng khí C dư qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn còn lại là
A. Cu, Fe, ZnO, MgO.
B. Cu, Fe, Zn, Mg.
C. Cu, Fe, Zn, MgO.
D. Cu, FeO, ZnO, MgO.
Câu 14. Cho a gam hỗn hợp bột Zn và Fe vào lượng dư dung dịch CuSO4. Sau khi kết thúc các phản ứng, lọc bỏ phần dung dịch thu được m gam bột rắn. Thành phần phần trăm theo khối lượng của Zn trong hỗn hợp ban đầu là
A. 12,67%.
B. 85,30%.
C. 90,27%.
D. 82,20%.
Lời giải:
Gọi nZn= x mol; nFe = y mol
Zn + CuSO4→ ZnSO4 + Cu
x → x
Fe + CuSO4→ FeSO4+ Cu
y → y
nCu= x + y mol
Vì khối lượng chất rắn trước và sau phản ứng bằng nhau nên mZn + mFe = mCu
Do đó 65x + 56by = 64(x + y) ⇔ x = 8y
Vậy phần trăm khối lượng của Zn trong hỗn hợp ban đầu là
%mZn = .100 = .100 = 90,27%
Câu 15. Hoà tan 7,8 gam hỗn hợp bột Al và Mg trong dung dịch HCl dư. Sau phản ứng khối lượng dung dịch axit tăng thêm 7,0 gam. Khối lượng nhôm và magie trong hỗn hợp đầu là:
A. 2,7 gam và 1,2 gam
B. 5,4 gam và 2,4 gam
C. 5,8 gam và 3,6 gam
D. 1,2 gam và 2,4 gam
Lời giải:
Áp dụng định luật bảo toàn khối lượng ta có: mH2 = 7,8 - 7,0 = 0,8 gam
Mặt khác theo công thức 1 và theo đề ta có hệ phương trình:
(Khi tham gia phản ứng nhôm nhường 3 e, magie nhường 2 e và H2 thu về 2e)
3.nAl + 2.nMg= 2.nH2 = 2.0.8/2 (1)
27.nAl + 24.nMg = 7,8 (2)
Giải phương trình (1), (2) ta có nAl = 0.2 mol và nMg = 0.1 mol
Từ đó ta tính được mAl = 27.0,2 =5,4 gam và mMg = 24.0,1 = 2,4 gam
Câu 16. Cho H2SO4 loãng dư tác dụng với 6,660 gam hỗn hợp 2 kim loại X và Y đều hóa trị II thu được 0,1 mol khí đồng thời khối lượng giảm 6,5 g. Hòa tan phần rắn còn lại bằng H2SO4 đặc nóng thì thu được 0,16 gam SO2. Xác định X, Y?
A. Zn, Cu
B. Fe, Ba
C. Fe, Cu
D. Zn, Fe
Lời giải:
Khối lượng giảm 6,5 g < 6,66 g → chỉ có một kim loại tan trong H2SO4 loãng.
Giả sử kim loại đó là X
X + H2SO4 (l) → XSO4 + H2
nX= nH2 = 0,1 → MX= = 65 (Zn)
Phần rắn còn lại là kim loại Y
Y – 2e → Y2+ ; S+6 + 2e → S+4 (SO2)
Theo định luật bảo toàn e:
nY = nSO2 = = 0,0025 → MY = = 64 (Cu)
Câu 17. Cho 10,5 gam hỗn hợp 2 kim loại Cu, Zn vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (ở đktc). Tính khối lượng chất rắn còn lại sau phản ứng
A. 2 gam
B. 4 gam
C. 8 gam
D. 6 gam
Lời giải:
Phương trình phản ứng của phản ứng:
Zn + H2SO4 loãng → ZnSO4 + H2 ↑ (1)
Cu + H2SO4 loãng → không phản ứng
→ Chất rắn còn lại sau phản ứng là Cu.
Ta có:
nH2 = = 0,1 (mol)
Theo phương trình phản ứng (1), ta có: nZn = nH2 = 0,1 (mol)
⇒ mZn = 0,1 x 65 = 6,5 (g)
Khối lượng Cu còn lại sau phản ứng là:
mCu = mhh – mZn = 10,5 – 6,5 = 4 (g)
Câu 18. Cho hỗn hợp các kim loại Fe, Mg, Zn vào cốc đựng dung dịch CuSO4 dư, thứ tự các kim loại tác dụng với muối là
A. Fe, Zn, Mg
B. Mg, Zn, Fe
C. Mg, Fe, Zn
D. Zn, Mg, Fe
Lời giải:
Câu 19. Hòa tan hoàn toàn quặng hematit (sau khi đã loại bỏ các tạp chất trơ) trong dung dịch H2SO4 loãng dư, thu được dung dịch X. Dãy gồm các chất nào sau đây khi tác dụng với X, xảy ra phản ứng oxi hóa-khử?
A. KNO3, KI, KMnO4.
B. BaCl2, KMnO4, KOH.
C. Cu, KI, khí H2S.
D. khí Cl2, KOH, Cu.
Lời giải:
Quặng hemantit (Fe2O3) tan trong H2SO4 loãng dư, thu được dung dịch X gồm Fe2(SO4)3, H2SO4.
X tác dụng với BaCl2, KOH, Cu, KI, khí H2S.
Câu 20. Cho các ống nghiệm đựng các dung dịch sau: HCl, H2SO4 đặc nguội, CuCl2, NaCl. Thả bột nhôm vào các ống nghiệm thấy có hiện tượng lần lượt là
A. sủi bọt khí, không hiện tượng, xuất hiện kết tủa màu đỏ, không hiện tượng.
B. không hiện tượng, sủi bọt khí, không hiện tượng, xuất hiện kết tủa vàng.
C. xuất hiện khói trắng, sủi bọt khí, xuất hiện kết tủa nâu đỏ, không hiện tượng.
D. sủi bọt khí, xuất hiện khói trắng, xuất hiện kết tủa màu đỏ, không hiện tượng.
Lời giải:
Thả bột nhôm vào
dung dịch HCl: có khí không màu: 2Al + 6HCl → 2AlCl3 + 3H2.
dung dịch H2SO4 đặc nguội không có hiện tượng. Vì Al bị thụ động trong axit H2SO4 đặc nguội
dung dịch CuCl2 có kết tủa màu đỏ (Cu):
2Al + 3CuCl2→ 2AlCl3 + 3Cu.
dung dịch NaCl không có hiện tượng.
Xem thêm các phương trình hóa học khác:
Zn + H2SO4 → ZnSO4 + SO2 + H2O
Zn + HNO3 → Zn(NO3)2 + NO2 + H2O
Zn + HNO3 → Zn(NO3)2 + NO + H2O
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
