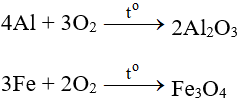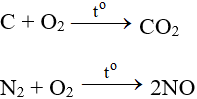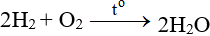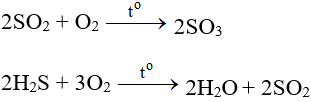S + O2 → SO2 | S ra SO2
S + O2 → SO2 là phản ứng hóa hợp. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng S + O2 → SO2
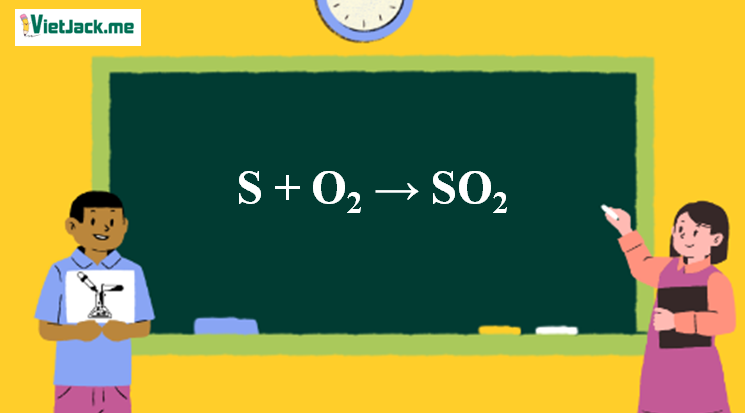
1. Phản ứng S ra SO2
S + O2 SO2
2. Điều kiện phản ứng đốt cháy lưu huỳnh
Điều kiện: Nhiệt độ
3. Cách thực hiện phản ứng đốt cháy lưu huỳnh trong không khí và oxi
Đưa muỗng sắt có chứa một 1 lượng nhỏ lưu huỳnh bột vào ngọn lửa đèn cồn. Sau đó đưa lưu huỳnh đang cháy vào lọ có chứa khí oxi.
4. Hiện tượng phản ứng xảy ra
Lưu huỳnh cháy trong không khí: với ngọn lửa nhỏ, màu xanh nhạt
Lưu huỳnh cháy trong oxi: mãnh liệt hơn, tạo thành khí lưu huỳnh đi oxit
5. Tính chất hóa học của lưu huỳnh
Nguyên tử S có 6e lớp ngoài cùng, trong đó có 2e độc thân.
Khi tham gia phản ứng hóa học, số oxi hóa của lưu huỳnh có thể giảm hoặc tăng: −2; 0; +4; +6.
⟹ Lưu huỳnh có tính oxi hóa và tính khử.
5.1. Tính oxi hóa
Khi lưu huỳnh tác dụng với kim loại hoặc hiđro, số oxi hóa của lưu huỳnh từ 0 giảm xuống −2
a) Tác dụng với kim loại
Lưu huỳnh tác dụng với nhiều kim loại tạo muối sunfua.
3S + 2Al → Al2S3
S + Cu → CuS
b) Tác dụng với hiđro
Lưu huỳnh tác dụng với khí hiđro tạo thành khí hiđro sunfua.
S + H2 → H2S
5.2. Tính khử
Khi lưu huỳnh phản ứng với phi kim hoạt động mạnh hơn, số oxi hóa của lưu huỳnh từ 00 tăng lên +4 hoặc +6.
a) Tác dụng với phi kim
Lưu huỳnh phản ứng với phi kim ở nhiệt độ thích hợp.
S + O2 → SO2
3F2+ S → SF6
b) Tác dụng với chất oxi hóa mạnh (H2SO4, HNO3,...)
S + 2H2SO4→ 3SO2 + 2H2O
S + 6HNO3 → H2SO4 + 6NO2 + 2H2O
6. Ứng dụng của S
Lưu huỳnh được sử dụng trong nhiều sản phẩm công nghiệp, ví dụ như: Ắc quy, bột giặt, lưu hóa cao su, thuốc diệt nấm và các phân bón photphat. Cụ thể, được lưu huỳnh được sử dụng để tạo nên độ trắng của giấy, làm chất bảo quản trong rượu vang và làm khô hoa quả. Do bản chất dễ cháy, lưu huỳnh còn được ứng dụng trong sản xuất các loại diêm, thuốc súng, thuốc nổ cũng như pháo hoa…
7. Tính chất hóa học của O2
- Khi tham gia phản ứng, nguyên tử O dễ dàng nhận thêm 2e. Nguyên tử oxi có độ âm điện lớn (3,44), chỉ kém flo (3,98).
- Do vậy, oxi là nguyên tố phi kim hoạt động hoá học, có tính oxi hoá mạnh. Trong các hợp chất (trừ hợp chất với flo), nguyên tố oxi có số oxi hoá là -2.
- Oxi tác dụng với hầu hết các kim loại (trừ Au, Pt, ...) và các phi kim (trừ halogen). Oxi tác dụng với nhiều hợp chất vô cơ và hữu cơ.
7.1. Tác dụng với kim loại
Tác dụng với hầu hết kim loại (trừ Au và Pt), cần có to tạo oxit:
7.2. Tác dụng với phi kim
Tác dụng với hầu hết phi kim (trừ halogen), cần có to tạo oxit:
ĐB: Tác dụng với H2 nổ mạnh theo tỉ lệ 2:1 về số mol:
7.3. Tác dụng với hợp chất
- Tác dụng với các chất có tính khử:
- Tác dụng với các chất hữu cơ:
8. Bài tập vận dụng
Câu 1. Nhận định nào sau đây phản ánh đúng tính chất hóa học của lưu huỳnh ?
A. Lưu huỳnh chỉ có tính oxi hóa.
B. Lưu huỳnh chỉ có tính khử.
C. Lưu huỳnh vừa có tính khử vừa có tính oxi hóa.
D. Lưu huỳnh không có tính oxi hóa và không có tính khử.
Lời giải:
Đáp án: C
Câu 2. Phát biểu nào sau đây là sai khi nói về lưu huỳnh?
A. Chất rắn, màu vàng.
B. Không tan trong các dung môi hữu cơ.
C. Không tan trong nước.
D. Dẫn điện, dẫn nhiệt kém.
Lời giải:
Đáp án: B
Giải thích:
Lưu huỳnh là chất rắn, màu vàng, không tan trong nước, tan trong các dung môi hữu cơ, dẫn điện, dẫn nhiệt kém.
Vậy phát biểu sai là không tan trong các dung môi hữu cơ.
Câu 3. Cho các nhận định sau:
(1) Số protron trong hạt nhân nguyên tử bằng số electron trong nguyên tử.
(2) Trong hạt nhân nguyên tử, số proton luôn bằng số nơtron.
(3) Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân nguyên tử.
(4) Chỉ có hạt nhân nguyên tử lưu huỳnh mới có 16 nơtron.
Những nhận định đúng là
A. (2), (4).
B. (3), (4).
C. (1), (2).
D. (1), (3).
Lời giải:
Đáp án: D
Giải thích:
(1) đúng, số protron trong hạt nhân nguyên tử bằng số electron trong nguyên tử (do nguyên tử trung hòa về điện).
(2) sai, chỉ có biểu thức liên hệ giữa số p và số n: 1 ≤ n / p ≤ 1,52 (áp dụng với 82 nguyên tố đầu tiên).
(3) đúng.
(4) sai, hạt nhân 3115Pcũng có 31 - 15 = 16 nơtron.
Vậy các nhận định (1), (3) đúng.
Câu 4. Cho các nhận định sau:
(1). O3 có tính oxi hóa mạnh hơn O2.
(2). Ozon oxi hóa được Bạc và dd KI.
(3). SO2 làm nhạt màu vàng của dd nước Brom.
(4). H2SO4 đặc rất háo nước và có tính oxi hóa mạnh.
(5). H2SO4 đặc hấp thụ SO3 tạo ra Oleum.
(6). Hiđro peoxit vừa có tính oxi hóa, vừa có tính khử.
(7). Lưu huỳnh đơn chất vừa có tính oxi hóa vừa có tính khử.
Số nhận định đúng là:
A. 4
B. 6
C. 5
D. 6
Lời giải:
Đáp án: B
Câu 5. Khẳng định nào sau đây là đúng khi nói về tính chất hóa học của hiđro sunfua.
A. Tính axit mạnh và tính khử yếu.
B. Tính bazơ yếu và tính oxi hóa mạnh.
C. Tính bazơ yếu và tính oxi hóa yếu.
D. Tính axit yếu và tính khử mạnh.
Lời giải:
Đáp án: D
Câu 6. Cho các phản ứng: (1) Na2S + HCl ; (2) F2 + H2O; (3) MnO2 + HCl đặc; (4) Cl2 + dung dịch H2S. Các phản ứng tạo ra đơn chất là
A. (1), (2), (4).
B. (2), (3), (4).
C. (1), (2), (3).
D. (1), (3), (4).
Lời giải:
Đáp án: B
Giải thích:
(1) Na2S + 2HCl → 2NaCl + H2S
(2) 2F2 + 2H2O → 4HF + O2
(3) MnO2 + 4HCl đặc → MnCl2 + Cl2 + 2H2O
(4) Cl2 + H2S → 2HCl + S
=> các phản ứng tạo ra đơn chất là: (2), (3), (4)
Câu 7. Lưu huỳnh tác dụng với axit sunfuric đặc, nóng:
S + 2H2SO4 → 3SO2 + 2H2O
Trong phản ứng này, tỉ lệ nguyên tử lưu huỳnh bị khử và số nguyên tử lưu huỳnh bị oxi hoá là:
A. 1 : 2.
B. 1 : 3.
C. 3 : 1.
D. 2 : 1.
Lời giải:
Đáp án: A
Câu 8. Đung nóng 9,75 gam kali với một phi kim X dư thu được 13,75 gam muối. Hỏi X là phi kim nào sau đây?
A. Cl
B. Br
C. S
D. N
Lời giải:
Đáp án: C
Giải thích:
Giả sử X có hóa trị là x.
xK + X → KxX
Ta có: nK= 9,75/39 = 0,25 mol
→nKxX= nK/x = 0,25/x
→ MKxX = 39x + X = (13,75)/0,25:n = 55x → X = 16x
Thỏa mãn x = 2 suy ra X = 32 nên X là S, muối là K2S
Câu 9. Phát biểu nào sau đây không đúng?
A. Lưu huỳnh là một phi kim mạnh, có tính oxi hóa mạnh điển hình
B. Khi tham gia phản ứng, lưu huỳnh thể hiện tính oxi hóa hoặc tính khử
C. Điều kiện thường, lưu huỳnh là chất rắn, màu vàng, không tan trong nước
D. Điều kiện thường, lưu huỳnh tồn tại dạng phân tử tám nguyên tử S8
Lời giải:
Đáp án: A
Câu 10. Hơi thủy ngân rất dộc, bởi vậy khi làm vỡ nhiệt kế thủy ngân thì chất bột được dùng để rắc lên thủy ngân rồi gom lại là
A. vôi sống.
B. cát.
C. muối ăn.
D. lưu huỳnh.
Lời giải:
Đáp án: D
Giải thích:
Thủy ngân tác dụng với lưu huỳnh ngay tại điều kiện thường:
Hg + S → HgS ↓
Do đó khi làm vỡ nhiệt kế thuỷ ngân thì chất bột được dùng để rắc lên thuỷ ngân rồi gom lại là lưu huỳnh, tránh gây ngộ độc
Câu 11. Cho các phản ứng hóa học sau:
S + O2 SO2
S + 3F2 SF6
S + Hg → HgS
S + 6HNO3 (đặc) H2SO4 + 6NO2 + 2H2O
Trong các phản ứng trên, số phản ứng trong đó S thể hiện tính khử là
A. 3
B. 2
C. 4
D. 1
Lời giải:
Đáp án: A
Câu 12. Cho 5,5 gam hỗn hợp bột sắt và bột nhôm tác dụng với bột lưu huỳnh trong điều kiện không có không khí) thấy có 6,4 gam lưu huỳnh tham gia phản ứng. Khối lượng sắt có trong 5 gam hỗn hợp đầu là
A. 5,6 gam.
B. 11,2 gam.
C. 2,8 gam.
D. 8,4 gam.
Lời giải:
Đáp án: C
Giải thích:
nS = 6,4/32 = 0,2 (mol)
⇒ mhh = mFe + mAl
Bảo toàn electron: 2nFe+ 3nAl = 2nS
⇒ 56nFe + 27 nAl= 5,5 (1)
2nFe + 3nAl = 2.0,2 (2)
Giải hệ phương trình (1), (2)
⇒ nFe = 0,05
nAl= 0,1
⇒ mFe = 0,05.56 = 2,8 (gam)
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)