Ba(HCO3)2 + NaOH → BaCO3 + Na2CO3 + H2O | Ba(HCO3)2 ra BaCO3 | NaOH ra Na2CO3
Ba(HCO3)2 + NaOH → BaCO3 + Na2CO3 + H2O là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Ba(HCO3)2 + NaOH → BaCO3 + Na2CO3 + H2O
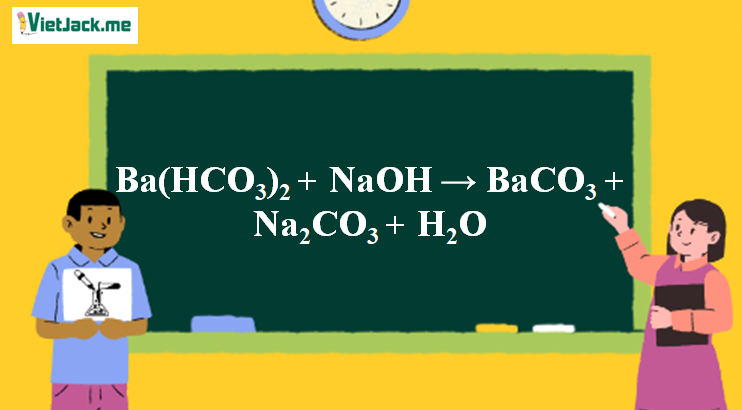
1. Phương trình phân tử của phản ứng NaOH + Ba(HCO3)2
Ba(HCO3)2 + 2NaOH → BaCO3↓ + Na2CO3 + 2H2O
2. Điều kiện để phản ứng Ba(HCO3)2 tác dụng với NaOH xảy ra
Nhiệt độ thường
3. Phương trình ion rút gọn của NaOH + Ba(HCO3)2
Phương trình phân tử
NaOH + Ba(HCO3)2 → BaCO3 + NaHCO3+ H2O
Phương trình ion
Na+ + OH− + Ba2+ + 2HCO3−→ BaCO3+ Na+ + HCO3− + H2O
Phương trình ion rút gọn
Ba2+ + HCO3− + OH− → BaCO3 + H2O
4. Hiện tượng phản ứng xảy ra khi cho Ba(HCO3)2 tác dụng với NaOH
Cho dung dịch Ba(HCO3)2 tác dụng với NaOH sau phản ứng xuất hiện kết tủa keo trắng.
5. Bản chất của các chất tham gia phản ứng
5.1. Bản chất của Ba(HCO3)2 (Bari hidrocacbonat)
Ba(HCO3)2 là muối axit tác dụng được với các dung dịch bazo.
5.2. Bản chất của NaOH (Natri hidroxit)
NaOH là bazo mạnh phản ứng được với các muối.
6. Tính chất hoá học của NaOH
6.1. Làm đổi màu chất chỉ thị
Dung dịch NaOH làm quỳ tím chuyển thành màu xanh.
Dung dịch NaOH làm phenolphthalein không màu chuyển sang màu đỏ, đổi màu methyl da cam thành màu vàng.
6.2. Tác dụng với oxit axit
Khi tác dụng với axit và oxit axit trung bình, yếu thì tùy theo tỉ lệ mol các chất tham gia mà muối thu được có thể là muối axit, muối trung hòa hay cả hai.
Phản ứng với oxit axit: NO2, SO2, CO2...
Ví dụ:
2NaOH + SO2 → Na2SO3 + H2O
NaOH + SO2→ NaHSO3
2NaOH + 2NO2→ H2O + NaNO2 + NaNO3 (tạo 2 muối )
NaOH + CO2 → NaHCO3
2NaOH + CO2→ Na2CO3 + H2O
3NaOH + P2O5 → Na3PO4↓ + 3H2O
NaOH + SiO2 → Na2SiO3
Phản ứng với SiO2 là phản ứng ăn mòn thủy tinh vì thế khi nấu chảy NaOH, người ta dùng các dụng cụ bằng sắt, niken hay bạc mà không dùng thủy tinh để chứa NaOH.
6.3. Tác dụng với axit
Là một bazơ mạnh nên tính chất đặc trưng của NaOH là tác dụng với axit tạo thành muối tan và nước. Phản ứng này còn gọi là phản ứng trung hòa.
Ví dụ:
NaOH + HCl → NaCl+ H2O
NaOH + HNO3→ NaNO3+ H2O
2NaOH + H2SO4 → Na2SO4 + 2H2O
3NaOH + H3PO4→ Na3PO4 + 3H2O
2NaOH + H2CO3 → Na2CO3 + 2H2O
6.4. Tác dụng với muối
Natri hidroxit tác dụng với dung dịch muối tạo thành muối mới và bazơ mới.
Điều kiện để có phản ứng xảy ra: Muối tạo thành phải là muối không tan hoặc bazơ tạo thành phải là bazơ không tan.
Ví dụ:
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2⏐↓
NaOH + MgSO4→ Mg(OH)2 + Na2SO4
2NaOH + MgCl2 → 2NaCl + Mg(OH)2
FeCl3 + 3NaOH → Fe(OH)3+ 3NaCl
Cu(NO3)2 + 2NaOH → Cu(OH)2 + 2NaNO3
2NaOH + FeSO4 → Na2SO4 + Fe(OH)2↓ nâu đỏ
6.5. Tác dụng với một số phi kim như Si, C, P, S, Halogen
Si + 2NaOH + H2O → Na2SiO3 + 2H2↑
C + NaOH nóng chảy → 2Na + 2Na2CO3 + 3H2↑
4P trắng + 3NaOH + 3H2O → PH3↑ + 3NaH2PO2
Cl2+ 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6NaOH → NaCl + NaClO3 + 3H2O
6.6. Hoà tan một hợp chất của kim loại lưỡng tính Al, Zn, Be Sn Pb
Ví dụ: Al, Al2O3, Al(OH)3
2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2↑
2NaOH + Al2O3→ 2NaAlO2 + H2O
NaOH + Al(OH)3→ NaAlO2 + 2H2O
Chất được tạo ra trong dung dịch có thể chứa ion Na[Al(OH)4], hoặc có thể viết
Al(OH)3 + NaOH → Na[Al(OH)4]
Tương tự, NaOH có thể tác dụng với kim loại Be, Zn, Sb, Pb, Cr và oxit và hiđroxit tương ứng của chúng.
7. Ứng dụng của NaOH
- Sử dụng trong xử lý nước
Nhờ vào sự cân bằng pH của NaOH, một trong những ứng dụng phổ biến của loại hợp chất này là xử lý nước thải, nước ngầm, làm sạch hồ bơi,…
Nói thêm, ứng dụng đặc biệt chính là gọi NaOH như một loại hóa chất bể bơi. Khi hồ bị ô nhiễm do nhiều tác nhân xung quanh, NaOH sẽ giúp ngăn ngừa vi khuẩn phát triển, đem lại nguồn nước sạch. Tuy nhiên, khi khử khuẩn hồ, cần lưu ý lượng NaOH hoà tan vào dựa trên số mét khối nước và độ rộng của bể để tránh gây ra những ảnh hưởng xấu đến sức khoẻ của người sử dụng.
Đặc biệt, NaOH phản ứng với nước rất mạnh nên cần trang bị đồ bảo hộ cẩn thận trong quá trình làm việc.
- Ứng dụng trong chế biến thực phẩm
Ứng dụng của NaOH trong đời sống cũng như ngành chế biến thực phẩm khá phổ biến. Chức năng chính là dùng để bảo quản thực phẩm, giúp chúng giữ được độ tươi ngon, ngăn ngừa các loại nấm mốc và vi trùng sản sinh trong đồ ăn, thức uống.
- Ứng dụng trong sản phẩm gỗ và giấy
Ứng dụng quan trọng nhất của NaOH chính là sản xuất giấy. Hỗn hợp dung dịch Natri Sunfua (Na2S) và NaOH giúp hoà lẫn các chất liệu không muốn có trong gỗ, chỉ còn lại Xenlulozo (C6H12O5) tinh khiết – thành phần chính để sản xuất giấy.
- Ứng dụng trong sản xuất công nghiệp khác
NaOH còn được sử dụng ở rất nhiều lĩnh vực khác như sản xuất sợi nhân tạo, chất nổ, sơn, thuỷ tinh, gốm sứ, nhựa epoxy, ngành dệt (thuốc nhuộm, xử lý vải, giặt tẩy trắng,…), mạ điện, xử lý kim loại,…
8. Bài tập vận dụng
Câu 1. Dãy muối tác dụng với dung dịch axit sunfuric loãng là:
A. Na2CO3, Na2SO3, NaCl
B. CaCO3, Na2SO3, BaCl2
C. BaCO3, BaCl2, CaCl2
D. CaCl2, Na2CO3, Cu(NO3)2
Lời giải:
Đáp án: B
Câu 2. Kim loại nào sau đây vừa tác dụng với dung dịch HCl vừa tác dụng với NaOH ?
A. Cu
B. Zn
C. Al
D. Ag
Lời giải:
Đáp án: D
Câu 3. Dãy các hợp chất vừa tác dụng được với dung dịch HCl vừa tác dụng với dung dịch NaOH là:
A. AlCl3, Al2O3, Al(OH)3
B. Al2O3, Al(OH)3, NaHCO3
C. Zn(OH)2, Al2O3, Na2CO3
D. ZnO, Cu(OH)2, NH4NO3
Lời giải:
Đáp án: B
Câu 4. Chất nào sau đây là muối trung hòa
A. NaHCO3.
B. Na2HPO3.
C. NaHSO4.
D. NaH2PO4
Lời giải:
Đáp án: B
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
