Na2CO3 + HCl → NaCl + CO2 + H2O | Na2CO3 ra CO2 | Na2CO3 ra NaCl | HCl ra CO2
Na2CO3 + HCl → NaCl + CO2 + H2O là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Na2CO3 + HCl → NaCl + CO2 + H2O
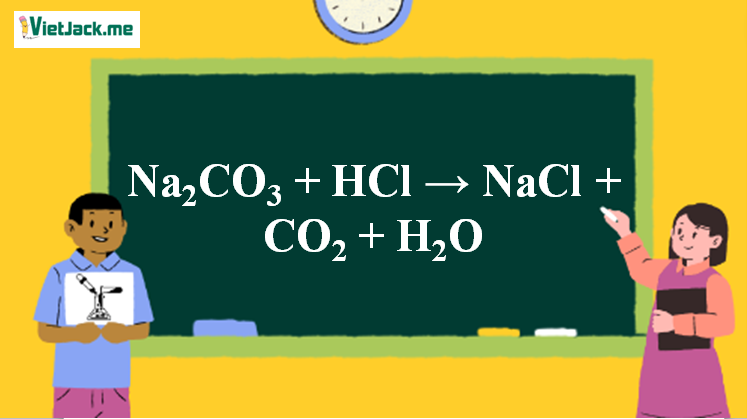
1. Phương trình Na2CO3 tác dụng HCl
Na2CO3 + 2HCl → 2NaCl + CO2+ H2O
2. Điều kiện phản ứng HCl tác dụng với Na2CO3
Nhiệt độ phòng
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của Na2CO3 (Natri cacbonat)
Na2CO3 là chất lưỡng tính tác dụng được cả axit và bazơ, khi Na2CO3 tác dụng với axit mạnh sẽ tạo thành muối và nước giải phóng khí CO2.
3.2. Bản chất của HCl (Axit clohidric)
HCl là một axit mạnh tác dụng được với chất có tính bazo.
4. Tính chất hóa học của Na2CO3
Na2CO3 là chất lưỡng tính tác dụng được cả axit và bazơ, Na2CO3 là muối trung hòa tạo môi trường trung tính nên nó có tác dụng đầy đủ tính chất hóa học như sau.
4.1.Tác dụng với axit mạnh tạo thành muối và nước giải phóng khí CO2
Na2CO3+ 2HCl → 2NaCl + H2O + CO2↑
4.2. Tác dụng với bazơ tạo muối mới và bazo mới
Na2CO3 + Ba(OH)2 → 2NaOH + BaCO3↓
4.3. Tác dụng với muối tạo hai muối mới
Na2CO3 + BaCl2→ 2NaCl + BaCO3
-
Chuyển đổi qua lại với natri bicacbonat theo phản ứng:
Na2CO3 + CO2 + H2O ⇌ 2NaHCO3
Khi tan trong nước, Na2CO3 bị thủy phân:
Na2CO3 → 2Na+ + CO32−
CO32− + H2O ⇌ HCO3− + OH− ⇒ Dung dịch Na2CO3 có tính base yếu.
Na2CO3 bị thủy phân mạnh tạo môi trường bazơ, làm đổi màu các chất chỉ thị:
Chuyển dung dịch phenolphtalein không màu sang màu hồng.
Na2CO3 làm quỳ tím chuyển sang màu xanh.
5. Ứng dụng Na2CO3
Được dùng rộng rãi trong các ngành công nghiệp thủy tinh, xà phòng, đồ gốm, phẩm nhuộm, giấy,…đặc biệt được dùng như chất đầu trong điều chế nhiều hợp chất quan trọng của natri như xút ăn da, borac, thủy tinh tan, cromat và đicromat. Dung dịch Na2CO3 dùng để tẩy sạch vết dầu mỡ bám trên chi tiết máy trước khi sơn, tráng kim loại. Na2CO3 còn được dùng trong công nghiệp sản xuất chất tẩy rửa.
6. Tính chất hóa học của HCl
Dung dịch axit HCl có đầy đủ tính chất hoá học của một axit mạnh.
6.1. Tác dụng chất chỉ thị
Dung dịch HCl làm quì tím hoá đỏ (nhận biết axit)
HCl → H+ + Cl-
6.2. Tác dụng với kim loại
Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Fe + 2HCl 
2Al + 6HCl 
Cu + HCl → không có phản ứng
6.3. Tác dụng với oxit bazo và bazo
Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2 O
CuO + 2HCl 
Fe2 O3 + 6HCl
6.4. Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3
(dùng để nhận biết gốc clorua )
Ngoài tính chất đặc trưng là axit , dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hoá mạnh như KMnO4, MnO2, K2 Cr2O7, MnO2, KClO3 ……
4HCl + MnO2 
K2 Cr2 O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2 O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan ( cường thuỷ) có khả năng hoà tan được Au ( vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
7. Bài tập vận dụng
Câu 1. Hấp thụ hoàn toàn 0,784 lít CO2 (đktc) vào 500ml dung dịch NaOH 0,08 M thu được dung dịch X. Thêm 250 ml dung dich Y gồm BaCl2 0,08 M và Ba(OH)2 a mol/l vào dung dịch X thu được 1,97 gam kết tủa và dung dịch Z. Tính a?
A. 0,02 M
B. 0,04 M
C. 0,03M
D. 0,015 M
Lời giải:
Đáp án: B
Giải thích:
nCO2 = 0,035 mol; nNaOH = 0,04 mol
⇒ nNa2CO3 = 0,005 mol; nNaHCO3 = 0,03 mol
⇒ nBaCO3 = 0,01 mol < nBaCl2 = 0,02 mol ⇒ nCO32- = nBaCO3 = 0,01 mol
OH- + HCO3- → CO32-
nOH- = nCO32- = 0,01 mol ⇒ a = 0,005/0,125 = 0,04 mol
Câu 2. Khi cắt miếng Na kim loại, bề mặt vừa cắt có ánh kim lập tức mờ đi, đó là do có sự hình thành các sản phẩm rắn nào sau đây?
A. Na2O, NaOH, Na2CO3, NaHCO3.
B. NaOH, Na2CO3, NaHCO3.
C. Na2O, Na2CO3, NaHCO3.
D. Na2O, NaOH, Na2CO3.
Lời giải:
Đáp án: A
Giải thích:
Do hàm lượng H2O và CO2 trong không khí khá nhiều:
H2O sễ chuyển Na → NaOH từ đó tác dụng với CO2
Na + H2O → NaOH + 1/2H2
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + H2O + CO2 → 2NaHCO3
Câu 3. Để điều chế kim loại Na, người ta thực hiện phản ứng:
A. Điện phân dung dịch NaOH.
B. Điện phân nóng chảy NaCl hoặc NaOH .
C. Cho dung dịch NaOH tác dụng với dung dịch HCl.
D. Cho dung dịch NaOH tác dụng với H2O.
Lời giải:
Đáp án: B
Giải thích:
Điện phân nóng chảy NaCl hoặc NaOH .
Khi điện phân NaOH nóng chảy thì ở catot (-) xảy ra quá trình khử Na+ thành Na, ở anot (+) xảy ra quá trình oxi hóa OH- thành O2 và H2O
4NaOH → 4Na + O2+ 2H2O
Câu 4. Cho các dung dịch sau: KOH; KHCO3; K2CO3; KHSO4; K2SO4, CH3COOK. Dung dịch làm cho quỳ tím đổi màu xanh là:
A. KOH; K2SO4; Na2CO3, CH3COOK
B. KHSO4; KHCO3; K2CO3.
C. KOH; KHCO3; K2CO3.
D. KHSO4; KOH; KHCO3, CH3COOK
Lời giải:
Đáp án: C
Giải thích:
Dung dịch làm cho quỳ tím đổi màu xanh là: KHSO4; KOH; KHCO3, CH3COOK
Câu 5. Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa K2CO3 0,2M và KHCO3 0,2M, sau phản ứng thu được số mol CO2 là
A. 0,02.
B. 0,03.
C. 0,04.
D. 0,01.
Lời giải:
Đáp án: D
Giải thích:
Nhỏ từ từ HCl vào dung dịch thứ tự phản ứng:
H+ + CO32- → HCO3- (1)
H+ + HCO3- → CO2 + H2O (2)
nH+ = 0,03 mol
nCO32- = 0,02 mol < nH+
nH+ (2) = nCO2= 0,03 - 0,02 = 0,01 mol
Câu 6. Kim loại nào sau đây tan được trong nước
A. Fe
B. Mg
C. Na
D. Cu
Lời giải:
Đáp án: C
Giải thích:
Kim loại nào sau đây tan được trong nước
2Na + 2H2O → 2NaOH + H2
Câu 7. Sản phẩm tạo thành có chất kết tủa khi dung dịch Na2CO3 tác dụng với dung dịch
A. NaCl.
B. BaCl2.
C. KOH.
D. KNO3.
Lời giải:
Đáp án: B
Giải thích:
Sản phẩm tạo thành có chất kết tủa khi dung dịch Na2CO3tác dụng với dung dịch là BaCl2
Phương trình phản ứng hóa học
Na2CO3 + BaCl2 → 2NaCl + BaCO3
BaCO3 là kết tủa màu trắng
Câu 8. Nhận định nào sau đây về muối cacbonat là đúng?
Tất cả các muối cacbonat đều
A. tan trong nước.
B. bị nhiệt phân tạo ra oxit kim loại và cacbon dioxit.
C. bị nhiệt phân trừ muối cacbonat của kim loại kiềm.
D. không tan trong nước.
Lời giải:
Đáp án: C
Câu 9. Phản ứng sản xuất vôi: CaCO3(r) → CaO(r) + CO2(k); ΔH > 0 .
Biện pháp kĩ thuật tác động vào quá trình sản xuất vôi để tăng hiệu suất phản ứng là
A. giảm nhiệt độ.
B. tăng nhiệt độ và giảm áp suất khí CO2.
C. tăng áp suất.
D. giảm nhiệt độ và tăng áp suất khí CO2.
Lời giải:
Đáp án: B
Giải thích:
Chiều thuận ( ∆H > 0):phản ứng thu nhiệt → tăng nhiệt độ cân bằng chuyển dịch theo chiều thuận
Giảm áp suất khí CO2 → Cân bằng chuyển dịch theo hướng tăng áp suất của hệ tức theo chiều thuận
Câu 10. Nhóm các kim loại nào sau đây đều tác dụng được với nước tạo dung dịch kiềm:
A. Na, K, Mg, Ca.
B. Fe, Mg, Ca, Ba.
C. Ba, Na, K, Ca.
D. K, Na, Ca, Cu.
Lời giải:
Đáp án: C
Giải thích:
Ba + 2H2O → Ba(OH)2 + H2
Na + H2O → NaOH + 1/2H2
K + H2O → KOH + 1/2H2
Ca + 2H2O → Ca(OH)2 + H2
Câu 11. Muối NaHCO3 không thể tham gia phản ứng nào sau đây
A. Tác dụng với axit
B. Tác dụng với kiềm
C. Tác dụng nhiệt, bị nhiệt phân
D. Tác dụng với dung dịch Ba(NO3)2.
Lời giải:
Đáp án: D
Câu 12. Hỗn hợp R gồm 2 kim loại X và Y thuộc phân nhóm chính nhóm II, ở 2 chu kỳ liên tiếp. Cho 3,52 gam R tan hoàn toàn trong dung dịch HCl dư thu được 2,688 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng, khối lượng muối khan thu được là
A. 12,04 gam
B. 3,98 gam
C. 5,68 gam
D. 7,2 gam
Lời giải:
Đáp án: A
Giải thích:
Phương trình phản ứng: R + 2HCl → RCl2 + H2
Ta có nHCl = 2nH2 = 0,24 mol
mmuối = mkim loại+ mCl- = 3,52 + 0,24. 35,5 = 12,04 gam.
Xem thêm các phương trình phản ứng hóa học khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
