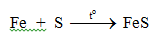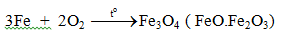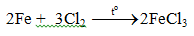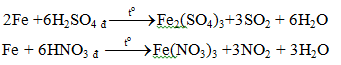Fe + HNO3 đặc → Fe(NO3)3 + N2O + H2O l Fe ra Fe(NO3)3 | HNO3 ra Fe(NO3)3 | HNO3 ra NO2
Fe + HNO3 đặc → Fe(NO3)3 + N2O + H2O là phản ứng oxi hóa khử. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Fe + HNO3 đặc → Fe(NO3)3 + N2O + H2O
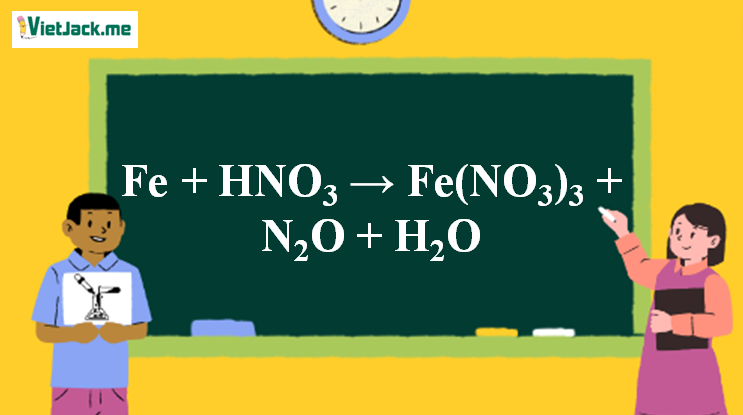
1. Phương trình phản ứng giữa Fe và HNO3 đặc
8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O + 15H2O
2. Điều kiên phản ứng xảy ra Fe và HNO3 đặc
Nhiệt độ thường
3. Cách cân bằng phương trình Fe + HNO3 → Fe(NO3)3 + N2O + H2O
Xác định số oxi hóa của các nguyên tố thay đổi
Fe0 + HN+5O3 → Fe+3(NO3)3+ N+12O + H2O
|
8x 3x |
Fe0 → Fe3+ + 3e 2N+5 + 8e → N2+1 |
Vậy ta có phương trình: 8Fe + 30HNO3 → 8Fe(NO3)3 + 3N2O↑ + 15H2O
4. Bản chất của các chất tham gia phản ứng
4.1. Bản chất của Fe (Sắt)
- Trong phản ứng trên Fe là chất khử.
- Fe là kim loại tác dụng được với các axit HNO3, H2SO4 đặc.
4.2. Bản chất của HNO3 (Axit nitric)
- Trong phản ứng trên HNO3 là chất oxi hoá.
- Đây là một monoaxit mạnh, có tính oxi hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ.
5. Tính chất hoá học của Fe
Sắt là kim loại có tính khử trung bình, tùy theo các chất oxi hóa mà sắt có thể bị oxi hóa lên mức +2 hay +3.
Fe → Fe2+ + 2e
Fe → Fe3+ + 3e
5.1. Tác dụng với phi kim
a. Tác dụng với lưu huỳnh
b. Tác dụng với oxi
c. Tác dụng với clo
5.2. Tác dụng với axit
a.Tác dụng với dung dịch axit HCl, H2SO4 loãng
Fe + 2H+ → Fe2+ + H2
b. Với các axit HNO3, H2SO4 đặc
Fe + 4HNO3 l → Fe(NO3)3 + NO + 2H2O
Chú ý: Với HNO3 đặc, nguội; H2SO4 đặc, nguội: Fe bị thụ động hóa.
5.3. Tác dụng với dung dịch muối
- Fe đẩy được kim loại đứng sau ra khỏi dung dịch muối của chúng:
Fe+ CuSO4 → FeSO4 + Cu
Chú ý:
Fe + 2Ag+ → Fe2+ + 2Ag
Ag+ dư + Fe2+ → Fe3+ + Ag
5.4. Ứng dụng của Fe
- Sắt có trong những đồ dùng cá nhân như: dao, kềm, kéo, kệ sắt, các loại dụng cụ gia đình khác,…
- Sắt ở trong các đồ nội thất như: bàn ghế, khung cửa, tủ kệ, cầu thang,…
- Các loại máy móc trong gia đình như máy xay, máy giặt, bồn rửa cũng có sắt.
- Trong giao thông vận tải sắt cũng đóng vai trò rất quan trọng.
- Sắt là bộ khung sườn cho những công trình xây dựng như nhà cửa, cầu, tòa nhà,…
6. Tính chất hóa học của HNO3
- Axit nitric là một dung dịch nitrat hydro có công thức hóa học HNO3 . Đây là một axit khan, là một monoaxit mạnh, có tính oxy hóa mạnh có thể nitrat hóa nhiều hợp chất vô cơ, có hằng số cân bằng axit (pKa) = −2.
- Axit nitric là một monoproton chỉ có một sự phân ly nên trong dung dịch, nó bị điện ly hoàn toàn thành các ion nitrat NO3− và một proton hydrat, hay còn gọi là ion hiđroni.
H3O+ HNO3 + H2O → H3O+ + NO3-
- Axit nitric có tính chất của một axit bình thường nên nó làm quỳ tím chuyển sang màu đỏ.
- Tác dụng với bazo, oxit bazo, muối cacbonat tạo thành các muối nitrat
2HNO3 + CuO → Cu(NO3)2 + H2O
2HNO3 + Mg(OH)2 → Mg(NO3)2 + 2H2O
2HNO3 + CaCO3 → Ca(NO3)2 + H2O + CO2
- Axit nitric tác dụng với kim loại: Tác dụng với hầu hết các kim loại trừ Au và Pt tạo thành muối nitrat và nước .
Kim loại + HNO3 đặc → muối nitrat + NO + H2O ( to)
Kim loại + HNO3 loãng → muối nitrat + NO + H2O
Kim loại + HNO3 loãng lạnh → muối nitrat + H2
Mg(rắn) + 2HNO3 loãng lạnh → Mg(NO3)2 + H2 (khí)
- Nhôm, sắt, crom thụ động với axit nitric đặc nguội do lớp oxit kim loại được tạo ra bảo vệ chúng không bị oxy hóa tiếp.
- Tác dụng với phi kim (các nguyên tố á kim, ngoại trừ silic và halogen) tạo thành nito dioxit nếu là axit nitric đặc và oxit nito với axit loãng và nước, oxit của phi kim.
C + 4HNO3 đặc → 4NO2 + 2H2O + CO2
P + 5HNO3 đặc → 5NO2 + H2O + H3PO4
3C + 4HNO3 loãng → 3CO2 + 4NO + 2H2O
- Tác dụng với oxit bazo, bazo, muối mà kim loại trong hợp chất này chưa lên hóa trị cao nhất:
FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
FeCO3 + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O + CO2
- Tác dụng với hợp chất:
3H2S + 2HNO3 (>5%) → 3Skết tủa + 2NO + 4H2O
PbS + 8HNO3 đặc → PbSO4 kết tủa + 8NO2 + 4H2O
Ag3PO4 tan trong HNO3, HgS không tác dụng với HNO3.
- Tác dụng với nhiều hợp chất hữu cơ: Axit nitric có khả năng phá hủy nhiều hợp chất hữu cơ, nên sẽ rất nguy hiểm nếu để axit này tiếp xúc với cơ thể người.
7. Bài tập vận dụng liên quan
Câu 1. Hệ số cân bằng của phương trình hóa học: Fe + HNO3 → Fe(NO3)3 + N2O + H2O
A. 8:24:8:3:12
B. 6:30:6:3:15
C. 6:30:6:2:15
D. 8:30:8:3:15
Lời giải:
Câu 2. Dãy nào dưới đây gồm các chất mà nguyên tố nitơ có khả năng vừa thể hiện tính oxi hóa vừa tính khử khi tham gia phản ứng hóa học?
A. NH3, N2O5, N2, NO2
B. NH3, NO, HNO3, N2O5
C. N2, NO, NO2, N2O5
D. NO2, N2, NO, N2O3
Lời giải:
Nguyên tố N có các số oxi hóa: -3, 0, +1, + 2, +3, +4, +5
Những nguyên tố N mang số oxi hóa trung gian có khả năng vừa thể hiện tính oxi hóa, vừa thể hiện tính khử khi tham gia phản ứng
Trong NH3, Nitơ có số oxi hóa -3, là số oxi hóa thấp nhất nên chỉ thể hiện tính khử.
Trong HNO3 và N2O5, N có số oxi hóa +5, là số oxi hóa cao nhất nên chỉ thể hiện tính oxi hóa.
Câu 3. R có oxit cao nhất là R2O5, trong hợp chất của R với hiđro có 17,64% khối lượng H. Nguyên tố R là:
A. S
B. P
C. N
D. Cl
Lời giải:
R có oxit cao nhất là R2O5→ hợp chất của R với hiđro có dạng RH3
%H= = → M= 14 → M là nguyên tố nitơ
Câu 4. Trong các oxit của nito thì oxit được điều chế trực tiếp từ phản ứng của nitơ với oxi là:
A. NO2
B. NO
C. N2O
D. N2O5
Lời giải:
Oxit được điều chế trực tiếp từ phản ứng của nitơ với oxi là NO.
N2 + O2 ⇔ 2NO.
Câu 5. Trong 3 oxit: FeO, Fe2O3, Fe3O4 thì chất nào phản ứng với HNO3 đặc nóng không tạo ra khí là:
A. Fe2O3
B. FeO và Fe3O4
C. Fe3O4
D. FeO
Lời giải:
Fe2O3 + 6HNO3→ 2Fe(NO3)3+ 3H2O
FeO + 4HNO3 đặc nóng → Fe(NO3)3 + NO2↑+ 2H2O
3Fe3O4 + 28HNO3 đặc nóng → 9Fe(NO3)3+ NO2↑+ 14H2O
Câu 6. Cho hỗn hợp gồm 0,14 mol Mg và 0,01 mol MgO phản ứng vừa đủ với dung dịch HNO3 thu được 0,448 lít (đktc) khí N2 và dung dịch X. Khối lượng muối trong X là:
A. 23 gam
B. 24,5 gam
C. 22,2 gam
D. 20,8 gam
Lời giải:
Bảo toàn nguyên tố Mg ta có : nMg(NO3)2= nMg+ nMgO = 0,15 mol
nkhí N2 = 0,02 mol.
Quá trình cho e:
Mg → Mg2++ 2e (1)
0,14 → 0,28 mol
Quá trình nhận e:
2NO3- + 10e + 12H+ → N2 + 6H2O (2)
0,2 ← 0,02 mol
Nểu chỉ có 1 quá trình nhận e (2) thì số mol e cho khác số mol e nhận
Do đó phải có quá trình nhận e (3) và số mol e nhận ở (3) bằng:
0,28 - 0,2=0,08 mol
NO3-+ 8e + 10H+ → NH4++ 3H2O (3)
0,08 → 0,01 mol
Muối trong X gồm 0,15 mol Mg(NO3)2 và 0,01 mol NH4NO3
→mmuối= 0,15.148+ 0,01.80 = 23 gam
Câu 7. Đốt cháy 5,6g bột Fe trong bình đựng O2 thu được 7,36g hỗn hợp X gồm 4 chất rắn. Hoà tan hỗn hợp X bằng dung dịch HNO3 vừa đủ thu được V ml (đktc) hỗn hợp khí Y gồm NO và NO2 (không còn sản phẩm khử nào khác của N+5) và dung dịch Z. Tỉ khối của Y so với H2 bằng 19. Giá trị của V là.
A. 0,336 lít
B. 0,224 lít
C. 0,896 lít
D. 1,008 lít
Lời giải:
MX = 19.2 = 38
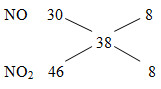
=> nN2 = nNO2 = x
mFe+ mO = moxit
=> mO = moxit- mFe = 7,36 - 5,6 = 1,76 gam
=> nO = 0,11 mol
Fe0 → Fe3+ + 3e
0,1 0,3
O0 +2e → O2-
N+5 + 3e → N+2
3x x x
N+5 +1e → N+4
0,11 0,22 x
Bảo toàn e: 0,3 = 0,22 + 3x + x =0,22 + 4x => x = 0,02
=> nkhí= 2x = 0,04 mol
=> Vkhí= 0,04.22,4 = 0,896 lít
Câu 8. Hòa tan hoàn toàn 20 gam hỗn hợp Mg và Fe trong dung dịch HCl 4M thu được 11,2 lít H2 (đktc) và dung dịch D. Để kết tủa hoàn toàn các ion trong D cần 600 ml dung dịch NaOH 2M. Thể tích dung dịch HCl đã dùng là :
A. 0,1 lít.
B. 0,3 lít.
C. 0,15 lít.
D. 0,2 lít.
Lời giải:
nNaCl= nNaOH = 1,2 (mol)
Áp dụng định luật bảo toàn nguyên tố Clo
=> nHCl= nNaCl= 1,2 (mol)
VHCl = = 0,3 lít
Câu 9. Đều chế FeCl2 bằng cách cho Fe tác dụng với dung dịch HCl. Để bảo quản dung dịch FeCl2 thu được không bị chuyển thành hợp chất sắt (III), người ta có thể cho thêm vào dung dịch
A. một lượng sắt dư .
B. một lượng kẽm dư.
C. một lượng HCl dư.
D. một lượng HNO3 dư.
Lời giải:
Dung dịch FeCl2 dễ bị không khí oxi hóa thành muối Fe3+ . Để bảo quản FeCl2 người ta thêm 1 lương Fe vì: Fe + 2Fe3+ → 3Fe2+
Không dùng HNO3 vì HNO3 oxi hóa luôn ion Fe2+ thành Fe3+,
Không dùng Zn sẽ tạo ra 1 lượng muối Zn2+,
Không dùng HCl sẽ không ngăn cản quá trình tạo Fe3+.
Xem thêm các phương trình hóa học khác:
FeCl2 + AgNO3 → Fe(NO3)2 + AgCl
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)