Al + H2SO4 → Al2(SO4)3 + H2 l Al ra Al2(SO4)3 | H2SO4 ra Al2(SO4)3
Al + H2SO4 → Al2(SO4)3 + H2 là phản ứng thế. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem:
Phản ứng Al + H2SO4(loãng)→ Al2(SO4)3 + H2
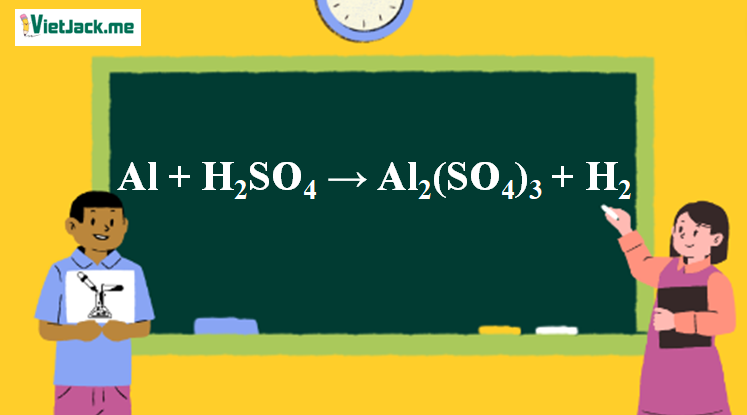
1. Phương trình phản ứng Nhôm tác dụng với axit sunfuric loãng
2Al + 3H2SO4 (loãng) → Al2(SO4)3 + 3H2
2. Điều kiện phản ứng Al+ H2SO4 loãng
Nhiệt độ phòng
3. Bản chất của các chất tham gia phản ứng
3.1. Bản chất của Al (Nhôm).
Với các axit HCl và H2SO4 loãng, nhôm có thể dễ dàng phản ứng tạo ra muối và hidro.
3.2. Bản chất của H2SO4 (Axit sunfuric).
H2SO4 là một axit mạnh, H2SO4 phản ứng với các kim loại đứng trước Hidro (trừ Pb) tạo muối sunfat.
4. Tiến hành thí nghiệm Nhôm tác dụng với axit sunfuric loãng
Cho một ít mẫu Al vào đáy ống nghiệm, thêm 1- 2ml dung dịch axit H2SO4 loãng
Kim loại bị hòa tan, đồng thời có bọt khí không màu bay ra.
5. Tính chất hóa học của Nhôm
5.1. Tác dụng với oxi và một số phi kim
4Al + 3O2→ 2Al2O3
ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững, lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng oxi trong không khí, nước.
2Al + 3Cl2 → 2AlCl3
5.2. Nhôm tác dụng với axit (HCl, H2SO4 loãng,..)
- Tác dụng với axit (HCl, H2SO4 loãng,..)
2Al + 6HCl(loãng) → 2AlCl3 + 3H2
Chú ý: Nhôm không tác dụng với H2SO4, HNO3 đặc, nguội
- Tác dụng với axit có tính oxi hóa mạnh như HNO3 hoặc H2SO4 đậm đặc
Al + 4HNO3(đặc)→ Al(NO3)3 + NO + 2H2O
Al + 6HNO3(đặc) → Al(NO3)3 + 3NO2 + 3H2O
2Al + 6H2SO4(đặc) → Al2(SO4)3 + 3SO2 + 6H2O
5.3. Tác dụng với dung dịch muối của kim loại yếu hơn
Al + 3AgNO3 → Al(NO3)3 + 3Ag
2Al + 3FeSO4 → Al2(SO4)3 + 3Fe
5.4. Tính chất hóa học riêng của nhôm
Do lớp oxit nhôm bị hòa tan trong kiềm nên nhôm phản ứng với dung dịch kiềm.
2Al + 2H2O + 2NaOH → 2NaAlO2+ 3H2↑
5.5. Phản ứng nhiệt nhôm
Phản ứng nhiệt nhôm là phản ứng hóa học toả nhiệt trong đó nhôm là chất khử ở nhiệt độ cao.
Ví dụ nổi bật nhất là phản ứng nhiệt nhôm giữa oxit sắt III và nhôm:
Fe2O3+ 2Al → 2Fe + Al2O3
Một số phản ứng khác như:
3CuO+ 2Al → Al2O3 + 3Cu
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
Cr2O3 + 2Al→ Al2O3 + 2Cr
5.6. Ứng dụng của Nhôm
Máy cắt rất dễ kiếm và các bộ phận trong nhà máy sản xuất được làm bằng Al. Với đặc tính sáng và không rỉ sét, Al dần trở thành vật liệu không thể thiếu đối với mọi nhà máy. Một số mặt hàng được làm bằng Al, chẳng hạn như: Khung xe máy, khung xe hơi, thùng xe tải, các chi tiết tản nhiệt...
Đặc biệt, Al được sử dụng trong sản xuất trong ngành hàng không vũ trụ. Thân máy bay và cánh được làm bằng nhôm. Các ứng dụng dựa vào trọng lượng riêng nhẹ và bền của nhôm là rất cần thiết để tiết kiệm tối đa trọng lượng trong không khí.
6. Tính chất hoá học của H2SO4
6.1. H2SO4 loãng
Axit sunfuric là một axit mạnh, hóa chất này có đầy đủ các tính chất hóa học chung của axit như:
- Axit sunfuric H2SO4 làm chuyển màu quỳ tím thành đỏ.
- Tác dụng với kim loại đứng trước H (trừ Pb) tạo thành muối sunfat.
Fe + H2SO4 → FeSO4 + H2
- Tác dụng với oxit bazo tạo thành muối mới (trong đó kim loại giữ nguyên hóa trị) và nước .
FeO + H2SO4 → FeSO4 + H2O
- Axit sunfuric tác dụng với bazo tạo thành muối mới và nước.
H2SO4 + NaOH → NaHSO4 + H2O
H2SO4 + 2NaOH → Na2SO4 + 2H2O
- H2SO4 tác dụng với muối tạo thành muối mới (trong đó kim loại vẫn giữ nguyên hóa trị) và axit mới.
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2
H2SO4 + 2KHCO3 → K2SO4 + 2H2O + 2CO2
6.2. H2SO4 đặc
Axit sunfuric đặc có tính axit mạnh, oxi hóa mạnh với tính chất hóa học nổi bật như:
- Tác dụng với kim loại: Khi cho mảnh Cu vào trong H2SO4 tạo ra dung dịch có màu xanh và có khí bay ra với mùi sốc.
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Tác dụng với phi kim tạo thành oxit phi kim + H2O + SO2.
C + 2H2SO4 → CO2 + 2H2O + 2SO2 (nhiệt độ)
2P + 5H2SO4 → 2H3PO4 + 5SO2 + 2H2O
- Tác dụng với các chất khử khác.
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
- H2SO4 còn có tính háo nước đặc trưng như đưa H2SO4 vào cốc đựng đường, sau phản ứng đường sẽ bị chuyển sang màu đen và phun trào với phương trình hóa học như sau.
C12H22O11 + H2SO4 → 12C + H2SO4.11H2O
7. Bài tập vận dụng liên quan
7.1.Câu hỏi trắc nghiệm nhôm và hợp chất của nhôm
Câu 1. Dung dịch H2SO4 loãng tác dụng với chất nào tạo ra khí hiđro?
A. NaOH
B. Al
C. CaO
D. CO2
Lời giải:
Phương trình hóa học xảy ra
2Al + 3H2SO4(loãng) → Al2(SO4)3 + 3H2
Câu 2. Tính chất hóa học nào không phải của axit
A. Tác dụng với kim loại
B. Tác dụng với muối
C. Tác dụng với oxit axit
D. Tác dụng với oxit bazơ
Lời giải:
Câu 3. Dung dịch tác dụng với CuO tạo ra sản phẩm là dung dịch có màu xanh lam:
A. Dung dịch NaOH
B. Dung dịch Na2CO3
C. Dung dịch HCl
D. Dung dịch Ca(OH)2
Lời giải:
Phương trình phản ứng hóa học xảy ra
CuO + 2HCl → CuCl2 + H2O
Câu 4. Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là:
A. Fe, Cu, Mg
B. Zn, Fe, Cu
C. Zn, Fe, Al.
D. Fe, Zn, Ag
Lời giải:
Phương trình phản ứng hóa học
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4 → FeSO4 + H2
2Al + 3H2SO4(loãng) → Al2(SO4)3 + 3H2
Câu 5. Nhóm chất tác dụng với nước và với dung dịch HCl là:
A. Na2O, SO3, CO2.
B. K2O, P2O5, CaO
C. BaO, SO3, P2O5
D. CaO, BaO, Na2O
Lời giải:
Phương trình phản ứng hóa học xảy ra
CaO + H2O → Ca(OH)2
CaO + 2HCl → CaCl2 + H2O
BaO + H2O → Ca(OH)2
BaO + 2HCl → BaCl2 + H2O
Na2O + H2O → 2NaOH
Na2O + 2HCl → 2NaCl + H2O
Câu 6. Có thể dùng hóa chất nào sau đây để phân biệt 3 chất rắn Mg, Al, Al2O3 đựng trong các lọ riêng biệt?
A. H2SO4 loãng.
B. NaOH.
C. HCl đặc.
D. NH3.
Lời giải:
Trích mẫu thử và đánh số thứ tự
Cho từng chất rắn trong lọ tác dung với NaOH.
Không có hiện tượng xảy ra là kim lọa Mg.
Chất rắn tan dần, có khí thoát ra chính là Al
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Chất rắn tan dần chính là Al2O3
Al2O3 + 2NaOH → 2NaAlO2+ H2O
Câu 7. Dùng m gam Al để khử hết 3,2 gam Fe2O3 (phản ứng nhiệt nhôm). Sản phẩm sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo 1,344 lít khí (đktc). Giá trị của m là
A. 0,540 gam.
B. 0,810 gam.
C. 1,080 gam.
D. 1,755 gam.
Lời giải:
nFe2O3 = = 0,02 mol;
nH2 = = 0,06 mol
Phương trình phản ứng hóa học
2Al + Fe2O3 Al2O3 + 2Fe (1)
0,04 ← 0,02 mol
Khi Al dư thì:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (2)
0,04 mol ← 0,06 mol
=> ∑nAl ban đầu = nAl (1) + nAl (2) = 0,04 + 0,04 = 0,08 mol
=> mAl= 0,08.27 = 2,16 gam
Câu 8. Kim loại vừa tác dụng với dung dịch HCl vừa tác dụng với dung dịch NaOH là:
A. Fe
B. Mg
C. Ca
D. Al
Lời giải:
Al vừa tác dụng với dung dịch HCl vừa tác dụng với dung dịch NaOH
Phương trình phản ứng hóa học
2Al + 6HCl → 2AlCl3+ 3H2↑
Al + NaOH + H2O → NaAlO2 + H2↑
Câu 9. Để hòa tan hoàn toàn m gam Al cần dùng 200 ml dung dịch chứa NaOH 1M và Ba(OH)2 0,5M. Giá trị của m là
A. 5,4 gam
B. 10,8 gam
C. 2,7 gam
D. 6 gam
Lời giải:
nNaOH = 0,2 mol;
nBa(OH)2 = 0,1 mol
Phương trình phản ứng hóa học
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
0,2 ← 0,2 mol
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2↑
0,2 ← 0,1 mol
=> ∑nAl phản ứng = 0,2 + 0,2 = 0,4 mol => mAl = 0,4.27 = 10,8 gam
Câu 10. Cho 10,8 gam bột nhôm vào 200 ml dung dịch KOH, sau phản ứng thấy khối lượng dung dịch tăng 7,2 gam. Nồng độ mol/lít của dung dịch KOH là
A. 0,75M
B. 1,5M
C. 2M
D. 1M
Lời giải:
nAl = 0,4 mol
Gọi số mol Al phản ứng là a mol
Phương trình hóa học
2Al + 2KOH + 2H2O → 2KAlO2 + 3H2↑
a → a →
Khối lượng dung dịch tăng 7,2 gam => ∆mtăng = mAl – mH2 = 7,2 gam
=> 27x – .2 = 7,2 => x = 0,3 mol
Theo phương trình hóa học
nKOH = nAl phản ứng = 0,3 mol
=>CMNaOH= = 1,5M
Câu 11. Hỗn hợp X gồm Na và Al. Cho m gam X vào một lượng dư nước thì thoát ra V lít khí. Nếu cũng cho m gam X vào dung dịch NaOH (dư) thì được 1,75V lít khí. Thành phần phần trăm theo khối lượng của Na trong X là (biết các thể tích khí đo ở cùng điều kiện)
A. 29,87%.
B. 77,31%.
C. 49,87%.
D. 39,87%.
Lời giải:
Theo bài ra khi cho m gam X vào nước Na hết, Al dư. Khi cho m gam X vào NaOH dư, cả hai chất hết.
Gọi số mol Na và Al trong hỗn hợp X lần lượt là x và y mol.
Trường hợp 1:
Phương trình phản ứng hóa học
2Na + 2H2O → 2NaOH + H2
x x mol
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
x x
→ ∑nH2 = + = 2x.
Trường hợp 2:
Phương trình phản ứng hóa học
2Na + 2H2O (x) → 2NaOH + H2
x x
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
y
→ nkhí = 0,5x + 1,5y
Có thể tích các khí đo ở cùng điều kiện, do đó tỉ lệ về thể tích cũng chính là tỉ lệ về số mol
= =
=> y = 2x => %mNa = .100 = .100 = 29,87%
Câu 12. Dùng m gam Al để khử hết 3,2 gam Fe2O3 (phản ứng nhiệt nhôm). Sản phẩn sau phản ứng tác dụng với lượng dư dung dịch NaOH tạo ra 1,344 lít khí (đktc). Giá trị của m là
A.1,755
B. 2,160
C.1,080
D.0,540
Lời giải:
nFe2O3 = = 0,02 mol;
nH2 = = 0,06 mol
Phương trình phản ứng hóa học
2Al + Fe2O3→ Al2O3 + 2Fe (1)
0,04 ← 0,02 mol
Khi Al dư thì:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (2)
0,04 mol ← 0,06 mol
=> ∑nAl ban đầu = nAl(1) + nAl (2) = 0,04 + 0,04 = 0,08 mol
=> mAl = 0,08.27 = 2,16 gam
Câu 13. Cho 10,8 gam bột nhôm tác dụng với 200 ml dung dịch NaOH 0,2M. Sau khi phản ứng xảy ra hoàn toàn thu được V lít khí hiđro (đktc). Giá trị của V là
A. 1,344 lít.
B. 0,672 lít.
C. 0,448 lít.
D. 6,72 lít.
Lời giải:
nAl= = 0,4 mol
nNaOH = 0,2.0,2 = 0,04 mol
Phương trình phản ứng
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
0,4 0,4
Sau phản ứng Al dư, NaOH hết
nNaOH = 0,04 mol → nH2= 0,06 mol
VH2 = 0,06.22,4 = 1,344
Câu 14. Phản ứng hóa học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm?
A. Al tác dụng với H2SO4 đặc, nóng.
B. Al tác dụng với CuO nung nóng.
C. Al tác dụng với Fe2O3 nung nóng.
D. Al tác dụng với Fe3O4 nung nóng.
Lời giải:
Al tác dụng với Fe3O4 nung nóng.Phản ứng nhiệt nhôm là cho nhôm khử các oxit của kim loại
=> Phản ứng hoá học không thuộc loại phản ứng nhiệt nhôm là Al tác dụng với axit H2SO4 đặc, nóng.
8Al + 3Fe3O4 → 4Al2O3 + 9Fe
2Al + 3CuO → Al2O3 + 3Cu
2Al + Fe2O3 → Al2O3 + 2Fe
7.2. Câu hỏi bài tập tự luận
Bài tập 1. Để hòa tan hoàn toàn m gam Al cần dùng 100 ml dung dịch chứa KOH 1M và Ba(OH)2 0,5M. Giá trị của m là
Đáp án hướng dẫn giải chi tiết
nNaOH= 0,1mol;
nBa(OH)2= 0,05 mol
Phương trình phản ứng hóa học
2Al + 2KOH + 2H2O → 2NaKO2 + 3H2↑
0,1 ← 0,1 mol
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2↑
0,1 ← 0,05 mol
=> ∑nAl phản ứng = 0,1 + 0,1 = 0,2 mol => mAl= 0,2.27 = 5,4 gam
Bài tập 2. Trộn 5,4 gam nhôm với 4,8 gam Fe2O3 rồi tiến hành nhiệt nhôm không có không khí sau phản ứng thu m gam chất rắn. Giá trị của m là
Đáp án hướng dẫn giải chi tiết
Áp dụng Bảo toàn khối lượng:
mhh trước phản ứng = mhh sau phản ứng = 5,4 + 4,8= 10,2 gam
Bài tập 3. Đốt nóng một hỗn hợp gồm Al và 16 gam Fe2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng vừa đủ với V ml dung dịch NaOH 1M sinh ra 3,36 lít H2 (ở đktc). Giá trị của V là
Đáp án hướng dẫn giải chi tiết
Ta có:
Phương trình phản ứng hóa học
2Al + Fe2O3 → Al2O3 + 2Fe (1)
Vì X tác dụng với NaOH tạo 0,15 mol H2 => Al dư
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Al2O3+ 2NaOH → 2NaAlO2 + H2O
Vì nH2 = 0,15 => nAl dư = nH2 = 0,1 mol
nFe2O3 = 0,1 => nAl (1) = 0,2 mol
=> Tổng số mol Al dùng là:
Theo bảo toàn nguyên tố (để ý tỉ lệ Na:Al trong NaAlO2 là 1:1)
=> nNa+ = 0,3 mol => V = 300 ml
Bài tập 4. Hòa tan hoàn toàn 9,6g kim loại M trong dung dịch H2SO4 đặc nóng thu được khí SO2. cho khí này hấp thụ hết vào 400ml dung dịch NaOH thu đc dung dịch X chứa 22,9 gam chất tan, xác định kim loại M.
Đáp án hướng dẫn giải chi tiết
Theo mình tìm hiểu thì nồng độ NaOH đề cho là 1M.
2M + 2nH2SO4 → M2(SO4)n + nSO2+ 2nH2O
......................................
SO2+ 2NaOH → Na2SO3 + H2O
x............2x............x
SO2 + NaOH → NaHSO3
y...........y.............y
2x + y = 0,4
126x + 104y = 22,9
Hệ vô nghiệm, chứng tỏ NaOH còn dư, hay nói cách khác, dung dịch sau phản ứng chỉ gồm Na2SO3 và NaOH dư.
SO2 + 2NaOH → Na2SO3 + H2O
a..........2a................a
126a + 40.b = 22,9 (với b = nNaOH dư)
<=> 126a + 40.(0,4 - 2a) =22,9
<=> a = 0,15 mol
nSO2 = a = 0,15 mol =
=> M = 32n
Vậy M là Cu (n = 2).
Bài tập 5. Có một loại quặng pirit chứa 96% FeS2. Nếu mỗi ngày nhà máy sản xuất 100 tấn H2SO4 98% thì lượng quặng pirit trên cần dùng là bao nhiêu ? Biết hiệu suất điều chế H2SO4 là 90%.
Đáp án hướng dẫn giải chi tiết
Sơ đồ phản ứng:
FeS2 → 2H2SO4(hiệu suất 90%)
120 → 196
60 ← 98 tấn
H = 90% => mFeS2 thực tế = = tấn
Vì quặng chứa 96% FeS2 => mquặng = . = 69,44 tấn
Bài tập 6. Nhiệt nhôm hỗn hợp A gồm Fe2O3 và Al trong điều kiện không có không khí thu được hỗn hợp chất rắn B. Cho B tác dụng với dung dịch NaOH dư sẽ thu được 0,3 mol H2. Mặt khác nếu cho B tác dụng với dung dịch HCl dư sẽ thu được 0,4 mol H2. Số mol Al trong A là:
Đáp án hướng dẫn giải chi tiết
Vì B tác dụng với NaOH sinh ra khí H2 nên có Al còn dư → Fe2O3 phản ứng hết.
Vậy B gồm có Al dư, Al2O3 và Fe.
- Y tác dụng với NaOH sinh khí H2.
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 (1)
=> nAl dư = nH2 = .0,3 = 0,2 mol
- B tác dụng với HCl sinh khí H2.
2Al + 6HCl → 2AlCl3 +3H2 (2)
Fe + HCl → FeCl2 + H2 (3)
⇒ nH2(2) = nAl dư = . 0,2 = 0,3 mol
⇒ nH2(3) = nFe = nH2 - nH2(2) = 0,4-0,3= 0,1 mol
- Phản ứng nhiệt nhôm:
2Al + Fe2O3 → Al2O3 + 2Fe (4)
Theo phản ứng (4) ta có:
⇒ nAl ban đầu = nAl dư + nAl pư = 0,2+0,1 = 0,3 mol → m↓ = mAl(OH)3 = 0,1.78 =7,8g
Xem thêm các phương trình hóa học khác:
Al + H2SO4 → Al2(SO4)3 + SO2 + H2O
Al + H2SO4 → Al2(SO4)3 + S + H2O
Al + HNO3 → H2O + NO2 + Al(NO3)3
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
