AgNO3 + NaCl → AgCl + NaNO3 | AgNO3 ra AgCl | NaCl ra NaNO3 | NaCl ra AgCl
AgNO3 + NaCl → AgCl + NaNO3 là phản ứng trao đổi. Bài viết này cung cấp đầy đủ thông tin về phương trình hóa học đã được cân bằng, điều kiện các chất tham gia phản ứng, hiện tượng (nếu có), ... Mời các bạn đón xem
Phản ứng AgNO3 + NaCl → AgCl + NaNO3
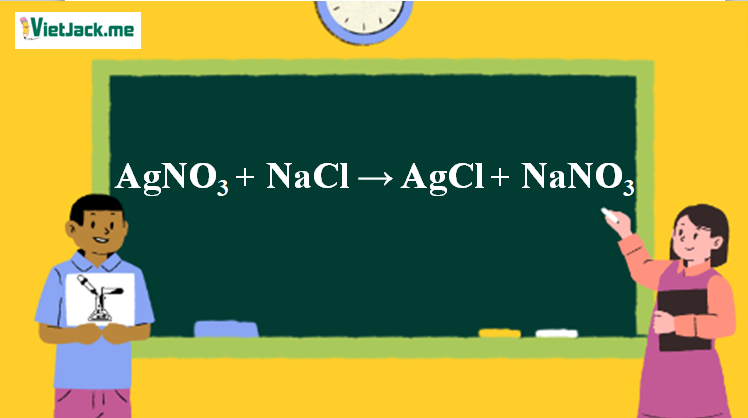
1. Phương trình phản ứng AgNO3 tác dụng NaCl
AgNO3 + NaCl → AgCl↓trắng + NaNO3
2. Điều kiện phản ứng xảy ra
Nhiệt độ thường
3. Hiện tượng phản ứng giữa AgNO3 tác dụng NaCl
Khi cho dung dịch AgNO3 tác dụng với dung dịch NaCl, sau phản ứng tạo thành bạc clorua không tan có màu trắng.
4. Mở rộng kiến thức về AgNO3
4.1. Tính chất vật lí & nhận biết
- Tính chất vật lí: Là chất rắn, có màu trắng, tan tốt trong nước, có nhiệt độ nóng chảy là 212oC.
- Nhận biết: Sử dụng muối NaCl, thu được kết tủa trắng
AgNO3 + NaCl →AgCl↓+ NaNO3
4.2. Tính chất hóa học
- Mang tính chất hóa học của muối
Tác dụng với muối
AgNO3 + NaCl →AgCl↓+ NaNO3
2AgNO3 + BaCl2 →2AgCl↓+ Ba(NO3)2
Tác dụng với kim loại:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Tác dụng với axit:
AgNO3 + HI → AgI ↓ + HNO3
Oxi hóa được muối sắt (II)
Fe(NO3)2 + AgNO3 → Fe(NO3)3 + Ag
4.3. Điều chế
Bạc nitrat điều chế bằng cách hòa tan kim loại bạc trong dung dịch axit nitric.
3Ag + 4 HNO3(loãng) → 3AgNO3 + 2H2O + NO
3Ag + 6 HNO3(đặc, nóng) → 3AgNO3 + 3 H2O + 3NO2
4.4. Ứng dụng
- Hóa phân tích:
Bạc Nitrat được sử dụng để kết tủa các ion clorua và cơ sở hoạt động của bạc nitrat được sử dụng để hiệu chuẩn dung dịch natri clorua.
- Trong công nghiệp:
AgNO3 được sử dụng để sản xuất muối bạc khác.
AgNO3 được sử dụng để tạo ra chất kết dính dẫn điện, máy lọc khí mới, sàng phân tử A8x , quần áo cân bằng áp suất mạ bạc và găng tay để làm việc trực tiếp.
AgNO3 được sử dụng để làm vật liệu nhạy sáng cho phim, phim x-quang và phim ảnh.
AgNO3 sử dụng để mạ bạc các linh kiện điện tử và thủ công mỹ nghệ khác và cũng được sử dụng rộng rãi làm vật liệu mạ bạc cho gương và phích nước.
AgNO3 được sử dụng để sản xuất pin bạc-kẽm.
- Ứng dụng trong y học:
AgNO3 được sử dụng trong y học để ăn mòn mô hạt tăng sinh và dung dịch loãng được sử dụng làm thuốc diệt nấm cho nhiễm trùng mắt.
5. Bài tập vận dụng liên quan
Câu 1. Cho dung dịch AgNO3 vào dung dịch NaCl thì có hiện tượng là:
A. Có bọt khí thoát ra, dung dịch thu được không màu
B. Có xuất hiện kết tủa trắng
C. Dung dịch đổi màu vàng nâu
D. Không có hiện tượng gì xảy ra
Lời giải:
Câu 2. Kết tủa hoàn toàn m gam NaCl bởi dung dịch AgNO3 dư thấy thu được 2,87 gam kết tủa. Giá trị của m là
A. 11,7 gam.
B. 1,71 gam.
C. 17,1 gam.
D. 1,17 gam.
Lời giải:
nkết tủa = = 0,02 mol
Phương trình phản ứng hóa học
AgNO3+ NaCl → AgCl↓trắng + NaNO3
0,02 ← 0,02
mNaCl = 0,2. 58,5 = 11,7 gam
Câu 3. Cho m gam muối NaCl tác dụng với dung dịch AgNO3 dư thì thu được một kết tủa , kết tủa này sau khi phản ứng phân hủy hoàn toàn cho 1,08 gam bạc. Tính giá trị của m
A. 0,585 gam
B. 5,850 gam
C. 1,17 gam
D. 1,755 gam
Lời giải:
NaCl + AgNO3 → NaNO3 + AgCl
2AgCl 2Ag + Cl2
nAg ==0,01 (mol)
==> nAgCl = nAg= 0,01 (mol)
nNaCl = nAgCl = 0,01 (mol)
==> mNaCl = 0,01.58,5=0,585 (g)
Vậy m = 0,585 gam.
Câu 4. Cho phản ứng NaOH + HCl → NaCl + H2O. Phản ứng hóa học nào sau đây có cùng phương trình ion thu gọn với phản ứng trên?
A. 2KOH + FeCl2 → Fe(OH)2 + 2KCl.
B. NaOH + NH4Cl → NaCl + NH3 + H2O.
C. NaOH + HNO3 → NaNO3 + H2O.
D. AgNO3 + NaCl → AgCl↓ + NaNO3
Lời giải:
Phương trình ion rút gọn của phản ứng NaOH + HCl → NaCl + H2O là:
OH- + H+ → H2O
A. 2OH- + Fe2+ → Fe(OH)2
B. OH- + NH4+ → NH3 + H2O
C. OH- + H+ → H2O
D. Ag+ + Cl- → AgCl
Câu 5. Trong các cặp chất cho dưới đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
A. AlCl3 và CuSO4.
B. NH3 và AgNO3.
C. AgNO3 và NaCl .
D. NaHSO4 và NaHCO3.
Lời giải:
Câu 6. Cho một mẫu K vào 200ml dung dịch AlCl3 thu được 2,8 lit khí (đktc) và một kết tủa A. Nung A đến khối lượng không đổi thu được 2,55 gam chất rắn. Tính nồng độ mol/l của dung dịch AlCl3
A. 0,375M
B. 0,75M
C. 0,025M
D. 0,45M
Lời giải:
mrắn: Al2O3 → nAl2O3 = 0,025 mol
→ nAl(OH)3 = 0,05 mol
nKOH = 2nH2 = 0,25 mol.
TH1: KOH thiếu, chỉ có phản ứng.
3KOH + AlCl3 → Al(OH)3 + 3KCl
Không xảy ra vì số mol Al(OH)3 tạo ra trong phản ứng > số mol Al(OH)3 đề cho.
TH2: KOH dư, có 2 phản ứng xảy ra.
3KOH + AlCl3 → Al(OH)3+ 3KCl
0,15 0,05 0,05 mol
4KOH + AlCl3→ KAlO2 + 3KCl + H2O
(0,25 – 0,15) 0,025
Tổng số mol AlCl3 phản ứng ở 2 phương trình là 0,075 mol
→ Nồng độ của AlCl3 = 0,375M
Câu 7. Cho m gam Fe tác dụng hết với dung dịch CuSO4 dư, thu được 28,8 gam Cu. Giá trị của m là
A. 50,4.
B. 12,6.
C. 16,8.
D. 25,2.
Lời giải:
nCu= 0,45 mol
Phương trình hóa học
CuSO4 + Fe → FeSO4+ Cu
0,45 ← 0,45 mol
⟹ mFe = 0,45.56 = 25,2 gam
Xem thêm các phương trình hóa học khác:
AgNO3 + H2O + NH3 + HCOOH → (NH4)2CO3 + Ag + NH4NO3
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
