Phương trình Claperon - Mendeleep và cách giải các dạng bài tập (2025) chi tiết nhất
Với tài liệu về Phương trình Claperon - Mendeleep và cách giải các dạng bài tập chi tiết nhất bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Vật lí hơn.
Phương trình Claperon - Mendeleep và cách giải các dạng bài tập chi tiết nhất
I. Lý thuyết
1. Khái niệm
- Phương trình Claperon - Mendeleep được xây dựng từ phương trình trạng thái của khí lí tưởng áp dụng cho trạng thái của lượng khí xác định ở điều kiện tiêu chuẩn.
- Phương trình Claperon - Mendeleep cho biết mối liên quan của ba đại lượng: áp suất p, thể tích V, nhiệt độ T với khối lượng (hoặc số mol) của lượng khí.
2. Phương trình Claperon - Mendeleep
pV=nRT=mMRT=NNART=mμRT
Trong đó:
R = 8,314 J/mol.K với p (Pa), V (m3)
μ là khối lượng mol nguyên tử (g).
m là khối lượng nguyên tử (g).
n là số mol.
T (K) = toC + 273
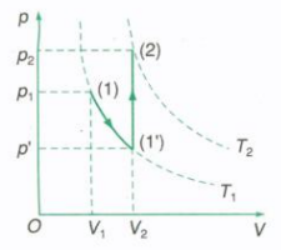
Đồ thị biểu diễn quá trình biến đổi trạng thái trong hệ tọa độ (p, V)
Chuyển lượng khí từ trạng thái 1 (p1, V1, T1) sang trạng thái 2 (p2, V2, T2) qua trạng thái trung gian 1’ (p’, V2, T1) bằng các đẳng quá trình.
3. Kiến thức mở rộng
- Số mol:
n=NNA=mM=V22,4=mμ
- Số phân tử / nguyên tử:
N=nNA=mMNA=V22,4NA=mμNA
- Khối lượng:
m=nM=NNAM=V22,4M=NNAμ=V22,4μ
- Khối lượng riêng:
D=mV⇒m=D.V⇒V=mD
- Từ phương trình Claperon - Mendeleep, ta có thể tính:
+ Áp suất:p=mμVRT
+ Thể tích: V=mμpRT
+ Nhiệt độ tuyệt đối: T=PVμRm
+ Số mol: n=PVRT
+ Khối lượng nguyên tử: m=PVμRT
+ Khối lượng mol nguyên tử: μ=mPVRT
- Khi áp dụng công thức Claperon - Mendeleep:
+ Áp suất có đơn vị là atm thì thể tích phải có đơn vị là lít, với:
R = 0,082 l.atm/mol.K
+ Áp suất có đơn vị là Pa, N/m2 thì thể tích phải có đơn vị là m3, với:
R = 8,314 J/mol.K
II. Bài tập vận dụng
Bài 1:Một khí chứa trong một bình dung tích 3 lít có áp suất 200kPa và nhiệt độ 16°C có khối lượng 11g. Khối lượng mol của khí ấy là bao nhiêu?
Lời giải
Theo bài ta có:
V = 3 l = 3.10-3 m3
p = 200 kPa = 200.103 Pa
T = 16 + 273 = 289 K
Áp dụng phương trình Claperon - Mendeleep:
μ=mpVRT=11.8,31.289200.103.3.10-3≈44g/mol
Bài 2: Một bình chứa khí ờ nhiệt độ 27°C và áp suất 40atm. Hỏi khi một nửa lượng khí thoát ra ngoài thì áp suất của nó còn lại trong bình là bao nhiêu? Biết nhiệt độ của bình khi đó là 12°C.
Lời giải
Khi khí chưa thoát ra ngoài, ta có: p1V1=m1μRT1(1)
Khi một nửa lượng khí đã thoát ra ngoài, ta có: p2V2=m2μRT2
Với V1 = V2; m2 = m12⇒p2V1=m12μRT2(2)
Từ (1) và (2) ⇒p2=p1T22T1=40.2852.300=19atm
Bài 3: Khí cầu có dung tích 328m3 được bơm khí hidro. Khi bơm xong, hidro trong khí cầu có nhiệt độ 27°C, áp suất 0,9atm. Hỏi phải bơm bao nhiêu lâu nếu mỗi giây bơm được 2,5g hidro vào khí cầu?
Lời giải:
V = 328m3 = 328.103lít;
T = 300K; p = 0,9atm,
R = 0,082 atm.lít/mol.K, µ = 2g/mol.
Gọi m là khối lượng khí đã bơm vào khí cầu.
Ta có:
pV = mμRT ⇒ m = μpVRT= 24000g.
Do đó: t = m/2,5 = 9600s.
Bài 4: Trong một ống dẫn khí tiết diện đều s = 5cm2 có khí CO2 chảy qua ở nhiệt độ 35°C và áp suất 3.105N/m2. Tính vận tốc của dòng khí biết trong thời gian 10 phút có m = 3kg khí CO2 qua tiết diện ống.
Lời giải:
S = 5.10-4m2; T = 308K; m = 3kg; µ = 44 kg/mol; R = 8,31.10-3 kJ/kmol.K, p = 3.105N/m2, t = 600s
Thể tích khí qua ống trong thời gian 10 phút: V = v.S.t
pV = mμ)RT ⇒ v = 1,939 m/s
Bài 5: Bài tập 20. Bình chứa được 4g khí Hidro ở 53°C dưới áp suất 44,4.105 N/m2. Thay Hidro bởi khí khác thì bình chứa được 8g khí mới ở 27°C dưới áp suất 5.105N/m2. Khi thay Hidro là khí gì? biết khí này là đơn chất.
Lời giải:
p1p2=m1μ2T1m2μ1T2 ⇒ µ2 = 32 ⇒ O2
Bài 6: Hai bình có thể tích V1 = 100cm3, V2 = 200cm3 được nối bằng một ống nhỏ cách nhiệt. Ban đầu hệ có nhiệt độ t = 27°C và chứa Oxi ở áp suất p = 760mmHg. Sau đó bình V1 được giảm nhiệt độ xuống 0°C còn bình V2 tăng nhiệt độ lên đến 100°C. Tính áp suất khí trong các bình.
Lời giải:
Ban đầu, bình I có thể tích V1 = V, áp suất p, nhiệt độ T. Bình II có thể tích V2 = 2V, áp suất p, nhiệt độ T. Tổng số mol khí trong 2 bình là:
n=p.3VRT(1)
Sau đó, bình I có thể tích V1, áp suất p’, nhiệt độ T1 nên số mol khí của bình I là:
n1=p'VRT1(2)
Bình II có thể tích V2, áp suất p’, nhiệt độ T2 nên số mol khí của bình II là:
n2=p'.2VRT2(3)
Mặt khác:
n=n1+n2⇔p.3VRT=p'VRT1+p'.2VRT2⇔p'=3pT(1T1+2T2)
Với T = 27 + 273 = 300K
T1 = 273K
T2 = 100 + 273 = 373K
Vậy p’ = 842mmHg.
Bài 7: Bình dung tích V = 4lít chứa khí có áp suất p1 = 840mmHg, khối lượng tổng cộng của bình và khí là m1 = 546g. Cho một phần khí thoát ra ngoài, áp suất giảm đến p2 = 735mmHg, nhiệt độ như cũ, khối lượng của bình và khí còn lại là m2 = 543g. Tìm khối lượng riêng của khí trước và sau thí nghiệm.
Lời giải:
Ban đầu, khí trong bình có khối lượng m, thể tích V, áp suất p1, nhiệt độ T1:
p1V=mμRT1(1)
Khi có một phần khí thoát ra, khí trong bình có khối lượng m’, thể tích V, áp suất p2, nhiệt độ T2 = T1:
p2V=mμRT1 (2)
Do đó:
p1p2=mm'⇔mm-m'=p1p1-p2=840840-735=8
Suy ra:
m = 8(m – m’) = 8(m1 - m2) = 24g.
m’ = 21g.
Khối lượng riêng của khí trong bình lúc đầu là: D=mV=6g/l
Khối lượng riêng của khí trong bình lúc sau là: D=m'V=5,25g/l
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- Phương trình hóa học | Tổng hợp PTHH của các chất hữu cơ, vô cơ chính xác nhất
- Đồng phân & Công thức cấu tạo của các chất hữu cơ
- Nhận biết các chất Hóa học
- Cấu hình electron
- So sánh bán kính nguyên tử và bán kính ion
- 1000 câu hỏi ôn tập môn Hóa có đáp án
- Wiki các chất hóa học | Định nghĩa, tính chất, nhận biết, điều chế, ứng dụng
- Cách đọc danh pháp hóa học (chương trình mới) đầy đủ nhất
- Công thức Lewis của một số chất thường gặp (chương trình mới)
- Công thức electron của một số chất thường gặp (chương trình mới)
- Công thức cấu tạo của một số chất thường gặp (chương trình mới)
- Công thức hợp chất khí với hidro của các nguyên tố (phổ biến) | Cách viết công thức hợp chất khí với hidro
- Công thức hidroxit cao nhất của các nguyên tố (phổ biến) | Cách viết công thức hidroxit cao nhất
- Công thức oxit cao nhất của các nguyên tố (phổ biến) | Cách viết công thức oxit cao nhất
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
