Phương trình Claperon và cách giải các dạng bài tập (2025) chi tiết nhất
Với tài liệu về Phương trình Claperon và cách giải các dạng bài tập chi tiết nhất bao gồm: lý thuyết và bài tập cũng như những định nghĩa, tính chất, các dạng bài sẽ giúp bạn nắm vững kiến thức và học tốt môn Vật lí hơn.
Phương trình Claperon và cách giải các dạng bài tập chi tiết nhất
I. Lý thuyết
1. Khái niệm
- Phương trình Cla-pe-ron là phương trình xác định mối liên hệ giữa ba thông số trạng thái (áp suất, thể tích, nhiệt độ) của chất khí.
2. Phương trình Cla-pe-ron
Gọi p1, V1, T1 là áp suất, thể tích và nhiệt độ của lượng khí ở trạng thái 1. Thực hiện một quá trình bất kì chuyển khí sang trạng thái 2 có áp suất p2, thể tích V2 và nhiệt độ T2.
Mối liên hệ giữa các đại lượng đó là:
p1.V1T1=p2.V2T2
Việc chọn trạng thái 1, 2 là bất kì.
Do đó, ta có phương trình Cla-pe-ron
p.VT=hằng
Trong đó:
+ p là áp suất (N/m2 hoặc Pa)
+ V là thể tích (m3)
+ T là nhiệt độ tuyệt đối (K)
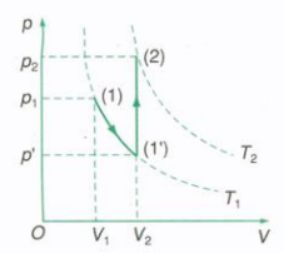
Đồ thị biểu diễn quá trình biến đổi trạng thái trong hệ tọa độ (p,V)
Chuyển lượng khí từ trạng thái 1 (p1, V1, T1) sang trạng thái 2 (p2, V2, T2) qua trạng thái trung gian 1’ (p’, V2, T1) bằng các đẳng quá trình.
3. Kiến thức mở rộng
- Từ công thức trên, ta có thể tính:
+ Nhiệt độ tuyệt đối của lượng khí ở trạng thái 1 là :
+ Áp suất của lượng khí ở trạng thái 1 là :
+ Thể tích của lượng khí ở trạng thái 1 là :
+ Nhiệt độ tuyệt đối của lượng khí ở trạng thái 2 là :
+ Áp suất của lượng khí ở trạng thái 2 là :
+ Thể tích của lượng khí ở trạng thái 2 là :
- Đổi đơn vị nhiệt độ:
K = 0C + 273
⁰F = 1,8 . ⁰C + 32
- Công thức khối lượng riêng:
Trong đó: D là khối lượng riêng (kg/m3)
m là khối lượng (kg)
V là thể tích (m3)
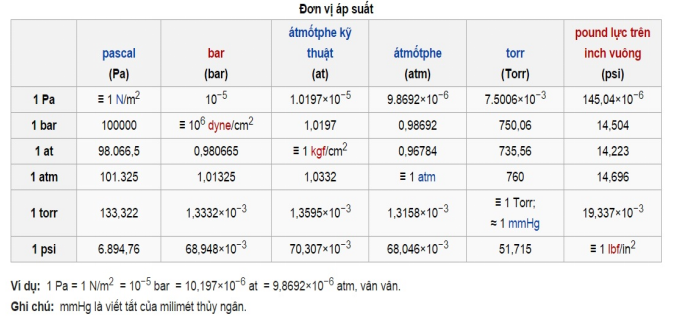
- Bảng chuyển đổi đơn vị áp suất:
- Ở điều kiện tiêu chuẩn, trạng thái của một lượng khí:
+ Áp suất: 1 atm
+ Nhiệt độ: 00C
+ Thể tích: 22,4 lít
Chú ý: Do sự khác biệt giữa khí thực và khí lí tưởng không lớn ở những nhiệt độ và áp suất thông thường. Nên trong đời sống và kĩ thuật, khi không yêu cầu độ chính xác cao, ta có thể áp dụng các định luật về chất khí lí tưởng để tính áp suất, thể tích và nhiệt độ của khí thực.
II. Bài tập vận dụng
Bài 1:Tính khối lượng riêng của không khí ở nhiệt độ 80°C và có áp suất 2,5.105Pa. Biết khối lượng riêng của không khí ở 0°C là l,29kg/m3, và áp suất l,01.105Pa.
Lời giải
Gọi D1, T1, p1 là khối lượng riêng, nhiệt độ, áp suất của không khí ở nhiệt độ 0°C
D2, T2, p2 là khối lượng riêng, nhiệt độ, áp suất của không khí ở nhiệt độ 80°C
Ta có phương trình Cla-pe-ron:
Ta có công thức tính khối lượng riêng:
Từ (1) và (2), ta được:
Bài 2:Một thùng có thể tích 40dm3 chứa 3,96 kg khí cacbonic, biết rằng bình sẽ bị nổ khi áp suất vượt quá 60 atm. Khối lượng riêng của chất khí ở điều kiện tiêu chuẩn là 1,98 kg/m3. Hỏi ở nhiệt độ nào thì bình bị nổ?
Lời giải
Trạng thái 1 là trạng thái khí ở điều kiện tiêu chuẩn:
Trạng thái 2 là trạng thái khí ở điều kiện có thể nổ:
Áp dụng phương trình Cla-pe-ron:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- Phương trình hóa học | Tổng hợp PTHH của các chất hữu cơ, vô cơ chính xác nhất
- Đồng phân & Công thức cấu tạo của các chất hữu cơ
- Nhận biết các chất Hóa học
- Cấu hình electron
- So sánh bán kính nguyên tử và bán kính ion
- 1000 câu hỏi ôn tập môn Hóa có đáp án
- Wiki các chất hóa học | Định nghĩa, tính chất, nhận biết, điều chế, ứng dụng
- Cách đọc danh pháp hóa học (chương trình mới) đầy đủ nhất
- Công thức Lewis của một số chất thường gặp (chương trình mới)
- Công thức electron của một số chất thường gặp (chương trình mới)
- Công thức cấu tạo của một số chất thường gặp (chương trình mới)
- Công thức hợp chất khí với hidro của các nguyên tố (phổ biến) | Cách viết công thức hợp chất khí với hidro
- Công thức hidroxit cao nhất của các nguyên tố (phổ biến) | Cách viết công thức hidroxit cao nhất
- Công thức oxit cao nhất của các nguyên tố (phổ biến) | Cách viết công thức oxit cao nhất
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
