Cu + Cl2 → CuCl2 | Cu ra CuCl2
Tổng hợp Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Phản ứng Cu + Cl2 → CuCl2. Bên cạnh đó là một số bài tập có liên quan về Cu có lời giải, mời các bạn đón xem
Phản ứng Cu + Cl2 → CuCl2

1. Phương trình hoá học của phản ứng Cu tác dụng với Cl2
Cu + Cl2 →t° CuCl2
Cách lập phương trình hoá học theo phương pháp thăng bằng electron:
Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hoá, từ đó xác định chất oxi hoá – chất khử:
Chất khử: Cu; chất oxi hoá: Cl2.
Bước 2: Biểu diễn quá trình oxi hoá, quá trình khử
- Quá trình oxi hoá:
- Quá trình khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hoá
Bước 4: Điền hệ số của các chất có mặt trong phương trình hoá học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
Cu + Cl2 CuCl2
2. Điều kiện để Cu tác dụng với Cl2
Phản ứng giữa nhôm và Cl2 diễn ra ở điều kiện đun nóng.
3. Cách tiến hành thí nghiệm
Đốt cháy dây Cu trong không khí rồi vào trong lọ chứa khí clo.
4. Hiện tượng phản ứng
Dây Cu khi đốt chuyển thành màu đen, khi cho vào bình khí clo chuyển sang màu trắng là CuCl2.
Đồng là kim loại kém hoạt động, có tính khử yếu.
5.1. Tác dụng với phi kim
- Ở nhiệt độ thường, đồng có thể tác dụng với clo, brom nhưng tác dụng rất yếu với oxi. Ví dụ:
Cu + Cl2 → CuCl2
- Khi đun nóng, đồng tác dụng được với một số phi kim như oxi, lưu huỳnh. Ví dụ:
2Cu + O2 2CuO
- Chú ý: đồng không tác dụng được với hiđro, nitơ, cacbon.
5.2. Tác dụng với axit
- Đồng không khử được nước và ion H+ trong các dung dịch HCl và H2SO4 loãng.
- Với các dung dịch H2SO4 đặc, nóng và HNO3, đồng khử xuống và xuống hoặc :
Cu + 2H2SO4đặc CuSO4 + SO2 + 2H2O
Cu + 4HNO3 đặc → Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3 loãng → 3Cu(NO3)2 + 2NO + 4H2O
6. Tính chất hoá học của clo (Cl2)
- Nguyên tử clo có độ âm điện lớn (3,16) chỉ sau F (3,98) và O (3,44). Vì vậy trong các hợp chất với các nguyên tố này clo có số oxi hóa dương (+1; +3; +5; +7), còn trong các trường hợp khác clo có số oxi hóa âm (-1).
- Khi tham gia phản ứng hóa học clo dễ dàng nhận thêm 1 electron:
Cl + 1e → Cl-
⇒ Tính chất hóa học cơ bản của clo là tính oxi hóa mạnh.
6.1. Tác dụng với kim loại
- Khí clo oxi hóa trực tiếp được hầu hết các kim loại tạo thành muối clorua. Phản ứng xảy ra ở nhiệt độ thường hoặc không cao lắm, phản ứng xảy ra nhanh, tỏa nhiều nhiệt.
- Ví dụ:
2Na + Cl2 2NaCl
2Fe + 3Cl2 2FeCl3
Cu + Cl2 CuCl2
- Trong phản ứng với kim loại clo thể hiện tính oxi hóa.
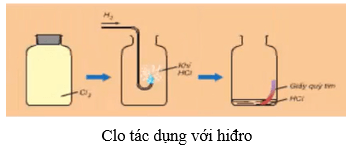
6.2. Tác dụng với hiđro
- Ở nhiệt độ thường và trong bóng tối, khí clo hầu như không phản ứng với khí hiđro.
- Khi chiếu sáng hỗn hợp bởi ánh sáng mặt trời hoặc ánh sáng của magie cháy, phản ứng xảy ra và có thể nổ. Hỗn hợp nổ mạnh nhất khi tỉ lệ số mol giữa hiđro và clo là 1 : 1.
- Phương trình hóa học:
H2 + Cl2 2HCl
- Trong phản ứng với H2, clo thể hiện tính oxi hóa.
6.3. Tác dụng với nước
- Khi tan trong nước, một phần khí clo tác dụng với nước tạo ra hỗn hợp axit clohiđric và axit hipoclozơ.
- Phương trình hóa học:
Trong phản ứng trên clo vừa là chất oxi hóa vừa là chất khử.
- Phản ứng trên là phản ứng thuận nghịch do HClO là chất oxi hóa mạnh, có thể oxi hóa HCl thành Cl2 và H2O. Cũng do HClO có tính oxi hóa mạnh nên nước clo có tính tẩy màu.
- Chú ý: Thành phần của nước clo gồm: Cl2; HCl; HClO; H2O
Mở rộng:
Ngoài ra, clo có thể tham gia một số phản ứng hóa học khác như:
- Tác dụng với dung dịch bazơ:
Cl2 + 2NaOH → NaCl + NaClO + H2O
3Cl2 + 6KOH KClO3 + 5KCl + 3H2O
- Tác dụng với muối của các halogen khác
Cl2 + 2NaBr → 2NaCl + Br2
Cl2 + 2FeCl2 → 2FeCl3
- Tác dụng với chất khử khác
3Cl2 + 2NH3 → N2 + 6HCl
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
7. Bài tập vận dụng liên quan
Câu 1: Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sufuric loãng đun nóng là vì
A.phản ứng tạo ra kết tủa màu vàng và dung dịch có màu xanh.
B. phản ứng tạo ra dung dịch có màu xanh và khí không mùi làm xanh giấy quỳ ẩm.
C. phản ứng tạo ra kết tủa màu xanh.
D. phản ứng tạo dung dịch có màu xanh và khí không màu hóa nâu trong không khí.
Hướng dẫn giải
Đáp án D
Xảy ra phản ứng:
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO + 4H2O
Dung dịch Cu2+ có màu xanh; khí NO không màu nhưng hóa nâu trong không khí.
Câu 2: Cho Cu (Z = 29), vị trí của Cu trong bảng tuần hoàn là
A. ô 29, chu kỳ 4, nhóm IB. B. ô 29, chu kỳ 4, nhóm IA.
C. ô 29, chu kỳ 4, nhóm VIIIB. D. ô 29, chu kỳ 4, nhóm IIB.
Hướng dẫn giải
Đáp án A
Cấu hình electron của Cu là 1s22s22p63s23p63d104s1
Vậy Cu ở ô 29 (Z = 29), chu kỳ 4 (do có 4 lớp electron), nhóm IB (1 electron hóa trị, nguyên tố d).
Câu 3: Trong các hợp chất, đồng có số oxi hóa phổ biến là
A. +1. B. +2. C. -2. D. +1 và +2.
Hướng dẫn giải
Đáp án D
Trong các hợp chất, đồng có số oxi hóa phổ biến là +1 và +2.
Câu 4: Hợp kim Cu – Zn (45% Zn) được gọi là
A. đồng thau. B. đồng thanh. C. đồng bạch. D. đuy ra.
Hướng dẫn giải
Đáp án A
Đồng thau là hợp kim Cu – Zn (45% Zn).
Câu 5: Cho 3,2 gam Cu tác dụng với 100ml dung dịch hỗn hợp (HNO3 0,8M + H2SO4 0,2M), sản phẩm khử duy nhất của HNO3 là NO. Thể tích khí NO (đktc) là
A. 0,672 lít. B. 0,336 lít.
C. 0,747 lít. D. 1,792 lít.
Hướng dẫn giải
Đáp án A
nCu = 3,2 : 64 = 0,05 mol
= 0,8.0,1 + 2.0,2.0,1 = 0,12 mol
= 0,8.0,1 = 0,08 mol
3Cu+ 8H++ 2NO3- → 3Cu2+ + 2NO + 4H2O
→ Sau phản ứng H+ hết đầu tiên
→ nNO === 0,03 mol
→ VNO = 0,03.22,4 = 0,672 lít.
Câu 6: Đồng thuộc ô 29 trong bảng tuần hoàn, vậy cấu hình electron của Cu+ và Cu2+ lần lượt là
A. [Ar]3d10; [Ar]3d9. B. [Ar]3d94s1; [Ar]3d84s1.
C. [Ar]3d94s1; [Ar]3d9. D. [Ar]3d84s2; [Ar]3d84s1.
Hướng dẫn giải
Đáp án A
Đồng có cấu hình electron là [Ar]3d104s1
→ Cấu hình electron của Cu+ và Cu2+ lần lượt là:[Ar]3d10; [Ar]3d9.
Câu 7: Tổng hệ số là các số nguyên, tối giản của tất cả các chất trong phương trình phản ứng giữa Cu với dung dịch HNO3 đặc, nóng là
A. 8. B. 10. C. 11. D. 9.
Hướng dẫn giải
Đáp án B
Cu + 4HNO3 Cu(NO3)2 + 2NO2 + 2H2O
Tổng hệ số = 1 + 4 + 1 + 2 + 2 = 10.
Câu 8: Nhận định nào sau đây là sai?
A. Đồng dẻo, dễ kéo sợi .
B. Đồng là kim loại có màu đen.
C. Đồng có thể dát mỏng hơn giấy viết từ 5 đến 6 lần.
D. Đồng dẫn nhiệt, điện tốt.
Hướng dẫn giải
Đáp án B
Đồng là kim loại có màu đỏ.
Câu 9: Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học),
thấy thoát ra khí không màu hóa nâu trong không khí. Mặt khác, khi X tác dụng với dung dịch NaOH thì có khí mùi khai thoát ra. Chất X là
A. amophot. B. ure.
C. natri nitrat. D. amoni nitrat.
Hướng dẫn giải
Đáp án D
Amoni nitrat NH4NO3
3Cu + 8H+ + 2NO3- → 3Cu2+ + 2NO↑ + 4H2O
NH4+ + OH- → NH3↑ + H2O
Câu 10: Nhúng một thanh Cu vào dung dịch AgNO3, sau một thời gian lấy ra, rửa sạch, sấy khô, đem cân thì khối lượng thanh đồng thay đổi thế nào ?
A. Tăng. B. Giảm.
C. Không thay đổi. D. không xác định được.
Hướng dẫn giải
Đáp án A
Giả sử có 1 mol Cu tham gia phản ứng
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
nAg = 2nCu = 2 mol
→ Khối lượng thanh đồng tăng = 2.108 - 64 = 152 gam.
Xem thêm các phương trình hóa học hay khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)