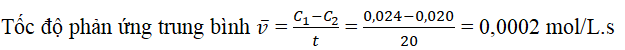Chất xúc tác là gì?
Tổng hợp Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Chất xúc tác giúp bạn nắm vững kiến thức và học tốt Hóa học.
Chất xúc tác
1. Định nghĩa
Chất xúc tác là một hay nhiều chất phản ứng tham gia vào quá trình xúc tác làm thay đổi tốc độ của một phản ứng hoá học. Chất xúc tác khác biệt với các chất khác trong phản ứng hoá học, các chất này không bị mất đi trong quá trình phản ứng.
2. Phân loại
Về chất xúc tác đồng thể, phản ứng trong chứa chất xúc tác đồng thể và chất phản ứng ở cùng một pha mà không tồn tại ranh giới, và chất xúc tác có thể đóng vai trò xúc tác đồng thể là chất xúc tác đồng thể. Chất xúc tác đồng thể bao gồm axit lỏng, chất xúc tác bazơ và axit rắn Color Base và chất xúc tác bazo, các hợp chất kim loại chuyển tiếp hoà tan (muối và phức chất) và các loại tương tự. Chất xúc tác đồng thể hoạt động độc lập với các phân tử hoặc ion, có các tâm hoạt động đồng nhất, có hoạt tính và độ chọn lọc cao. Quá trình xúc tác đồng thể là phản ứng có xúc tác, trong đó chất xúc tác và chất phản ứng hợp thành một pha (khí và lỏng).
Về chất xúc tác dị thể, còn được gọi là chất xúc tác dị thể, được sử dụng trong các phản ứng của các giai đoạn khác nhau, tức là ở các trạng thái khác với chất phản ứng mà chúng xúc tác. Một phản ứng xúc tác dị thể đơn giản liên quan đến sự hấp thụ của chất phản ứng trên bề mặt của chất xúc tác. Các liên kết trong chất phản ứng bị phá vỡ và các liên kết mới được tạo ra, nhưng do liên kết giữa sản phẩm và chất xúc tác không mạnh, sản phẩm được giải phóng khỏi vị trí phản ứng và các quá trình khác. Nhiều cấu trúc khá nhau của sự hấp thụ và phản ứng trên bề mặt của chất xúc tác đã được biết đến. Quá trình phản ứng xúc tác dị thể là phản ứng chất xúc tác và chất phản ứng thuộc các pha khác nhau.
Về chất xúc tác sinh học, Enzyme là chất xúc tác sinh học, là những chất hữu cơ có khả năng xúc tác do thực vật, động vật và vi sinh vật tạo ra (hầu hết các protein, nhưng một lượng nhỏ RNA cũng có chức năng xúc tác sinh học). Sự xúc tác của các enzym cũng có tính chọn lọc như enzyme xúc tác trong quá trình thuỷ phân tinh bột thành dextrin và maltose, và protease xúc tác quá trình thuỷ phân protein thành peptit...Các sinh vật sống sử dụng chúng để tăng tốc quá trình phản ứng hoá học trong cơ thể.
3. Tính chất
- Chất xúc tác có đặc điểm làm giảm năng lượng hoạt hoá của phản ứng (Năng lượng hoạt hoá của chất là năng lượng tối thiểu cần cung cấp cho các tiểu phân để chúng trở thành hoạt động, có khả năng phản ứng).
- Chất xúc tác có tính chọn lọc (mỗi chất xúc tác thường chỉ có tác dụng với phản ứng, đôi khi có tác dụng cho nhóm phản ứng xác định).
- Chất xúc tác không gây nên chuyển dịch cân bằng, mà chỉ làm cho phản ứng nhanh chóng đạt đến trong thái cân bằng.
- Trong các phản ứng xúc tác đồng thể, tác dụng của chất xúc tác tỷ lệ với lượng xúc tác.
- Chất xúc tác có thể làm giảm hoạt tính, thậm chí mất hẳn hoạt tính khi gặp một số chất nào đó, những chất này được gọi là chất độc xúc tác; ngược lại, chất xúc tác cũng có thể tăng mạnh hoạt tính, tăng độ bền khi gặp một số chất, những chất này được gọi là chất kích thích xúc tác
4. Bài tập vận dụng
Bài 1: Cho phản ứng: A+ 2B → C
Nồng độ ban đầu các chất: [A] = 0,3M; [B] = 0,5M. Hằng số tốc độ k = 0,4
a) Tính tốc độ phản ứng lúc ban đầu.
b) Tĩnh tốc độ phản ứng tại thời điểm t khi nồng độ A giảm 0,1 mol/l.
Giải
a) Tốc độ ban đầu:
Vban đầu = k.[A].[B]2= 0,4.[0,3].[0,5] 2 =0,3 mol/ls
b) Tốc độ tại thời điểm t
Khi nồng độ A giảm 0,1 mol/lít thì B giảm 0,2 mol/l theo phản ứng tỉ lệ 1 : 2
Nồng độ tại thời điểm t:
[A’] = 0,3 – 0,1 =0,2 (mol/l)
[B’]=0,5 -0,2 =0,3 (mol/l)
V= k.[A’].[B’] 2= 0,4.[0,2].[0,3] 2=0,0072 mol/ls
Bài 2: Cho phản ứng A + 2B → C
Cho biết nồng độ ban đầu của A là 0,8M, của B là 0,9M và hằng số tốc độ k = 0,3. Hãy tính tốc độ phản ứng khi nồng độ chất A giảm 0,2M.
Giải
Ta có [A] giảm 0,2M thì theo phương trình:
A + 2B → C
0,2 → 0,4 → 0,2
⇒ [B] giảm 0,4
Nồng độ còn lại của các chất: [A] = 0,8 – 0,2 = 0,6M
[B] = 0,9 – 0,4 = 0,5M
Tốc độ phản ứng: v = k.[A].[B]2 = 0,3 x 0,6 x (0,5)2 = 0,045
Bài 3: Cho phản ứng hóa học có dạng: A + B → C.
Tốc độ phản ứng thay đổi như thế nào khi:
a. Nồng độ A tăng 2 lần, giữ nguyên nồng độ B.
b. Nồng độ B tăng 2 lần, giữ nguyên nồng độ A.
c. Nồng độ của cả hai chất đều tăng lên 2 lần.
d. Nồng độ của chất này tăng lên 2 lần, nồng độ của chất kia giảm đi 2 lần.
e. Tăng áp suất lên 2 lần đối với hỗn hợp phản ứng, coi đây là phản ứng của các chất khí
Giải
Ta có: v = k.[A].[B]
a, Khi [A] tăng 2 lần thì : va = k.[2A].[B] = 2k.[A].[B] = 2v
Vậy tốc độ phản ứng tăng lên 2 lần.
b, Khi [B] tăng lên 2 lần thì : vb = k.[2B].[A] = 2k.[A].[B] = 2v
Vậy tốc độ phản ứng tăng lên 2 lần.
c, Khi [A] và [B] đều tăng 2 lần: vc = k.[2A].[2B] = 4k.[A].[B] = av
Vậy tốc độ phản ứng tăng lên 4 lần.
d, Nồng độ của chất này tằng 2 lần, nồng độ của chất kia giảm 2 lần, do đó tốc độ phản ứng không thay đổi.
e, Khi tăng áp suất 2 lần (tương ứng với việc giảm thể tích 2 lần) nghĩa là tăng nồng độ của mỗi phản ứng lên 2 lần, do đó tốc độ phản ứng tăng lên 4 lần
Bài 4: Khi bắt đầu phản ứng, nồng độ của một chất là 0,024 mol/l. Sau 10s xảy ra phản ứng nồng độ của chất đó là 0,022 mol/lít. Hãy tính tốc độ phản ứng trong thời gian đó
Giải
Tốc độ phản ứng: v = (0,024-0,022)/10 = 0,0002 (mol/lít.s)
Bài 5: Cho chất xúc tác Mn2 vào 100 ml dung dịch H2O2, sau 60 giây thu được 3,36 ml khí O2 (ở đktc). Tính tốc độ trung bình của phản ứng (tính theo H2O2) trong 60 giây.
Giải
Bài 6: Khi bắt đầu phản ứng, nồng độ của một chất là 0,024 mol. Sau 20 giây phản ứng, nồng độ của chất đó là 0,020 mol. Hãy tính tốc độ trung bình của phản ứng này trong thời gian đã cho.
Giải
Bài 7: Xét phản ứng phân hủy N2O5 trong dung môi CCl4 ở 450oC:
Ban đầu nồng độ của N2O5 là 2,33M, sau 184 giây nồng độ của N2O5 là 2,08M. Tốc độ trung bình của phản ứng tính theo N2O5 là
Bài 8: Xét phản ứng: 2KI + H2O2 ⇌ 2KOH + I2
Nồng độ ban đầu của KI là 1,0 mol/1, sau 20 giây nồng độ của nó bằng 0,2 mol/l. Tốc độ trung bình của phản ứng
Bài 9: Nồng độ ban đầu của A là 0,1 mol/1, của B là 0,8 mol/l. Sau 10 phút, nồng độ của B chỉ còn 20% nồng độ ban đầu. Tốc độ trung bình của phản ứng
Bài 10: Nồng độ ban đầu của A là 1M, B là 3M, hằng số tốc độ k = 0,5. Vận tốc của phản ứng khi đã có 20% chất A tham gia phản ứng
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)