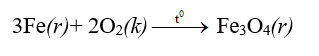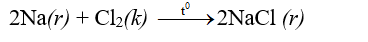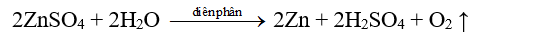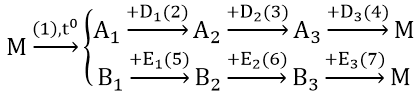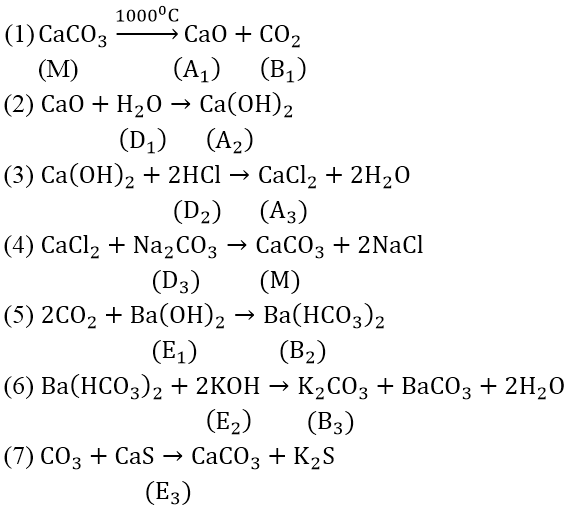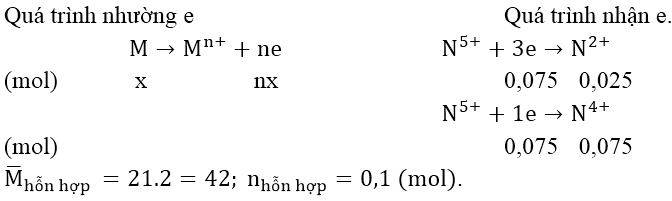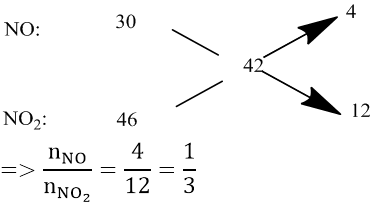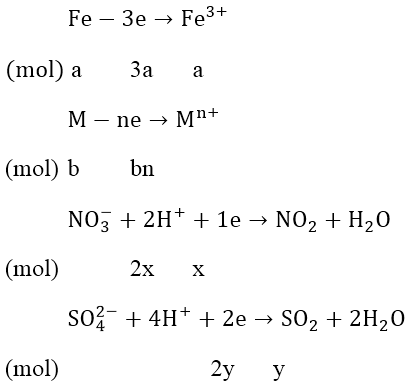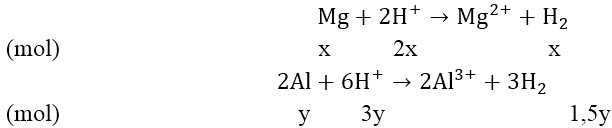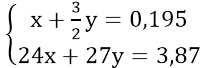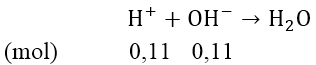Kim loại là gì? Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Kim loại
Tổng hợp Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Kim loại giúp bạn nắm vững kiến thức và học tốt Hóa học.
Kim loại là gì?
1. Định nghĩa về kim loại
Kim loại là tập hợp các nguyên tố có thể tạo ra các ion dương (cation) và có các liên kết kim loại. Cùng với phi kim và á kim, kim loại cũng được phân biệt bởi mức độ ion hóa. Trong bảng tuần hoàn hóa học, kim loại chiếm đến 80%, trong khi đó cả á kim và phi kim chỉ chiếm 20%.
2. Phân loại kim loại.
Kim loại được chia thành 4 loại chính như sau: Kim loại cơ bản, kim loại hiếm, kim loại đen và kim loại màu.
2.1. Kim loại cơ bản
Kim loại cơ bản là những kim loại dễ dàng phản ứng với môi trường bên ngoài (không khí và độ ẩm) tạo nên sự ăn mòn, oxi hóa. Ngoài ra, chúng còn phản ứng với các acid HCl.
Những kim loại cơ bản phổ biến như Sắt (Fe), Đồng (Cu), Chì (Pb), Kẽm (Zn), Niken... Mặc dù đồng (Cu) không có phản ứng hóa học với axit clohidric, nhưng lại dễ bị oxi hóa nên nó cũng cho xếp vào nhóm kim loại cơ bản.
2.2 Kim loại hiếm
So với kim loại cơ bản thì kim loại hiếm ít bị ăn mòn bởi oxi và axit hơn. Vì vậy, chúng bền hơn trong môi trường bên ngoài. Đồng thời giá trị của chúng cũng cao hơn nhiều so với các kim loại khác.
Các kim loại hiếm gồm Vàng, Bạc, Bạch kim,...
2.3. Kim loại đen
Là kim loại có màu đen rất phổ biến nguồn gốc từ 200 triệu năm trước. Chúng được tạo thành từ 2 nguyên tố chủ yếu là sắt và carbon. Kim loại này là một trong những loại có thể tái chế nhiều lần.
Kim loại đen bao gồm thép, gang, Inox,..
2.4. Kim loại màu
Kim loại màu được sản xuất từ các quặng màu thứ sinh hoặc nguyên sinh và có màu đặc trưng riêng. Kim loại màu chống ăn mòn tốt hơn kim loại đen, dẫn nhiệt và dẫn điện khá tốt. Do có đặc tính là nhiệt độ nóng chảy thấp hơn nên khả năng đúc dễ dàng hơn so với kim loại đen.
Ngoài ra, người ta còn phân loại thành kim loại nặng và kim loại nhẹ:
- Kim loại nặng: Là những kim loại có khối lượng riêng trên 3,5g/cm3. Chúng có số nguyên tử cao và thường thể hiện tính kim loại tại nhiệt độ thường. Kim loại nặng không thể phân hủy trong tự nhiên. Đặc biệt, chúng là vi lượng thiết yếu cho cây trồng và gia súc.
- Kim loại nhẹ: Là kim loại có khối lượng riêng tương đối thấp, thường khối lượng riêng nhỏ hơn 3,5g/cm3. Kim loại nhẹ được phân bố ở nửa trên bảng tuần hoàn hóa học
3. Tính chất kim loại
3.1 Tính chất vật lí
- Tính dẻo
- Kim loại có tính dẻo.
- Các kim loại khác nhau có tính dẻo khác nhau. Do có tính dẻo nên kim loại được rèn, kéo sợi, dát mỏng tạo nên các đồ vật khác nhau.
- Tính dẫn điện
- Kim loại có tính dẫn điện.
- Các kim loại khác nhau có khả năng dẫn điện khác nhau. Kim loại có khả năng dẫn điện tốt nhất là Ag, sau đó đến Cu, Al, Fe,...Do có tính dẫn điện, một số kim loại được sử dụng làm dây dẫn điện. Thí dụ như: đồng, nhôm, ...
- Chú ý: Không nên sử dụng dây dẫn điện trần hoặc dây điện đã bị hỏng lớp bọc cách điện để tránh bị điện giật, hay cháy do chập điện,...
- Tính dẫn nhiệt
- Kim loại có tính dẫn nhiệt .
- Kim loại khác nhau có tính dẫn nhiệt khác nhau. Kim loại nào dẫn điện tốt cũng thường dẫn nhiệt tốt.
- Dó có tính dẫn nhiệt và một số tính chất khác, nhôm, thép không gỉ (inox) được dùng để làm dụng cụ nấu ăn.
- Ánh kim
- Kim loại có ánh kim.Nhờ tính chất này, một số kim loại được dùng làm đồ trang sức và các vật dụng trang trí khác.
3.2 Tính chất hóa học
a) Phản ứng của kim loại với phi kim
- Tác dụng với oxi
- Khi đốt nóng đỏ, sắt cháy trong oxi tạo thành oxit sắt từ
- Nhiều phi kim khác như Al, Zn, Cu... phản ứng với oxi tạo thành các oxit Al2O3, ZnO, CuO...
- Tác dụng với phi kim khác
- Natri nóng chảy cháy trong khí clo tạo thành khói trắng.
- Ở nhiệt độ cao, đồng, magie, sắt... phản ứng với lưu huỳnh cho sản phẩm là các muối sunfua CuS, MgS, FeS,...
- Hầu hết kim loại (trừ Ag, Au, Pt...) phản ứng với oxi ở nhiệt độ thường hoặc nhiệt độ cao, tạo thành oxit (thường là oxit bazơ). Ở nhiệt độ cao kim loại phản ứng với nhiều phi kim khác tạo thành muối.
- Phản ứng của kim loại với dung dịch axit
- Một số kim loại phản ứng với dung dịch axit (H2SO4 loãng, HCl...) tạo thành muối và giải phóng khí hiđro.
Zn(r)+H2SO4(dd)→ZnSO4 (dd)+ H2(k)
- Phản ứng của kim loại với dung dịch muối
- Phản ứng của đồng với dung dịch bạc nitrat
Cu (r)+ 2AgNO3 (dd)→ Cu(NO3)2 (dd) + 2Ag (r)
Đồng đã đẩy bạc ra khỏi muối. Ta nói đồng hoạt động hóa học mạnh hơn bạc.
- Phản ứng của kẽm với dung dịch đồng (II) sunfat
Kẽm đẩy đồng ra khỏi dung dịch CuSO4.
Zn (r) + CuSO4 (dd) → ZnSO4 (dd) + Cu (r)
Ta nói kẽm hoạt động hóa học mạnh hơn đồng.
- Phản ứng của kim loại Mg, Al, Zn, ... với dung dịch CuSO4 hay AgNO3 tạo thành muối magie, muối nhôm, muối kẽm, ... và kim loại Cu và Ag được giải phóng.
Ta nói: Al, Zn, Mg hoạt động hóa học mạnh hơn Cu, Ag.
=>Kim loại hoạt động hóa học mạnh hơn (trừ Na, K, Ca ...) có thể đẩy kim loại hoạt động hóa học yếu hơn ra khỏi dung dịch muối, tạo thành muối mới và kim loại mới.
4. Nhận biết kim loại
Dựa vào tính chất hoá học và các dấu hiệu nhận biết các chất (kết tủa, khí, đổi màu dung dịch…) đã được học để tiến hành nhận biết.
- Bước 1: Trích mẫu thử (có thể đánh số các ống nghiệm để tiện theo dõi).
- Bước 2: Chọn thuốc thử để nhận biết (tuỳ theo yêu cầu của đề bài: thuốc thử tuỳ chọn, hạn chế hay không dùng thuốc thử nào khác).
- Bước 3: Cho thuốc thử vào mẫu, trình bày hiện tượng quan sát, rút ra kết luận đã nhận ra hoá chất nào.
- Bước 4: Viết phương trình phản ứng minh hoạ.
Chú ý: Để giải dạng bài tập này ta cần:
+ Dựa vào màu sắc của các dung dịch.
+ Các phản ứng hóa học đặc trưng của các hóa chất cần nhận biết.
+ Lập bảng để nhận biết.
5. Điều chế
Nguyên tắc điều chế kim loại:Trong tự nhiên chỉ có một số ít kim loại ở trạng thái tự do, hầu hết các kim loại đều tồn tại dưới dạng ion trong các hợp chất hóa họ. Muốn chuyển hóa những ion này thành kim loại ta thực hiện quá trình khử ion kim loại:
Mn+ + ne → M
- Có 3 phương pháp điều chế kim loại.
5.1 Phương pháp thủy luyện
- Phương pháp thủy luyện (còn gọi là phương pháp ướt) được dùng điều chế những kim loại có tính khử yếu, như Cu, Hg, Ag, Au,...
5.2 Phương pháp nhiệt luyện
- Phương pháp nhiệt luyện được ứng dụng rộng rãi trong công nghiệp dùng để điều chế những kim loại có độ hoạt động hóa học trung bình như Zn, Fe, Sn, Pb,...
- Với những kim loại kém hoạt động như Hg, Ag chỉ cần đốt cháy quặng cũng đã thu được kim loại mà không cần thiết phải khử bằng các tác nhân khác:
5.3 Phương pháp điện phân
- Điều chế kim loại có tính khử mạnh như Li, Na, K, Al, ... bằng cách điện phân các hợp chất ( muối, bazơ, oxit) nóng chảy của chúng.
- Thí dụ: Điều chế kim loại kẽm bằng phương pháp điện phân dung dịch kẽm sunfat với điện cực trơ.
Phương trình điện phân:
6. Ứng dụng của kim loại
Kim loại phổ biến như vậy nên hầu hết các ngành nghề khác nhau đều sử dụng loại vật liệu này.
6.1. Trong xây dựng
Kim loại đen, kim loại cơ bản thường được dùng cho các công trình xây dựng như nhà ở. tòa nhà cao tầng, cầu đường và hầu hết các kiến trúc khác.
6.2. Trong gia dụng
Kim loại được sử dụng để tạo ra các sản phẩm phục vụ đời sống như bàn ghế, dụng cụ bếp, cầu thang,...
6.3 Trong sản xuất
Trong nhiều ngành nghề khác nhau có thể dùng kim loại để sản xuất ra các máy móc, thiết bị. Chúng thường tạo ra nhiều chi tiết, phụ kiện, chế tạo phôi, khuôn đúc,...
6.4. Trong giao thông vận tải
Kim loại được ứng dụng làm vỏ các loại phương tiện, chi tiết máy móc, phụ kiện, khớp nối,... Trong các phương tiện đi lại hàng ngày đều có sử dụng kim loại như xe đạp, xe máy, ô tô, tàu thủy, máy bay,...
6.5. Trong hóa học
Ngoài các ứng dụng phổ biến trên, kim loại còn được dùng để nghiên cứu, phân tích các phản ứng hóa học. Từ đó, các nhà khoa học phát triển thêm nhiều vật liệu hữu ích khác trên các nền tảng là các nguyên tố kim loại cơ bản nhằm phục vụ cho cuộc sống hiện đại.

7. Bài tập liên quan đến kim loại
Bài 1: Hãy sắp xếp các cặp oxi hóa khử sau đây theo thứ tự tăng dần tính oxi hóa của các ion kim loại:
(1): Fe2+/Fe (2): Pb2+/Pb (3): 2H+/H2 (4): Ag+/Ag
(5): Na+/Na (6): Fe3+/Fe2+ (7): Cu2+/Cu
A. (5) < (1) < (2) < (3) < (7) < (6) < (4)
B. (4) < (6) < (7) < (3) < (2) < (1) < (5)
C. (5) < (1) < (6) < (2) < (3) < (4) < (7)
D. (5) < (1) < (2) < (6) < (3) < (7) < (4)
Hướng dẫn:
Đáp án D
Bài 2: Ion M2+, X- đều có cấu hình electron ở lớp ngoài cùng là 3s23p6. Hãy cho biết phân tử được tạo bởi M2+ và X-?
Hướng dẫn
+ M → M2+ + 2e ⇒ M có cấu hình electron là:
1s22s22p63s23p64s2 (ZM = 20 ⇒ Ca)
+ X + 1e → X- ⇒ X có cấu hình electron là:
1s22s22p63s23p5 (ZX = 17) ⇒ X là Cl ⇒ phân tử CaCl2.
Bài 3: Nguyên tố Cu có số hiệu nguyên tử là 29, lớp electron ngoài cùng có 1e. hãy cho biết:
a) Cấu hình electron của nguyên tử Cu và của các ion Cu+, Cu2+.
b) Vị trí của Cu trong bảng tuần hoàn.
Hướng dẫn:
a) Cấu hình electron của nguyên tử Cu và của các ion Cu+, Cu2+
Cu: 1s22s22p63s23p63d104s1
Cu+: 1s22s22p63s23p63d10
Cu2+: 1s22s22p63s23p63d9
b) Vị trí Cu: nằm ở ô số 29, chu kì 4 nhóm IB.
Bài 4: Hoàn thành phương trình phản ứng theo sơ đồ sau:
Cho biết: A1 là oxit kim loại A có điện tích hạt nhân là : 3,2.10-18 Culong; B1 là oxit phi kim B có cấu hình electron ở lớp vỏ ngoài cùng là 2s22p2
Hướng dẫn:
Số điện tích hạt nhân của A = (3,2.10-18)/(1,6.10-19) = 20(Ca)
Vậy A1 là CaO.
B ở chu kì 2, nhóm IV A ⇒ (B là cacbon). Vậy B1 là CO2
Các phản ứng:
Bài 5: Biết phản ứng oxi hóa khử xảy ra trong một pin điện hóa là:
Fe + Ni2+ → Fe2+ + Ni
a. Hãy xác định các điện cực âm và dương của pin điện hóa.
b. Viết các phản ứng oxi hóa và phản ứng khử xảy ra trên mỗi điện cực.
c. Tính suất điện động chuẩn pin điện hóa.
Hướng dẫn:
a. Ni (+); Fe (-)
b. Phản ứng trên các điện cực:
Cực (-): Fe → Fe2+ + 2e
Cực (+): Ni2+ + 2e → Ni
c. E0pin = -0,23 - (-0,44) = 0,21 V
Bài 6: Hòa tan 1,35 gam một kim loại M bằng dung dịch HNO3 loãng dư thu được 2,24 lít hỗn hợp khí NO và NO2 (đktc) có tỉ khối hơi so với hidro bằng 21. Tìm M.
Hướng dẫn:
Áp dụng phương pháp bảo toàn electron
Áp dụng phương pháp sơ đồ chéo :
⇒ nNO = 0,025(mol) và nNO2 = 0,075 (mol)
Áp dụng định luật bảo toàn số mol electron, ta có:
nX = 0,075 + 0,075 = 0,15 và MX = 1,35 ⇒ M = 9n
+) Khi n = 1 ⇒ M = 9 (loại)
+) Khi n = 2 ⇒ M = 18 (loại)
+) Khi n = 3 ⇒ M = 27 (kim loại là Al)
Bài 7:
a) Hòa tan m gam hỗn hợp A gồm Fe và kim loại M (M có hóa trị không đổi) trong dung dịch HCl dư thì thu được 1,008 lít khí (đktc) và dung dịch chứa 4,575 gam muối khan. Tính m.
b) Hòa tan hết cùng lượng hỗn hợp A (ở phần 1) trong dung dịch chứa hỗn hợp HNO3 và H2SO4 ở nhiệt độ thích hợp thì thu được 1,8816 lít hỗn hợp 2 khí (đktc) có tỉ khối so với H2 là 25,25. Xác định tên kim loại M.
Hướng dẫn:
mmuối = mFeCl2 + mMCln
⇔ (56 + 71)a + (M + 35,5)b = 4,575 ⇔ m = 1,38
Áp dụng định luật bảo toàn điện tích:
3a + nb = x + 2y = 0,105
Từ (1) và (2) ⇒ a = 0,015 (mol) và nb = 0,06
Mặt khác: 56a + Mb = 1,38 ⇒ Mb = 0,54
M = 9n ⇒ Nghiệm thích hợp n = 3, M = 27 (Al)
Bài 8: Cho 3,87 gam hỗn hợp A gồm Mg và Al vào 250 ml dung dịch X chứa axit HCl 1M và H2SO4 0,5M được dung dịch B và 4,368 lít H2 (đktc)
a) Tính phần trăm khối lượng kim loại trong A.
b) Tính thể tích dung dịch C gồm NaOH 0,2M và Ba(OH)2 0,1M cần để trung hòa hết lượng axit dư trong B.
Hướng dẫn:
a) Đối với bài tập có hỗn hợp axit, bazo giải theo phương trình ôn
nHCl = 0,25 (mol) ; nH2SO4 = 0,125 (mol); nH2 = 0,195 (mol)
= nH+ = 0,25 + 2.0,125 = 0,5 (mol);
nH2.2 < nH+ ⇒ H+ dư
Theo đề bài, ta có hệ phương trình:
Giải hệ phương trình ta được: x = 0,06 và y = 0,09
⇒ mMg = 1,44 (gam); mAl = 2,43(gam)
b) Gọi thể tích dung dịch C cần dùng là V (lít)
Ta có: nNaOH = 0,02V(mol); nBa(OH)2 = 0,11V (mol)
⇒ n-OH = 0,2 + 0,2 = 0,4V(mol)
nH+dư = 0,5 - (2x + 3y) = 0,11 (mol)
⇒ 0,11 = 0,4V ⇒ V = 0,275 (lít)
Bài 9: Ngâm một cái đinh sắt vào 200 ml dung dịch CuSO4. Sau khi phản ứng kết thúc, lấy đinh ra khỏi dung dịch, rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng thêm 0,8 gam. Tính nồng độ mol của dung dịch CuSO4 ban đầu.
Hướng dẫn:
Áp dụng phương pháp tăng giảm khối lượng
Theo phương trình: Fe + CuSO4 → Cu + FeSO4
Cứ 1 mol Fe (56 gam) tác dụng với 1 mol CuSO4 → 1 mol Cu (64 gam).
Khối lượng đinh sắt tăng: 64 – 56 = 8 (gam)
Thực tế khối lượng đinh sắt tăng 0,8 (gam)
Vậy, nCuSO4 phản ứng = 0,8/8 = 0,1(mol)và CMCuSO4 = 0,1/0,2 = 0,5M
Bài 10 : Cho 0,774 gam hỗn hợp Zn và Cu vào 500 ml dung dịch AgNO3 nồng độ 0,04M. Sau khi các phản ứng xảy ra hoàn toàn được chất rắn X nặng 2,288 gam chất rắn. Hãy xác định thành phần của ?
Hướng dẫn:
Ta có: nAgNO3 = 0,5.0,04 = 0,02(mol)
Thứ tự phản ứng:
Zn + 2AgNO3 → Zn(NO3 )2 + 2Ag (1)
Cu + 2AgNO3 → Cu(NO3 )2 + 2Ag (2)
Nếu Zn, Cu phản ứng hết thì khối lượng kim loại thu được tối đa nặng:
108 . 0,02 = 2,16 (gam) < mX ⇒ kim loại còn dư ⇒ AgNO3 phản ứng hết.
Nếu Cu chưa phản ứng thì phản ứng (1) làm tăng một lượng:
108.0,02 - 65.0,02/2 = 1,51 (gam) tức khối lượng chất rắn lúc đó nặng:
0,774 + 1,51 = 2,284 (gam) < mX ⇒ Cu có phản ứng nhưng còn dư.
Vậy X gồm Ag và Cu.
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)