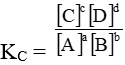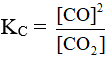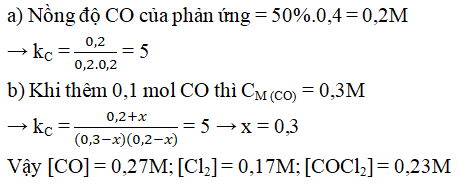Cách xác định hằng số cân bằng hóa học và các yếu tố ảnh hưởng đến cân bằng hóa học
Vietjack.me xin gửi tới bạn đọc tài liệu về cân bằng hóa học bao gồm khái niệm, hằng số cân bằng, các yếu tố ảnh hưởng tới cân bằng hóa học, ... Từ đó, giúp các bạn học sinh nắm vững kiến thức Hóa học. Mời bạn đọc tham khảo:
Cân bằng hóa học
I. Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hóa học
1. Phản ứng một chiều
- Phản ứng một chiều là phản ứng trong đó các sản phẩm phản ứng không tác dụng được với nhau để tạo ra các chất tham gia phản ứng.
Ví dụ:
O2 tạo ra không tác dụng được với KCl để tạo thành KClO3.
2. Phản ứng thuận nghịch
- Phản ứng thuận nghịch là phản ứng trong đó các chất tham gia phản ứng tác dụng với nhau để tạo thành sản phẩm đồng thời các sản phẩm phản ứng được với nhau để tạo ra các chất tham gia phản ứng.
Ví dụ: 3H2 + N2 ⇋ 2NH3
NH3 được tạo thành đồng thời lại bị phân hủy sinh ra H2 và N2 là các chất tham gia phản ứng.
3. Cân bằng hóa học
- Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ của phản ứng nghịch.
II. Hằng số cân bằng
1. Cân bằng trong hệ đồng thể
- Hệ đồng thể là hệ không có bề mặt phân chia trong hệ.
Ví dụ: hệ gồm các chất khí, hệ gồm các chất tan trong dung dịch.
Xét phản ứng thuận nghịch trong hệ đồng thể:
aA + bB ⇋ cC + dD
Trong đó A, B, C, D là những chất khí hay những chất tan trong một dung dịch. Khi phản ứng ở trạng thái cân bằng ta có:
KC là hằng số cân bằng nồng độ của phản ứng chỉ phụ thuộc vào nhiệt độ, không phụ thuộc vào nồng độ các chất ban đầu.
Chú ý: Giá trị của hằng số KC phụ thuộc vào cách viết phương trình phản ứng hóa học.
2. Cân bằng trong hệ dị thể
Hệ dị thể là hệ là hệ có bề mặt phân chia trong hệ, qua bề mặt này có sự thay đổi đột ngột tính chất.
Ví dụ: hệ gồm chất rắn và chất khí, hệ gồm chất rắn và chất tan trong dung dịch.
Xét hệ cân bằng: C + CO2 ⇋ 2CO.
Hằng số cân bằng:
Nồng độ chất rắn coi là hằng số, nên trong biểu thức tính KC không tính chất rắn.
III. Sự chuyển dịch cân bằng hóa học
- Sự chuyển dịch cân bằng hóa học là sự chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác do tác động của các yếu tố từ bên ngoài lên cân bằng.
IV. Các yếu tố ảnh hưởng đến cân bằng hóa học
1. Ảnh hưởng của nồng độ
- Khi tăng hoặc giảm nồng độ của một chất trong cân bằng thì cân bằng chuyển dịch theo chiểu làm giảm tác dụng của việc tăng hoặc giảm nồng độ của chất đó.
Lưu ý: Đối với hệ cân bằng có chất rắn thì việc thêm hay bớt lượng chất rắn không ảnh hưởng đến cân bằng, nghĩa là cân bằng không chuyển dịch.
2. Ảnh hưởng của áp suất
- Khi tăng hoặc giảm áp suất chung của hệ cân bằng thì cân bằng chuyển dịch theo chiều làm giảm tác dụng của việc tăng hoặc giảm áp suất đó.
Lưu ý: Khi hệ cân bằng có số mol khí ở 2 về bằng nhau hoặc trong hệ không có chất khí thì việc tăng, giảm áp suất chung của hệ không làm cho cân bằng chuyển dịch.
3. Ảnh hưởng của nhiệt độ
- Khi tăng nhiệt độ thì cân bằng chuyền dịch theo chiều phản ứng thu nhiệt, nghĩa là làm giảm tác dụng của việc tăng nhiệt độ. Còn khi giảm nhiệt độ thì cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt, nghĩa là làm giảm tác dụng của việc giảm nhiệt độ.
- Nguyên lí chuyển dịch cân bằng (Nguyên lí Lơ Sa-tơ-li-ê): "Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động bên ngoài, như biến đổi nồng độ, áp-suất, nhiệt độ sẽ chuyển dịch cân bằng theo chiều làm giảm tác động bên ngoài đó”.
4. Vai trò của chất xúc tác
- Chất xúc tác không ảnh hưởng đến cân bằng vì không làm thay đổi nồng độ, áp suất và hằng số cân bằng.
- Nhưng chất xúc tác làm tăng tốc độ phản ứng cả thuận và nghịch nên hệ nhanh chóng đạt đến cân bằng.
V. Ý nghĩa của tốc độ phản ứng và cân bằng hóa học trong sản xuất hóa học
- Trong công nghiệp và sản xuất việc tăng tốc độ phản ứng và chuyển dịch cân bằng giúp phản ứng thực hiện nhanh và đạt hiệu suất cao.
VI. Bài tập vận dụng
Câu 1. Cho phản ứng thuận nghịch sau:
2NaHCO3 (r) ⇋ Na2CO3 (r) + CO2(k) + H2O (k) ΔH = 129kJ
Có thể dùng những biện pháp gì để chuyển hóa nhanh và hoàn toàn NaHCO3 thành Na2CO3.
Lời giải:
Nhận thấy chiều thuận của phản ứng có ΔH = 129kJ > 0: thu nhiệt và có số mol khí tăng lên.
Vây biện pháp để cân bằng chuyển dịch hoàn toàn theo chiều thuận là
- Đun nóng (tăng nhiệt độ).
- Giảm áp suất bằng cách thực hiện phản ứng trong bình hở.
Câu 2. Cho phản ứng: 2SO2 (k) + O2 (k) ⇋ 2SO3 (k) ΔH < 0
Cân bằng chuyển dịch theo chiều nào khi:
a) Tăng nồng độ SO2
b) Giảm nồng độ O2
c) Giảm áp suất
d) Tăng nhiệt độ.
Lời giải:
a) Khi tăng nồng độ SO2 thì cân bằng chuyển dịch theo chiều thuận nghĩa là chiều làm giảm nồng độ SO2.
b) Khi giảm nồng độ O2 thì cân bằng chuyển dịch theo chiều nghịch nghĩa là chiều tạo ra O2.
c) Khi giảm áp suất thì cân bằng chuyển dịch theo chiều nghịch nghĩa là chiều tăng số mol khí.
d) Khi tăng nhiệt độ cân bằng chuyển dịch theo chiều nghịch nghĩa là chiêu phản ứng thu nhiệt.
Câu 3. Sản xuất amoniac trong công nghiệp dựa trên phương trình hóa học sau:
2N2(k) + 3H2(k) ⇋ 2NH3(k) ΔH = -92kJ
Cân bằng hóa học sẽ chuyển dịch về phía tạo ra amoniac nhiều hơn khi thực hiện. những biện pháp kĩ thuật nào? Giải thích.
Lời giải:
Để thu được nhiều amoniac, hiệu quả kinh tế cao có thể dùng các biện pháp kĩ thuật sau đây:
- Tăng nồng độ N2 và H2.
- Tăng áp suất chung của hệ lên khoảng 100 atm, vì phản ứng thuận có sự giảm thể tích khí.
- Dùng nhiệt độ phản ứng thích hợp khoảng 400 - 450oC và chất xúc tác để tăng tốc độ phản ứng tạo thành NH3. Chú ý rằng chất xúc tác không làm chuyển dịch cân bằng.
- Tận dụng nhiệt của phản ứng sinh ra để sấy nóng hỗn hợp N2 và H2.
- Tách NH3 ra khỏi hỗn hợp cân bằng và sử dụng lại N2 và H2 còn dư.
Câu 4. Sự tăng áp suất ảnh hưởng như thế nào đến trạng thái cân bằng của các phản ứng hóa học sau:
a) 3O2 (k) ⇋ 2O3 (k)
b) H2(k) + Br2(k) ⇋ 2HBr(k)
c) N2O4(k) ⇋ 2NO2(k)
Lời giải:
Để đánh giá tác động của áp suất cần so sánh sự biến đổi của thể tích khí trước và sau phản ứng. Nếu sau phản ứng có sự giảm thể tích thì áp suất tăng làm cân bằng chuyển dịch theo chiều thuận và ngược lại, áp suất không có ảnh hưởng tới cân bằng của các phản ứng không thay đổi thể tích khí.
3O2 (k) ⇋ 2O3 (k)
Phản ứng (a) có sự giảm thể tích, cân bằng chuyển theo chiều thuận khi áp suất tăng.
H2(k) + Br2(k) ⇋ 2HBr(k)
Phản ứng (b) không có sự thay đổi thể tích, cân bằng không phụ thuộc vào áp suất.
c) N2O4(k) ⇋ 2NO2(k)
Phản ứng (c) có sự tăng thể tích, cân bằng chuyển theo chiều nghịch khi áp suất tăng.
Câu 5. Cho phản ứng: CO (k) + Cl2 (k) ⇋ COCl2 (k) được thực hiện trong bình kín ở nhiệt độ không đổi, nồng độ ban đầu của CO và Cl2 bằng nhau và bằng 0,4M.
a) Tính hằng số cân bằng của phản ứng biết rằng khi hệ đạt trạng thái cân bằng thì chỉ còn 50% lượng CO ban đầu.
b) Sau khi cân bằng được thiết lập ta thêm 0,1 mol CO vào 1 lít hỗn hợp. Tính nồng độ các chất lúc cân bằng mới được thiết lập.
Lời giải:
Xem thêm các phần Lý thuyết Hóa học lớp 10 khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)