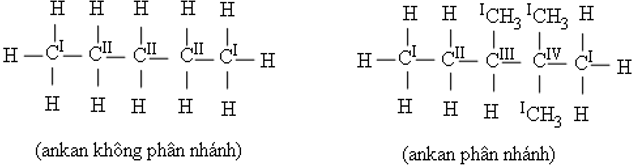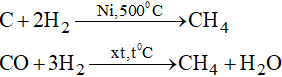Alkane là gì? Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Alkane
Tổng hợp Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Alkane giúp bạn nắm vững kiến thức và học tốt Hóa học.
Alkane
I. Đồng đẳng, đồng phân
1. Đồng đẳng, cấu tạo
- Công thức tổng quát chung cho alkane là CnH2n+2 (n ≥ 1).
- Tên gọi chung là alkane hay paraffin.
- Công thức đơn giản nhất là methane (CH4).
- Mạch carbon hở, có thể phân nhánh hoặc không phân nhánh.
- Trong phân tử chỉ có liên kết đơn (liên kết, …) tạo thành từ 4 obitan lai hóa sp3 của nguyên tử carbon, định hướng kiểu tứ diện đều. Do đó mạch carbon có dạng gấp khúc. Các nguyên tử carbon có thể quay tương đối tự do xung quanh các liên kết đơn.
2. Đồng phân
a. Đồng phân mạch carbon
Alkane chỉ có đồng phân mạch C khi có từ 4C trở lên.
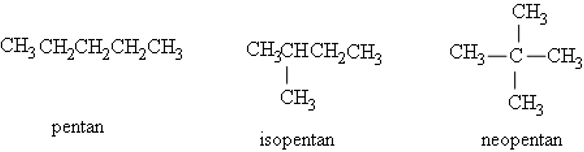
Ví dụ: Các đồng phân của C5H12.
b. Bậc của carbon
Bậc của 1 nguyên tử carbon ở phân tử alkane bằng số nguyên tử C liên kết trực tiếp với nó.
Ví dụ:
- Alkane không phân nhánh là alkane chỉ chứa nguyên tử C bậc I hoặc bậc II.
- Alkane phân nhánh là alkane có chứa C bậc III hoặc C bậc IV.
II. Danh pháp
– Tên gọi gồm: tên mạch carbon có đuôi an.
CH4: Methane C2H6: Ethane
C3H8: Propane C4H10: Butane
C5H12: Pentane C6H14: Hexane
C7H16: Heptane C8H18: Octane
C9H20: Nonane C10H22: Decane
– Phân tử có mạch nhánh thì gọi theo quy tắc sau:
+ Chọn mạch chính: là mạch dài nhất có nhiều nhóm thế nhất.
+ Đánh số vị trí carbon trong mạch chính bắt đầu từ phía gần nhánh hơn.
+ Gọi tên: Vị trí mạch nhánh + tên nhánh + tên mạch chính (tên alkane tương ứng với số nguyên tử carbon trong mạch chính).
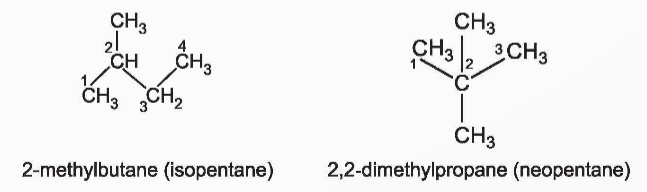
*Lưu ý:
Tên thường:
+ Nếu chỉ có một nhánh duy nhất CH3 ở nguyên tử C số 2 thì thêm tiền tố iso.
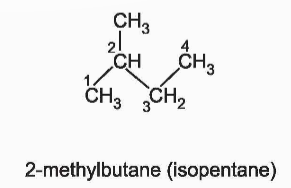
+ Nếu có 2 nhánh CH3 ở C số 2 thì thêm tiền tố neo.
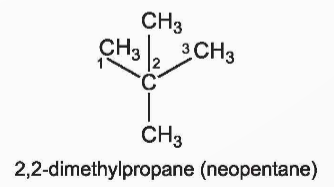
III. Cấu trúc phân tử alkane
1. Sự hình thành liên kết trong phân tử alkane
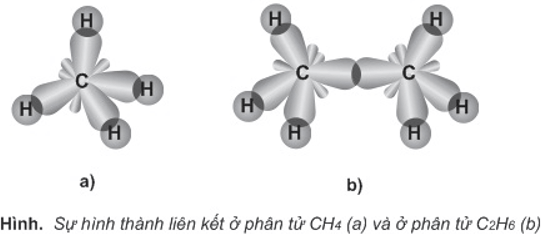
- Các nguyên tử C ở trạng thái lai hóa sp3.
- Mỗi nguyên tử C nằm ở tâm mà 4 đỉnh là các nguyên tử H hoặc C.
- Liên kết C-C, C-H đều là liên kết σ.
- Các góc liên kết xấp xỉ 109,5o.
2. Cấu trúc không gian của alkane
a. Mô hình phân tử
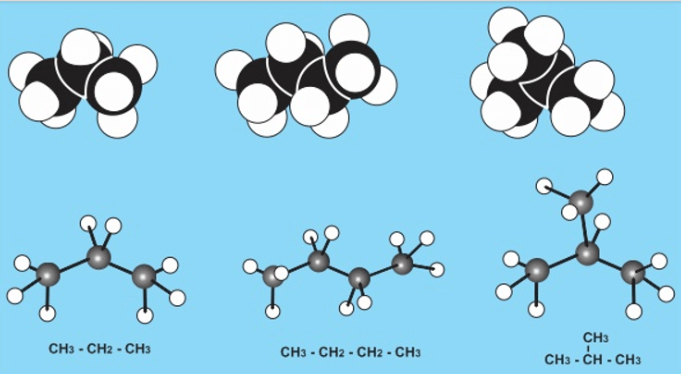
Mô hình phân tử propane, butane và isobutane
b. Cấu dạng
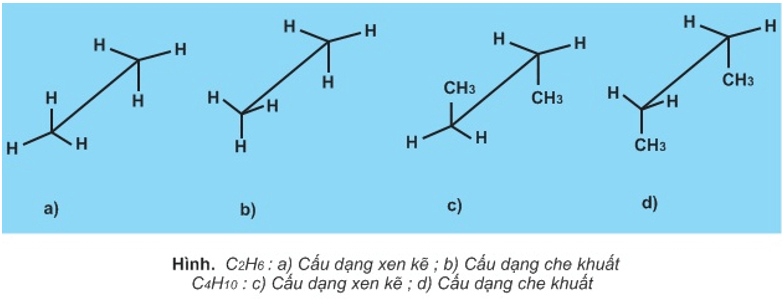
- Các liên kết đơn C-C có thể quay tự do quanh trục liên kết tạo ra vô số dạng khác nhau về vị trí tương đối trong không gian gọi là các cấu dạng.
- Cấu dạng xen kẽ bền hơn cấu dạng che khuất.
- Các cấu dạng luôn chuyển đổi cho nhau.
IV. Tính chất vật lý
- Ở điều kiện thường, các alkane từ C1 đến C4 ở trạng thái khí, từ C5 đến khoảng C18 ở trạng thái lỏng, từ khoảng C18 trở đi ở trạng thái rắn.
- Nhiệt độ nóng chảy, nhiệt độ sôi tăng dần khi tăng số nguyên tử carbon trong phân tử: 4 chất đầu là chất khí, các chất có n từ 5 đến 19 là chất lỏng, khi n ≥ 20 là chất rắn.
- Đều không tan trong nước nhưng dễ tan trong các dung môi hữu cơ.
- Alkane đều là những chất không màu.
- Các alkane nhẹ nhất như methane, ethane, propane là những khí không mùi. Alkane từ C5 − C10 có mùi xăng, từ C10 − C16 có mùi dầu hỏa. Các alkane rắn rất ít bay hơi nên hầu như không mùi.
V. Tính chất hóa học
Phản ứng đặc trưng là phản ứng thế; phản ứng tách hydro và phản ứng cháy.
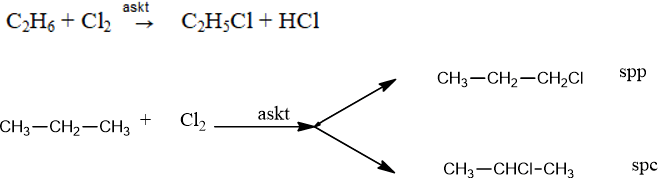
1. Phản ứng thế bởi halogen
Thế chlorine và bromine: Xảy ra dưới tác dụng của askt hoặc nhiệt độ và tạo thành một hỗn hợp sản phẩm.
- Phản ứng thế H bằng halogen thuộc loại phản ứng halogen hóa, sản phẩm hữu cơ có chứa halogen gọi là dẫn xuất halogen.
- Chlorine thế H ở carbon bậc khác nhau; Bromine hầu như chỉ thế H ở carbon bậc cao. Florine phản ứng mãnh liệt nên phân hủy alkane thành C và HF. Iodine quá yếu nên không phản ứng với alkane.
Những alkane có phân tử lớn tham gia phản ứng thế êm dịu hơn và ưu tiên thế những nguyên tử H của nguyên tử C bậc cao cho sản phẩm chính.
2. Phản ứng tách
* Phản ứng tách hydro: ở 400 - 900ºC, xúc tác Cr2O3 + Al2O3.
CH3–CH2-CH3 → CH3-CH=CH2 + H2
* Phản ứng phân cắt mạch carbon:
C5H12 → C2H6 + C3H6
Nhận xét: Dưới tác dụng của nhiệt và xúc tác (Cr2O3, Fe, Pt, ...) các alkane không những bị tách hydro tạo thành hydrocarbon không no mà còn bị gãy các liên kết C−C tạo ra các phân tử nhỏ hơn.
3. Phản ứng oxi hoá:
Phản ứng đốt cháy alkane tạo CO2, H2O và tỏa nhiều nhiệt:
CnH2n+2 + O2 → nCO2 + (n + 1)H2O (1)
Nhận xét:
+ Đốt alkane thu nCO2 < nH2O
+ Nếu đốt hydrocarbon thu được nCO2 < nH2O ⇒ Hydrocarbon đem đốt là alkane (CnH2n+2).
- Trong điều kiện thiếu oxygen ngoài CO2 và H2O phản ứng còn tạo CO, muội than gây hại cho môi trường.
- Nếu có xúc tác và to thích hợp, alkane bị oxi hóa không hoàn toàn tạo thành dẫn xuất chứa oxygen.
VI. Ứng dụng và điều chế
1. Ứng dụng
- Dùng làm nhiên liệu trong hàn cắt kim loại.
- Dùng làm dầu bôi trơn, dung môi.
- Để tổng hợp nhiều chất hữu cơ khác: CH3Cl, CH2Cl2, CCl4, CF2Cl2, ...
- Đặc biệt từ CH4 điều chế được nhiều chất khác nhau: hỗn hợp CO + H2, ammoniac, C2H2, rượu methylic, aldehyde formic, …
2. Điều chế
* Điều chế methane
- Các nguồn khí: từ khí thiên nhiên, khí hồ ao, khí dầu mỏ, khí chưng than đá.
- Tổng hợp:
- Từ khí CH3COONa khan:
- Từ Nhôm cacbua (Al4C3):
Al4C3 + 12H2O → 4Al(OH)3↓ + 3CH4↑
* Điều chế các alkane khác
- Lấy từ các nguồn thiên nhiên: Khí dầu mỏ, khí thiên nhiên, sản phẩm cracking.
- Từ các muối acid hữu cơ:
Xem thêm các phần Lý thuyết Hóa học lớp 11 ôn thi THPT Quốc gia hay khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)