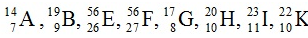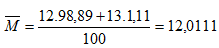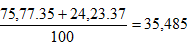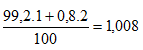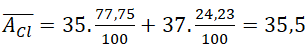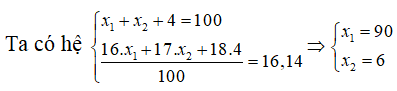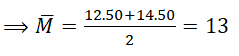Đồng vị là gì? Tính chất, phân loại, ứng dụng đồng vị. Cách tính phần trăm đồng vị
Vietjack.me gửi tới bạn đọc bài viết Đồng vị là gì? Phân loại, ứng dụng đồng vị. Cách tính phần trăm đồng vị với đầy đủ khái niệm, ví dụ, cách nhận biết, ... Mời các bạn đón xem:
Đồng vị là gì? Phân loại, ứng dụng đồng vị. Cách tính phần trăm đồng vị
1. Đồng vị là gì?
Đồng vị là những nguyên tử thuộc cùng một nguyên tố, có cùng số proton nhưng khác nhau về số neutron trong hạt nhân, dẫn đến khối lượng khác nhau. Vì vậy, đồng vị có cùng số nguyên tử và thuộc cùng nguyên tố hóa học nhưng khác nhau về tính chất vật lý do khối lượng khác nhau.
Ví dụ: nguyên tố oxygen, có ba đồng vị phổ biến: 16O, 17O và 18O. Cả ba đồng vị này đều có 8 proton trong hạt nhân, nhưng khác nhau về số neutron: 16O có 8 neutron, 17O có 9 neutron, và 18O có 10 neutron.
Đồng vị phóng xạ là đồng vị của một nguyên tố hóa học mà hạt nhân nguyên tử của nguyến tố đó ở trạng thái không ổn định và phát ra bức xạ ion hóa trong quá trình phân rã để trở thành trạng thái ổn định.
Một số đồng vị phổ biến trong tự nhiên:
Đồng vị của hydrogen: Hydrogen có ba đồng vị tự nhiên là:
Protium (1H), không có neutron.
Deuterium (2H), có một neutron.
Tritium (3H), có hai neutron và là đồng vị phóng xạ. Tritium phát ra bức xạ beta và được sử dụng trong các nghiên cứu khoa học.
Đồng vị của oxygen: Oxygen có ba đồng vị tự nhiên là 16O, 17O, và 18O. Đồng vị 16O chiếm đa số (khoảng 99,76%) và đóng vai trò quan trọng trong việc nghiên cứu khí hậu và môi trường.
Đồng vị của carbon: Carbon có ba đồng vị phổ biến là 12C, 13C, và 14C. Đồng vị 14C là một đồng vị phóng xạ, được sử dụng rộng rãi trong phương pháp xác định tuổi vật liệu hữu cơ, giúp xác định tuổi của các mẫu cổ sinh vật.
2. Tính chất vật lí, tính chất hóa học của đồng vị
-
Tính chất hóa học: Các đồng vị của một nguyên tố thường có tính chất hóa học giống nhau vì chúng có cùng số lượng electron và proton, nên phản ứng hóa học của chúng thường không thay đổi.
-
Tính chất vật lí: Các đồng vị có thể có sự khác biệt lớn về khối lượng nguyên tử, và sự khác biệt này dẫn đến một số thay đổi nhỏ trong tính chất vật lý như độ nóng chảy, độ sôi, và tốc độ khuếch tán.
3. Các loại đồng vị
Có hai loại đồng vị chính thường gặp trong tự nhiên:
-
Đồng vị bền: Là các đồng vị không phân rã tự nhiên và tồn tại vĩnh viễn. Ví dụ, đồng vị cacbon-12 (12C) và carbon-13 (13C) là đồng vị bền, thường gặp trong tự nhiên.
-
Đồng vị phóng xạ: Là các đồng vị không bền, tự phân rã theo thời gian và phát ra bức xạ ion hóa. Một ví dụ tiêu biểu là carbon-14 (14C), đồng vị phóng xạ thường được dùng trong phương pháp xác định tuổi của mẫu vật trong khảo cổ học
4. Cách tính phần trăm đồng vị
a. Các khái niệm tiền đề để tính phần trăm đồng vị
- Nguyên tử
Nguyên tử là đơn vị rất nhỏ, cơ bản cấu tạo nên vật chất. Bản chất của nguyên tử bao gồm 1 hạt nhân ở trung tâm được bao bọc bên ngoài bằng các hạt mang điện tích âm là electron
- Nguyên từ khối
Nguyên tử khối là khối lượng tương đối của nguyên tử.
Nguyên tử khối của một nguyên tố cho biết khối lượng của nguyên tố đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử.
Khối lượng của nguyên tử bằng tổng khối lượng của proton, notron và electron trong nguyên tử đó. Proton và notron đều có khối lượng xấp xỉ 1 u còn electron có khối lượng nhỏ hơn gấp nhiều , khoảng 0,00055 u. Do đó có thể coi nguyên tử khối xấp xỉ số khối của hạt nhân.
- Nguyên tử khối trung bình
Hầu hết các nguyên tố hóa học là hỗn hợp nhiều đồng vị với tỷ lệ phần trăm số nguyên tử xác định nên nguyên tử khối của các nguyên tố có nhiều đồng vị là nguyên tử khối trung bình của hỗn hợp các đồng vị có tính đến tỉ lệ phần trăm số nguyên tử tương ứng.
Giả sử nguyên tử X có hai đồng vị A và B, kí hiệu A, B đồng thời là nguyên tử khối của hai đồng vị, tyt lệ phần trăm số nguyên tử tương ứng là a và b. Khi đó nguyên tử khối trung bình A trung bình của nguyên tố X là :
Atb = (aA + bB ) / 100
Trong những phép toán không cần độ chính xác cao có thể coi nguyên tử khối bằng số khối.
b. Cách tính phần trăm đồng vị
Ta có công thức tính nguyên tử khối trung bình dựa trên thành phần các đồng vị như sau:
Với A1; A2; A3;...; An là nguyên tử khối của các đồng vị và a1; a2;...; an lần lượt là số nguyên tử (% số nguyên tử) của mỗi đồng vị. Nguyên tử khối trung bình sẽ được tính theo công thức:
A=a1A1+a2A2+...+anAn100
Từ đó ta xác định phần trăm các đồng vị
Gọi % của đồng vị 1 là x %
⇒ % của đồng vị 2 là (100 – x).
- Lập phương trình tính nguyên tử khối trung bình ⇒ giải được x.
5. Ứng dụng của đồng vị
* Trong công nghiệp
- Kiểm tra không phá hủy mẫu
- Diệt trùng bằng phóng xạ
- Thủy học và thủy lực học
- Tìm chỗ hỏng bằng sử dụng vết phóng xạ
- Xử lý bức xạ
- Phát năng lượng từ những nguồn đồng vị phóng xạ
* Trong y học
- Tạo ảnh hạt nhân phóng xạ ( chụp X - quang )
- Ứng dụng lâm sàng : tạo ảnh phóng xạ đang giữ một vai trò hữu ích ngày càng tăng trong thực hành lâm sàng thường ngày, Một số ứng dụng tiêu biểu bao gồm:
-
Sự đánh giá bệnh nhân với bệnh động mạch vành để quyết định giải phẫu và theo dõi sau giải phẫu
-
Chuẩn đoán sự quá áp gây ra do vấn đề của thận
-
Xác định ung thư và di căn của nó tới những cơ quan khác
-
Sự tắc nghẽn luồng máu tới phổi trong những bệnh nhân sau khi giải phẫu
-
Xác định sự tắc nghẽn ống dẫn mật dẫn tới bệnh vàng da phẫu thuật
-
Chụp ảnh toàn bộ não để đánh giá bệnh động kinh và chứng loạn trí nhớ
-
Đánh giá bướu tuyến giáp
-
Phân tích miễn dịch phóng xạ
-
Ứng dụng chữa bệnh dược phẩm phóng xạ.
* Trong nông nghiệp
- Sử dụng phốt pho phóng xạ như nguyên tử đánh dấu đã cho phương pháp xác nhận loại phốt phát mà thỏa mãn một cách tốt nhất cho đất đai và cây trồng
- Cách bón phân phốt pho tốt nhất cho gốc cây, bón theo chiều sâu đất trồng và bón theo thời gian cho năng suất tốt hơn.
- Sử dụng những nguyên tố đánh dấu trong phân bón dinh dưỡng, cơ chế của sưn quang hợp, bảo vệ thực vật bao gồm hoạt động của thuốc trừ sâu, sư trao đổi chất trong cây,...
- Sự biến đổi phóng xạ được sử dụng vô cùng rộng rãi trong nhiều quốc gia để nâng cao sản lượng, tạo các giống cây trồng có chất dinh dưỡng cao hơn, như các giống lạc, lúa, cây xanh,...
- Xử lý bức xạ cà phê bằng cách sử dụng electron nhanh, nâng cao chất lượng sản phẩm.
6. Bài tập về đồng vị
Câu 1: Đồng vị là những nguyên tử của cùng một nguyên tố, có số proton bằng nhau nhưng khác nhau về:
A. số electron B. số neutron C. số proton D. số obitan
Lời giải:
⇒ Chọn B.
Nhắc lại: Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số neutron, do đó số khối A khác nhau.
Câu 2: Trong dãy kí hiệu các nguyên tử sau: .
Các kí hiệu nào cùng chỉ cùng 1 nguyên tố hoá học?
A. A, G và B B. H và K C. H, I và K D. E và F
Lời giải:
H và K cùng 1 nguyên tố hóa học do có cùng số p là 10
⇒ Chọn B.
Câu 3: Nguyên tố Cacbon có 2 đồng vị bền: 612C chiếm 98,89% và 613C chiếm 1,11%. Nguyên tử khối trung bình của C là bao nhiêu?
Lời giải:
Vậy NTK trung bình của C là 12,0111
Câu 4: Đồng có 2 đồng vị là 2963Cu và 2965Cu. Nguyên tử khối trung bình của đồng là 63,54. Tính thành phần phần trăm số nguyên tử của mỗi đồng vị.
Lời giải:
Đặt thành phần phần trăm của 2963Cu và 2965Cu lần lượt là x và 1-x (%)
M− = 63.x +65.(1-x) = 63.54
Giải PT ⇒ x= 0,73 (73%)
% 2963Cu = 73%; và % 2965Cu = 27%
Câu 5: Trong tự nhiên, X có hai đồng vị 1735X và 1737X, chiếm lần lượt 75,77% và 24,23% số nguyên tử X. Y có hai đông vị à 11Y và 12Y, chiếm lần lượt 99,2% và 0,8% số nguyên tử Y.
a) Trong tự nhiên có bao nhiêu loại phân tử XY?
A. 2 B. 4 C. 5 D. 6
b) Phân tử khối trung bình của XY là
A. 36,0. B. 36,5. C. 37,5. D. 37,0.
Lời giải:
a) Các loại phân tử XY là : 35X – 1Y, 35X – 2Y, 37X – 1Y, 37X – 2Y
b) Nguyên tử khối trung bình của X :
Nguyên tử khối trung bình Y là:
Phân tử khối trung bình của XY: 35,485 + 1,008 =36,493 ≈ 36,5.
Bài tập trắc nghiệm
Câu 1. Nguyên tố hóa học bao gồm các nguyên tử:
A. Có cùng số khối A. B. Có cùng số proton.
C. Có cùng số neutron. D. Có cùng số proton và số neutron.
Lời giải:
Đáp án: B
Nguyên tố hóa học bao gồm các nguyên tử có cùng số proton khắc số neutron ( hay khác số khối)
Câu 2. Trong dãy kí hiệu các nguyên tử sau, dãy nào chỉ cùng một nguyên tố hóa học:
A. 6A14 ; 7B15 B. 8C16; 8D17; 8E18 C. 26G56; 27F56 D. 10H20 ; 11I22
Lời giải:
Đáp án: B
Câu 3. Cho ba nguyên tử có kí hiệu là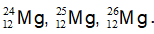
A. Số hạt electron của các nguyên tử lần lượt là: 12, 13, 14.
B. Đây là 3 đồng vị.
C. Ba nguyên tử trên đều thuộc nguyên tố Mg.
D. Hạt nhân của mỗi nguyên tử đều có 12 proton.
Lời giải:
Đáp án: A
Kí hiệu của nguyên tử có dạng với Z là số hiệu nguyên tử, A là số khối
Nhận thấy 3 nguyên tử đều có cùng số Z, khác số khối → 3 nguyên tử là đồng vị của nguyên tố Mg → B, C đúng
Luôn có Z = số p = số e = 12
Câu 4. Nguyên tố clo có hai đồng vị bền 1735Cl chiếm 75,77% và 1737Cl chiếm 24,23%. Tính nguyên tử khối trung của clo?
A. 35 B. 35,5 C. 36 D. 37
Lời giải:
Đáp án: B
Nguyên tử khối trung bình của clo là:
Câu 5. Có 3 nguyên tử: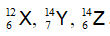
A. X, Y B. Y, Z C. X, Z D. X, Y, Z
Lời giải:
Đáp án: C
Đồng vị là những nguyên tử có cùng số proton ( số hiệu nguyên tử) khác nhau số khối
Thấy X, Z có cùng số proton là 6 , khác nhau số khối → X và Z là đồng vị của nguyên tố Cacbon.
Câu 6. Nguyên tử khối trung bình của đồng là 63,54. Trong tự nhiên, đồng có hai đồng vị 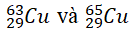
A. 28% B. 73% C 42% D. 37%
Lời giải:
Đáp án: B
Gọi x là % số nguyên tử của 2963Cu ⇒ 100 – x là % của 2965Cu
Ta có 63,54 = (63x + 65(100 - x))/100 ⇒ x = 73
Vậy 2963Cu chiếm 73%
Câu 7. Trong tự nhiên có hai đồng vị bền: 1737Cl chiếm 24,23% tổng số nguyên tử, còn lại là 1735Cl. Thành phần % theo khối lượng của 1737Cl trong HClO4 là:
A. 8,92% B. 8,43% C. 8,56% D. 8,79%
Lời giải:
Đáp án: A
Câu 8. Nguyên tố cacbon có hai đồng vị bền: 12Cchiếm 98,89% và 13C chiếm 1,11%. Nguyên tử khối trung bình của nguyên tố cacbon là
A. 12,5245 B. 12,0111 C. 12,0219 D. 12,0525
Lời giải:
Đáp án: B
Mtb = 98.89% x 12 + 1.11% x 13 = 12,0111
Câu 9. Trong tự nhiên Oxi có 3 đồng vị 16O(x1%) , 17O(x2%) , 18O(4%), nguyên tử khối trung bình của Oxi là 16,14. Phần trăm đồng vị 16O và 17O lần lượt là
A. 35% & 61% B. 90% & 6% C. 80% & 16% D. 25% & 71%
Lời giải:
Đáp án: B
Luôn có x1 + x2 + 4 = 100
Nguyên tử khối trung bình của O là 16.14 = (16x1 + 17x2 + 18.4)/100
Ta có hệ
Câu 10. Một nguyên tố X gồm hai đồng vị là X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng % các đồng vị trong X bằng nhau và các loại hạt trong X1 cũng bằng nhau. Xác định nguyên tử khối trung bình của X?
A. 13 B. 19 C. 12 D. 16
Lời giải:
Đáp án: A
Các hạt trong đồng vị X1 bằng nhau nên: P = E = N = 18/3 = 6
⇒ Số khối của đồng vị X1 là: P + N= 12
⇒ Số khối của đồng vị X2 là: 20 – 6 = 14
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)