Bảng tuần hoàn các nguyên tố hóa học là gì?
Vietjack.me xin giới thiệu đến bạn đọc về bảng tuần hoàn các nguyên tố hóa học bao gồm nguyên tắc sắp xếp, cấu tạo, ý nghĩa. Từ đó, giúp bạn nắm vững kiến thức và học tốt Hóa học.
Bảng tuần hoàn các nguyên tố hóa học
I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
- Các nguyên tố được xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng. (chu kì)
- Các nguyên tố có cùng số e hóa trị trong nguyên tử được xếp thành một cột. (nhóm)
II. Cấu tạo bảng tuần hoàn
1. Ô nguyên tố
Số thứ tự của ô nguyên tố đúng bằng số hiệu nguyên tử của nguyên tố đó (= số e = số p = số đơn vị điện tích hạt nhân).

2. Chu kì
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân tăng dần.
Số thứ tự của chu kì trùng với số lớp electron của nguyên tử các nguyên tố trong chu kì đó.
* Chu kì nhỏ: gồm chu kì 1, 2, 3.
* Chu kì lớn: gồm chu kì 4, 5, 6, 7.
Ví dụ: 12Mg: 1s2/2s22p6/3s2.
→ Mg thuộc chu kì 3 vì có 3 lớp electron.
3. Nhóm nguyên tố
- Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
- Có 2 loại nhóm nguyên tố là nhóm A và nhóm B:
+ Nhóm A: bao gồm các nguyên tố s và p.
Số thứ tự nhóm A = tổng số e lớp ngoài cùng.
+ Nhóm B: bao gồm các nguyên tố d và f có cấu hình e nguyên tử tận cùng dạng (n – 1)dxnsy:
* Nếu (x + y) = 3 → 7 thì nguyên tố thuộc nhóm (x + y)B.
* Nếu (x + y) = 8 → 10 thì nguyên tố thuộc nhóm VIIIB.
* Nếu (x + y) > 10 thì nguyên tố thuộc nhóm (x + y – 10)B.
- Khối các nguyên tố s, p, d, f
- Khối các nguyên tố s: gồm các nguyên tố nhóm IA và IIA
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp s.
Ví dụ: 11Na: 1s22s22p63s1
- Khối các nguyên tố p: gồm các nguyên tố thuộc các nhóm từ IIIA đến VIIIA (trừ He).
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp p.
Ví dụ: 13Al: 1s22s22p63s23p1
- Khối các nguyên tố d: gồm các nguyên tố thuộc nhóm B.
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp d.
Ví dụ: 26Fe: 1s22s22p63s23p63d64s2
- Khối các nguyên tố f: gồm các nguyên tố thuộc họ Lantan và họ Actini.
Là những nguyên tố mà nguyên tử có electron cuối cùng được điền vào phân lớp f.
Ví dụ: 58Ce: 1s22s22p63s23p63d104s24p64f25s25p66s2
III. Xu hướng biến đổi một số tính chất của nguyên tử các nguyên tố trong một nhóm
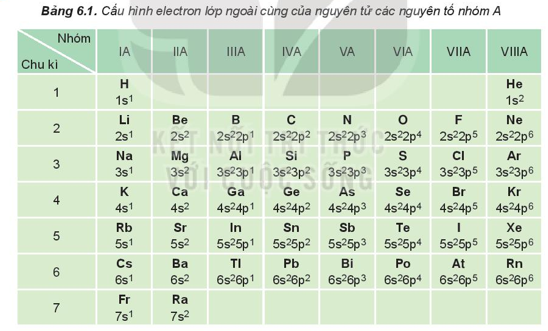
1. Cấu hình electron nguyên tử của các nguyên tố nhóm A
Nguyên tử các nguyên tố nhóm A (gồm các nguyên tố s và p) có số electron lớp ngoài cùng (electron hóa trị) bằng nhau (trừ He trong nhóm VIIIA). Sự giống nhau về số electron hóa trị dẫn đến sự tương tự nhau về tính chất hóa học của các nguyên tố trong cùng nhóm A.
Sau mỗi chu kì, cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố nhóm A được lặp đi lặp lại một cách tuần hoàn là nguyên nhân của sự biến đổi tuần hoàn về tính chất của các nguyên tố.
2. Bán kính nguyên tử
Bán kính nguyên tử phụ thuộc vào lực hút giữa hạt nhân với các electron lớp ngoài cùng. Bán kính giảm là do lực hút tăng và ngược lại, bán kính tăng là do lực hút giảm.
Xu hướng biến đổi bán kính nguyên tử:
- Trong một chu kì, bán kính nguyên tử giảm theo chiều tăng dần của điện tích hạt nhân.
- Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
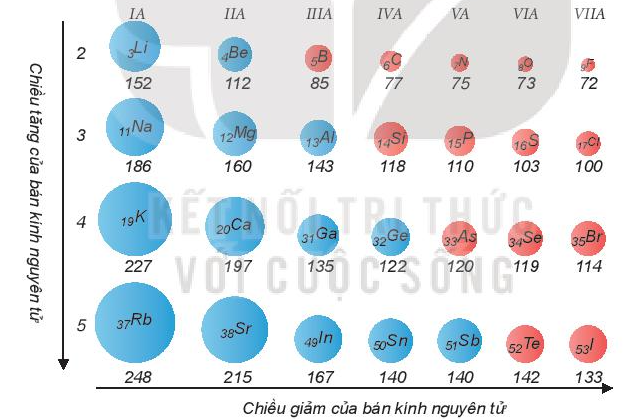 Ví dụ: So sánh bán kính nguyên tử của lithium (Z = 3) và potassium (Z = 19).
Ví dụ: So sánh bán kính nguyên tử của lithium (Z = 3) và potassium (Z = 19).
Hướng dẫn giải:
Cấu hình electron của nguyên tử:
Lithium (Z = 3): 1s22s1 Lithium thuộc chu kì 2, nhóm IA.
Potassium (Z = 19): 1s22s22p63s23p64s1 Potassium thuộc chu kì 4, nhóm IA.
Trong một nhóm A, bán kính nguyên tử tăng theo chiều tăng dần của điện tích hạt nhân.
Bán kính của nguyên tử lithium nhỏ hơn bán kính nguyên tử potassium.
3. Độ âm điện
Độ âm điện của nguyên tử (c) là đại lượng đặc trưng cho khả năng hút electron của nguyên tử một nguyên tố hóa học khi tạo thành liên kết hóa học.
Xu hướng biến đổi độ âm điện theo chiều tăng dần của điện tích hạt nhân:
- Độ âm điện tăng từ trái qua phải trong một chu kì.
- Độ âm điện giảm từ trên xuống dưới trong một nhóm A.
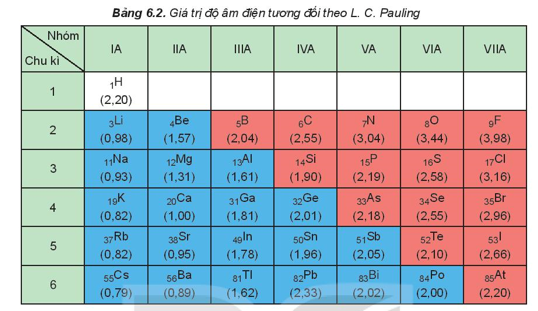
Ví dụ: Cho nguyên tử các nguyên tố: X (Z = 11); Y (Z = 13); T (Z = 17). So sánh độ âm điện của X, Y, T.
Hướng dẫn giải:
Cấu hình electron của nguyên tử các nguyên tố:
X (Z = 11): 1s22s22p63s1 X nằm ở ô số 11, chu kì 3, nhóm IA.
Y (Z = 13): 1s22s22p63s23p1 Y nằm ở ô số 13, chu kì 3, nhóm IIIA.
T (Z = 17): 1s22s22p63s23p5 T nằm ở ô số 17, chu kì 3, nhóm VIIA.
X, Y, T đều thuộc chu kì 3.
Trong một chu kì, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng tăng dần.
So sánh độ âm điện: X < Y < T.
4. Tính kim loại và tính phi kim
a. Khái niệm
Tính kim loại là tính chất của một nguyên tố mà nguyên tử của nó dễ nhường electron để trở thành ion dương. Nguyên tử của nguyên tố nào càng dễ nhường electron để trở thành ion dương, tính kim loại của nguyên tố đó càng mạnh.
- Tính phi kim là tính chất của một nguyên tố mà nguyên tử của nó dễ nhận electron để trở thành ion âm. Nguyên tử của nguyên tố nào càng dễ nhận electron để trở thành ion âm, tính phi kim của nguyên tố đó càng mạnh.
b. Sự biến đổi tính kim loại, tính phi kim
Xu hướng biến đổi tính kim loại và tính phi kim:
- Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần.
- Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần.
Ví dụ 1:

Ví dụ 2: Cho nguyên tử các nguyên tố X (Z = 9), Y (Z = 15), T (Z = 17). So sánh tính phi kim của X, Y, T.
Hướng dẫn giải:
Cấu hình electron nguyên tử:
X (Z = 9): 1s22s22p5 X thuộc chu kì 2, nhóm VIIA.
Y (Z = 15): 1s22s22p63s23p3 Y thuộc chu kì 3, nhóm VA.
T (Z = 17): 1s22s22p63s23p5 T thuộc chu kì 3, nhóm VIIA.
Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính phi kim của các nguyên tố nhóm A có xu hướng tăng dần.
Tính phi kim: Y < T (Y, T cùng thuộc chu kì 3).
Trong một nhóm, theo chiều tăng điện tích hạt nhân, tính phi kim của các nguyên tố nhóm A có xu hướng giảm dần.
Tính phi kim: X > T (X, T cùng thuộc nhóm VIIA).
Vậy: Tính phi kim tăng dần là Y < T < X.
IV. Xu hướng biến đổi thành phần và một số tính chất của hợp chất trong một chu kì
1. Thành phần của các oxide và hydroxide
Hóa trị cao nhất của các nguyên tố nhóm A trong hợp chất với oxygen tăng từ I đến VII khi đi từ trái qua phải trong một chu kì (trừ chu kì 1 và nguyên tố fluorine ở chu kì 2), do đó thành phần của các oxide và hydroxide có sự lặp lại theo chu kì.
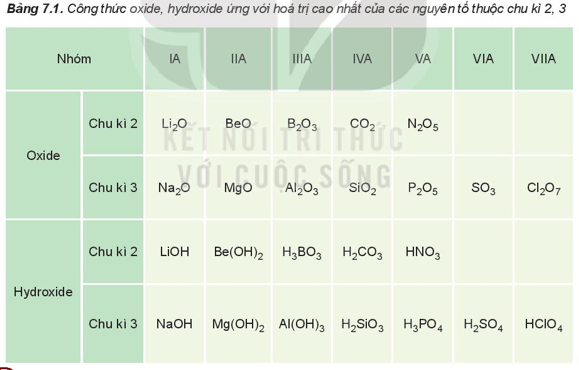
Ví dụ: Nguyên tố calcium thuộc nhóm IIA của bảng tuần hoàn. Viết công thức hóa học của oxide, hydroxide (ứng với hóa trị cao nhất) của nguyên tố trên.
Hướng dẫn giải:
Nguyên tố calcium (Ca) thuộc nhóm IIA.
Hóa trị cao nhất của Ca là II.
Công thức hóa học của oxide là CaO, của hydroxide là Ca(OH)2.
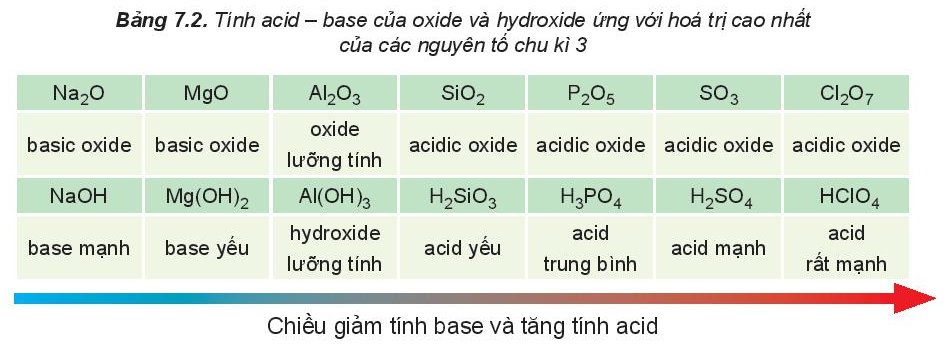
2. Tính chất của oxide và hydroxide
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
Nhận xét:
Hydroxide của các nguyên tố nhóm IA thể hiện tính base mạnh, hydroxide ứng với hóa trị cao nhất của các nguyên tố nhóm VIIA (trừ fluorine) thể hiện tính acid mạnh.
Ví dụ: Cho các nguyên tố P (Z = 15), S (Z = 16), Cl (Z = 17). So sánh tính acid của hydroxide (ứng với hóa trị cao nhất) của các nguyên tố trên.
Hướng dẫn giải:
P (Z = 15): [Ne]3s23p3 P thuộc chu kì 3, nhóm VA.
Hóa trị cao nhất của P là V Công thức hydroxide (ứng với hóa trị cao nhất) là H3PO4.
S (Z = 16): [Ne]3s23p4 S thuộc chu kì 3, nhóm VIA.
Hóa trị cao nhất của S là VI Công thức hydroxide (ứng với hóa trị cao nhất) là H2SO4.
Cl (Z = 17): [Ne]3s23p5 Cl thuộc chu kì 3, nhóm VA.
Hóa trị cao nhất của Cl là VII Công thức hydroxide (ứng với hóa trị cao nhất) là HClO4.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính base của oxide và hydroxide tương ứng giảm dần, đồng thời tính acid của chúng tăng dần.
So sánh tính acid: H3PO4 < H2SO4 < HClO4.
V. Định luật tuần hoàn. Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học
1. Định luật tuần hoàn
Nội dung của định luật tuần hoàn: “Tính chất của các nguyên tố và đơn chất, cũng như thành phần và tính chất của các hợp chất tạo nên từ các nguyên tố đó biến đổi tuần hoàn theo chiều tăng của điện tích hạt nhân nguyên tử”.
2. Ý nghĩa của bảng tuần hoàn
Vị trí của nguyên tố trong bảng tuần hoàn các nguyên tố hóa học cho biết cấu hình electron nguyên tử, từ đó dự đoán được tính chất hóa học của các nguyên tố.
Chú ý: Từ vị trí của nguyên tố trong bảng tuần hoàn, có thể:
- Viết được cấu hình electron của nguyên tử và ngược lại.
- Dự đoán được tính chất (tính kim loại, tính phi kim) của nguyên tố đó.
- Viết được công thức oxide, hydroxide và nêu tính acid, base tương ứng.
Ví dụ 1: Nguyên tố chlorine (Cl) ở ô số 17, nhóm VIIA, chu kì 3.
- Nguyên tử Cl có:
+ 17 proton, 17 electron (do số proton = số electron = Z).
+ 3 lớp electron (do số lớp electron = số thứ tự chu kì).
+ 6 electron lớp ngoài cùng (do số electron lớp ngoài cùng = số thứ tự nhóm A).
Cấu hình electron của Cl: 1s22s22p63s23p5. Cl là nguyên tố phi kim. Oxide cao nhất (Cl2O7) là acidic oxide và acid tương ứng HClO4 là acid mạnh.
Ví dụ 2: Cấu hình electron của nguyên tử phosphorus (P) là 1s22s22p63s23p3.
- Nguyên tử P có Z = 15 (do số proton = số electron = Z).
- Nguyên tố P ở chu kì 3, nhóm VA (do có 3 lớp electron và có 5 electron ở lớp ngoài cùng).
- P là nguyên tố phi kim. Oxide cao nhất (P2O5) là acidic oxide và acid tương ứng là (HPO3 hay H3PO4) là acid trung bình.
Ví dụ 3: So sánh tính phi kim của P (Z = 15), O (Z = 8) và S (Z = 16).
P (Z = 15): 1s22s22p63s23p3 Nguyên tố P thuộc chu kì 3, nhóm VA.
O (Z = 8): 1s22s22p4 Nguyên tố O thuộc chu kì 2, nhóm VIA.
S (Z = 16): 1s22s22p63s23p4 Nguyên tố S thuộc chu kì 3, nhóm VIA.
Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân, tính kim loại giảm dần và tính phi kim tăng dần Tính phi kim: P < S.
Trong một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần và tính phi kim giảm dần Tính phi kim: S < O.
Vậy tính phi kim: P < S < O.
Xem thêm các phần Lý thuyết Hóa học lớp 10 ôn thi THPT Quốc gia khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
