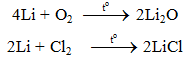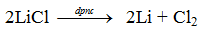Liti (Li) là gì? Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Liti (Li)
Tổng hợp Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Liti (Li) giúp bạn nắm vững kiến thức và học tốt Hóa học.
Liti (Li) là gì?
1. Định nghĩa
- Liti là một kim loại kiềm được phát hiện bởi Johann Arfvedson năm 1817. Arfvedson tìm thấy nguyên tố mới trong khoáng chất spodumen và lepidolit trong quặng petalit
- Kí hiệu: Li
- Cấu hình electron: [He] 2s1
- Số hiệu nguyên tử: 3
- Khối lượng nguyên tử: 7g/mol
- Vị trí trong bảng tuần hoàn
+ Ô: số 3
+ Nhóm: IA
+ Chu kì: 2
- Đồng vị: 6Li, 7li
- Độ âm điện: 0,98
2. Tính chất của Liti (Li)
2.1 Tính chất vật lí
- Kim loại kiềm. Trắng – bạc. Nhẹ nhất trong các kim loại, mềm, dễ nóng chảy.
- Có khối lượng riêng là 0,534 g/cm3; có nhiệt độ nóng chảy là 180,50C và sôi ở 1336,60C
-Nhận biết: Đốt cháy các hợp chất của Kali, cho ngọn lửa màu đỏ.
2.2 Tính chất hóa học
- Liti là kim loại kiềm có tính khử rất mạnh.
Li → Li+ + 1e
a. Tác dụng với phi kim
b. Tác dụng với axit
- Liti dễ dàng khử ion H+ (hay H3O+) trong dung dịch axit loãng (HCl, H2SO4 loãng...) thành hidro tự do.
2Li + 2HCl → 2LiCl + H2.
2Li + H2SO4 → Li2SO4 + H2.
c. Tác dụng với nước
- Li tác dụng chậm với nước tạo thành dung dịch kiềm và giải phóng khí hidro.
2Li + 2H2O → 2LiOH + H2.
d. Tác dụng với hidro
- Liti tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành Liti hidrua.
2Li (lỏng) + H2 (khí) → 2LiH (rắn)
3. Trạng thái tự nhiên
- Liti trong tự nhiên là hỗn hợp của 2 đồng vị ổn định 6Li và 7Li với 7Li là phổ biến nhất (92,5% trong tự nhiên).
- Liti do tính hoạt động hóa học cao nên chỉ có thể tìm thấy trong tự nhiên trong dạng các hợp chất. Nó tạo thành một phần nhỏ của các loại đá cuội và cũng được tìm thấy trong nước biển.
4. Điều chế
- Liti có thể điều chế nhờ điện phân nóng chảy Liti clorua
5. Ứng dụng
- Vì nhiệt dung riêng nhỏ của nó (nhỏ nhất trong số các chất rắn), liti được sử dụng trong các ứng dụng truyền nhiệt. Nó cũng là vật liệu quan trọng trong chế tạo anốt của pin vì khả năng điện hóa học cao của nó
- Liti có thể được sử dụng để tăng thêm hiệu quả của các thuốc chống trầm cảm khác.
- Liti là chất được sử dụng trong việc tổng hợp các hợp chất hữu cơ cũng như trong các ứng dụng hạt nhân.
6. Các hợp chất quan trọng của Liti
- Liti hiđroxit: LiOH
7. Bài tập liên quan
Cân bằng các phản ứng hóa học sau:
Li + Cl2→ 2LiCl
Li + H2O → KOH + H2
Li + 2H2SO4 → Li2SO4 + H2
Li + H3PO4 → Li3PO4 + H2
Li + H3PO4 → Li2HPO4 + H2
Li + 2H3PO4 → LiH2PO4 + H2
Li + C2H5OH → C2H5OLi + H2
Li + CH3OH → CH3OLi + H2
Li + CH3 COOH → CH3COOLi + H2
Li + C6H5OH → C6H5OLi + H2
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)