Alcohol là gì? Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của alcohol
Tổng hợp Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Alcohol giúp bạn nắm vững kiến thức và học tốt Hóa học.
Alcohol
I. Định nghĩa – phân loại
1. Định nghĩa
- Alcohol là những hợp chất hữu cơ, trong phân tử có nhóm hydroxyl – OH liên kết trực tiếp với nguyên tử carbon no.
- Nhóm OH này được gọi là nhóm – OH alcohol.
- Ví dụ một số alcohol:
CH3CH2OH; CH2 = CH – CH2 – OH; C6H5 – CH2 – OH.
- Công thức tổng quát của alcohol: R(OH)n (n ≥ 1), với R là gốc hydrocarbon.
- Công thức của alcohol no, mạch thẳng, đơn chức: CnH2n+1OH hay CnH2n+2O (với n ≥ 1).
2. Phân loại
- Dựa vào đặc điểm gốc hydrocarbon, các alcohol được chia thành:
+ Alcohol no. Ví dụ: CH3OH; CH2OH – CH2OH …
+ Alcohol không no. Ví dụ: CH2 = CH – CH2 – OH …
+ Alcohol thơm (phân tử có vòng benzene). Ví dụ: C6H5 – CH2 – OH…
- Dựa vào số nhóm OH trong phân tử, alcohol được chia thành:
+ Alcohol đơn chức: CH3OH; CH2 = CH – CH2 – OH …
+ Alcohol đa chức: CH2OH – CH2OH; CH2OH – CH(OH) – CH2OH …
- Các alcohol còn được phân loại theo bậc alcohol. Bậc của alcohol được xác định bằng bậc của nguyên tử C liên kết với nhóm -OH.
II. Đồng phân, danh pháp
1. Đồng phân
Các alcohol no, mạch hở, đơn chức có đồng phân mạch alcohol và đồng phân vị trí nhóm chức – OH trong mạch carbon.
Ví dụ: C4H10O có các đồng phân alcohol như sau:
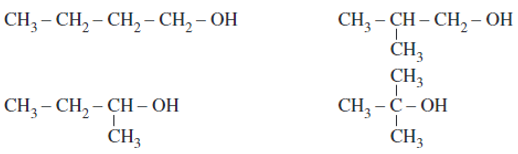
2. Danh pháp
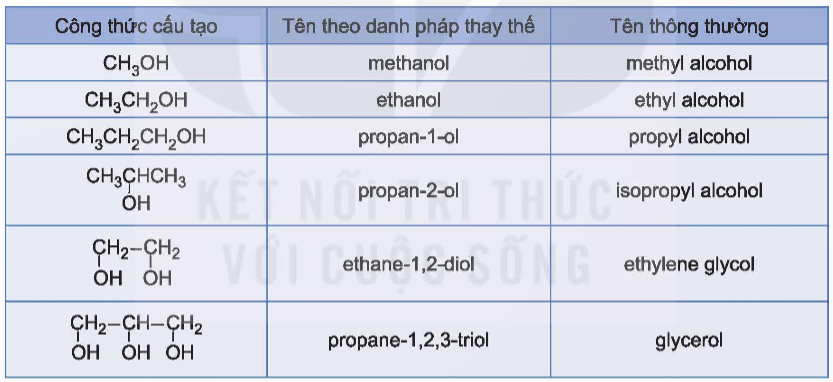
a) Tên thông thường
- Một số ít alcohol có tên thông thường.
- Tên thông thường = Alcohol + tên gốc alkyl+ ic.
Ví dụ:
CH3-CH2-OH: alcohol ethylic.
CH3-OH: alcohol methylic.
b) Tên thay thế
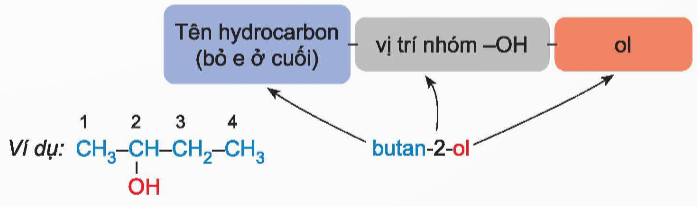
Các bước gọi tên thay thế:
-Chọn mạch chính của phân tử alcohol là mạch dài nhất có chứa nhóm -OH.
- Đánh số thứ tự nguyên tử carbon trên mạch chính bắt đầu từ phía gần nhóm -OH hơn.
- Tên thay thế = tên hydrocarbon tương ứng với mạch chính + số chỉ vị trí nhóm OH + ol.
- Ví dụ:
III. Tính chất vật lý
- Các alcohol là chất lỏng hoặc chất rắn ở điều kiện thường.
- Nhiệt độ sôi, khối lượng riêng của các alcohol tăng theo chiều tăng của phân tử khối, ngược lại độ tan trong nước của chúng lại giảm khi phân tử khối tăng.
- Các alcohol có nhiệt độ sôi cao hơn các hydrocarbon có cùng phân tử khối hoặc đồng phân ether của nó là do giữa các phân tử alcohol có liên kết hydrogen ⇒ Ảnh hưởng đến độ tan.
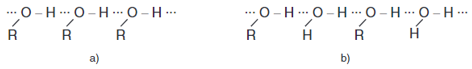
Liên kết hiđro giữa các phân tử ancol với nhau (a) và với nước (b)
IV. Tính chất hóa học
Trong phân tử alcohol liên kết C – OH, đặc biệt liên kết O – H phân cực mạnh nên nhóm – OH nhất là nguyên tử H dễ bị thay thế hoặc tách ra trong các phản ứng hóa học.
1. Phản ứng thế H của nhóm OH alcohol (phản ứng đặc trưng của alcohol)
- Tính chất chung của alcohol tác dụng với kim loại kiềm:
Ví dụ:
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2
Tổng quát:
+ Với alcohol đơn chức:
2ROH + 2Na → 2RONa + H2↑
+ Với alcohol đa chức:
2R(OH)x + 2xNa → 2R(ONa)x + xH2↑
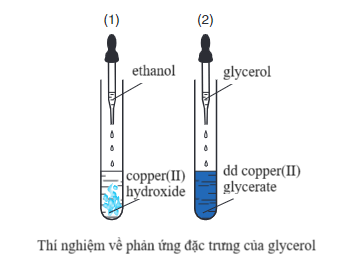
- Tính chất đặc trưng của glycerol hòa tan Cu(OH)2
Ví dụ:
2C3H5(OH)3 + Cu(OH)2 → [C3H5(OH)2O]2Cu + 2H2O
Không chỉ glycerol, các alcohol đa chức có các nhóm – OH liền kề cũng có tính chất này.
⇒ Phản ứng này dùng để phân biệt alcohol đơn chức với alcohol đa chức có các nhóm - OH cạnh nhau trong phân tử.
2. Phản ứng thế nhóm OH
a) Phản ứng với acid vô cơ:
Ví dụ:
C2H5OH + HBr C2H5Br + H2O
Các alcohol khác cũng có phản ứng tương tự, phản ứng này chứng tỏ phân tử alcohol có nhóm – OH.
b) Phản ứng với alcohol
Ví dụ:
2C2H5OH C2H5OC2H5 + H2O
C2H5OC2H5: diethyl ether
⇒ Công thức tính số ether tạo thành từ n alcohol khác nhau là
3. Phản ứng tách nước (phản ứng đehidrat hoá)
Ví dụ:
CH3CH2OH CH2 = CH2 + H2O
Trong điều kiện tương tự, các alcohol no, đơn chức, mạch hở (trừ CH3OH) có thể bị tách nước tạo thành alkene. Tổng quát:
CnH2n + 1OH CnH2n + H2O
4. Phản ứng oxi hoá
- Phản ứng oxi hoá hoàn toàn:
Khi bị đốt các alcohol cháy, tỏa nhiều nhiệt. Tổng quát cho đốt cháy alcohol no, đơn chức, mạch hở:
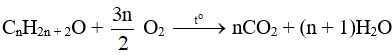
- Phản ứng oxi hoá không hoàn toàn bởi CuO, to
+ Các alcohol bậc I bị oxi hóa không hoàn toàn tạo thành aldehyde. Ví dụ:
CH3CH2OH + CuO CH3CHO (aldehyde acetic) + Cu + H2O
+ Các alcohol bậc II bị oxi hóa không hoàn toàn tạo thành keton. Ví dụ:
CH3- CH(OH) – CH3 + CuO CH3 – CO – CH3 + Cu + H2O
+ Trong điều kiện trên, alcohol bậc III không phản ứng.
V. Điều chế
a. Phương pháp tổng hợp
Alkene + H2O alcohol
Ví dụ:
CH2 = CH2 + H2O CH3 – CH2 – OH
b. Phương pháp sinh hoá: từ tinh bột, đường, ... lên men.
(C6H10O5)n C6H12O6 C2H5OH
VI. Ứng dụng
Ethanol có nhiều ứng dụng trong nhiều lĩnh vực như dược phẩm, dung môi, rượu, nước giải khát, mĩ phẩm, phẩm nhuộm, ...
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 11 đầy đủ, chi tiết khác:
Lý thuyết Bài 42: Luyện tập: Dẫn xuất halogen, ancol và phenol
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
