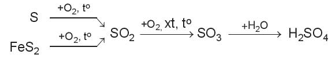Lý thuyết, cách xác định và bài tập về phản ứng oxi hóa khử
Phản ứng oxi hóa khử
I. Số oxi hóa
1. Khái niệm
- Số oxi hóa là điện tích quy ước của nguyên tử trong phân tử khi coi tất cả các electron liên kết đều chuyển hoàn toàn về nguyên tử có độ âm điện lớn hơn.
- Số oxi hóa được viết ở dạng đại số, dấu viết trước, số viết sau.
- Một số ví dụ:
+ Xét phân tử KCl: Nguyên tử K nhường 1 electron cho nguyên tử Cl, khi đó nguyên tử K trở thành ion dương mang điện tích 1+ (số oxi hóa của K là +1) và nguyên tử Cl nhận 1 electron của nguyên tử K trở thành ion âm mang điện tích 1- (số oxi hóa của Cl là – 1).
+ Xét phân tử nước H2O (có liên kết cộng hóa trị): Độ âm điện của nguyên tử O lớn hơn độ âm điện của nguyên tử H, nếu các cặp electron liên kết chuyển hoàn toàn về nguyên tử O thì nguyên tử O có thêm 2 electron và trở thành ion âm mang điện tích 2- (số oxi hóa của oxi là -2); mỗi nguyên tử H mất đi 1 electron và trở thành ion dương có điện tích 1+ (số oxi hóa của H là +1).
+ Xét phân tử hydrogen H2: Hai nguyên tử H giống nhau nên cặp electron liên kết không bị lệch về phía nguyên tử nào. Do vậy, mỗi nguyên tử H đều trung hòa về điện, có điện tích bằng 0 và số oxi hòa là 0.
2. Quy tắc xác định số oxi hóa
Thông thường, số oxi hóa của nguyên tử được xác định trực tiếp từ công thức phân tử theo các quy tắc:
- Quy tắc 1: Trong đơn chất, số oxi hóa của nguyên tử bằng 0.
Ví dụ: 0C;0S;0Fe;0H2
- Quy tắc 2: Trong phân tử các hợp chất, thông thường số oxi hóa của hydrogen là +1, của oxygen là -2, các kim loại điển hình có số oxi hóa dương và có giá trị bằng số electron hóa trị.
- Quy tắc 3: Trong hợp chất, tổng số oxi hóa của các nguyên tử trong phân tử bằng 0.
Ví dụ: +4C−2O2
Tổng số oxi hóa = (+4) + (-2).2 = 0.
- Quy tắc 4: Trong ion đơn nguyên tử, số oxi hóa của nguyên tử bằng điện tích ion; trong ion đa nguyên tử, tổng số oxi hóa của các nguyên tử bằng điện tích ion.
Ví dụ: (−3N+1H4)+
Tổng số oxi hóa = (-3) + (+1).4 = + 1.
- Phối hợp các quy tắc có thể xác định số oxi hóa của một nguyên tử trong hợp chất khi biết số oxi hóa của các nguyên tử còn lại.
Ví dụ: Xác định số oxi hóa của S trong H2SO4.
Hướng dẫn:
+ Dựa vào quy tắc 2 ta có số oxi hóa của H và O trong H2SO4 lần lượt là +1 và -2.
+ Gọi số oxi hóa của S là x, dựa vào quy tắc 3 ta có:
(+1).2 + x + (-2).4 = 0 → x = +6.
II. Chất oxi hóa, chất khử, phản ứng oxi hóa – khử.
1. Chất oxi hóa, chất khử
- Chất khử là chất nhường electron, chất oxi hóa là chất nhận electron.
- Quá trình oxi hóa là quá trình chất khử nhường electron, quá trình khử là quá trình chất oxi hóa nhận electron.
- Ví dụ: Đưa mẩu than gỗ nóng đỏ vào bình đựng khí oxygen, mẩu than cháy sáng.
0C+0O2to→+4C−2O2
Trong phản ứng trên, nguyên tử C nhường 4 electron, là chất khử; phân tử oxi nhận 4 electron, là chất oxi hóa.
0C→+4C+4e (Quá trình oxi hóa)
0O2+4e→2−2O (quá trình khử)
2. Phản ứng oxi hóa – khử
- Phản ứng oxi hóa – khử là phản ứng hóa học xảy ra đồng thời quá trình nhường và quá trình nhận electron.
- Dấu hiệu nhận ra phản ứng oxi hóa – khử là có sự thay đổi số oxi hóa của nguyên tử.
Ví dụ: Cho một số phản ứng sau:
(1) 0Na + 0Cl2 → 2+1Na−1Cl
(2) CuO + 2HCl → CuCl2 + H2O
(3) 0Cl2 + 2NaOH → Na−1Cl + Na+1ClO + H2O
Trong các phản ứng trên:
Phản ứng (1) là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của Na và Cl.
Phản ứng (2) không phải là phản ứng oxi hóa – khử vì không có nguyên tố nào thay đổi số oxi hóa.
Phản ứng (3) là phản ứng oxi hóa – khử vì có sự thay đổi số oxi hóa của Cl.
III. Lập phương trình hóa học của phản ứng oxi hóa – khử
- Phương pháp thăng bằng electron được dùng để lập phương trình hóa học của phản ứng oxi hóa – khử theo nguyên tắc: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
- Các bước lập phương trình hóa học của phản ứng oxi hóa – khử theo phương pháp thăng bằng electron:
+ Bước 1: Xác định các nguyên tử có sự thay đổi số oxi hóa, từ đó xác định chất oxi hóa, chất khử.
+ Bước 2: Biểu diễn các quá trình oxi hóa, quá trình khử.
+ Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa dựa trên nguyên tắc: Tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
+ Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng, từ đó tính hệ số của chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
- Ví dụ: Lập phương trình hóa học sau theo phương pháp thăng bằng electron:
Mg + HNO3 → Mg(NO3)2 + NO + H2O.
Hướng dẫn:
Xác định các nguyên tố thay đổi số oxi hóa:
0Mg + H+5NO3 → +2Mg(NO3)2+ +2NO + H2O.
Biểu diễn các quá trình oxi hóa, quá trình khử và tìm hệ số:
3×2×(0Mg→+2Mg+2e+5N+3e→+2N)
→ Phương trình hóa học:
3Mg + 8HNO3 → 3Mg(NO3)2 + 2NO + 4H2O.
IV. Phản ứng oxi hóa – khử trong thực tiễn
Trong thực tiễn, phản ứng oxi hóa – khử rất phổ biến. Ví dụ:
1. Sự cháy
- Phản ứng cháy là phản ứng oxi hóa – khử xảy ra ở nhiệt độ cao giữa chất cháy và chất oxi hóa.
- Sự cháy kèm theo sự tỏa nhiệt và phát sáng, tạo ra nhiệt lượng đủ để duy trì sự cháy.
- Ví dụ phản ứng oxi hóa – khử xảy ra khi đốt cháy carbon trong than đá:
C + O2 to→ CO2
2. Sự han gỉ kim loại
- Sau một thời gian sử dụng, nhiều thiết bị, máy móc, vật dụng bằng kim loại thường bị han gỉ do sự oxi hóa bởi oxygen trong không khí.
- Ví dụ: Trong không khí ẩm các vật dụng bằng thép bị oxi hóa tạo gỉ sắt:
4Fe + 3O2 + xH2O → 2Fe2O3.xH2O
3. Sản xuất hóa chất
- Trong công nghiệp, phần lớn các phản ứng hóa học xảy ra trong quy trình sản xuất là phản ứng oxi hóa – khử.
- Ví dụ quy trình sản xuất sulfuric acid từ sulfur hoặc quặng pyrite:
4. Chuyển hóa các chất trong tự nhiên
- Trong tự nhiên cũng xảy ra rất nhiều quá trình kèm theo phản ứng oxi hóa – khử.
- Ví dụ: Tia sét tạo ra tia lửa điện, tạo điều kiện cho nitrogen phản ứng với oxygen.
N2 + O2 tiaset→ 2NO
5. Xác định nồng độ của một chất dựa vào phản ứng oxi hóa – khử
- Trong thực tế, dung dịch thuốc tím (KMnO4) được sử dụng phổ biến như một tác nhân oxi hóa mạnh để xác định hàm lượng các chất khử như iron(II); hydrogen peroxide, oxalic acid, …
Xem thêm tóm tắt lý thuyết Hóa học lớp 10 khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)