Natri cacbonat (Na2CO3) là gì? Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Na2CO3
Tổng hợp Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Natri cacbonat (Na2CO3) giúp bạn nắm vững kiến thức và học tốt Hóa học.
Natri Cacbonat (Na2CO3) là gì?
1. Định nghĩa
Natri cacbonat là một muối diazonium của axit cacbonic với công thức hóa học Na2CO3.
Natri cacbonat có tác dụng kiềm hóa.
Khi natri cacbonat hòa tan trong nước, nó tạo ra axit cacbonic và natri hiđroxit.
Natri cacbonat (Na2CO3 ) có khối lượng mol phân tử là 106,0 g / mol. Nó là một muối natri của axit cacbonic được tạo thành từ hai cation natri (Na + ) và một anion cacbonat (CO3 2- ). Nó được tạo thành từ heptahydrat kết tinh.
2. Tính chất
2.1 Tính chất vật lý
Trạng thái tồn tại: Chất rắn khan, không mùi, màu trắng và là một chất hút ẩm tốt.
Khối lượng riêng: 2.532 g/cm3, thể rắn
Khối lượng mol: 105.9884 g/mol
Nhiệt độ nóng chảy: 851oC (1124 K)
Nhiệt độ sôi: 1600 °C (2451 K)
Nhiệt độ phân hủy: 853oC
Độ tan: Tan hoàn toàn trong nước nóng, glycerol, axit sunfuic . Ở 20°C, độ tan trong nước là 22 g/100 ml, phản ứng tỏa nhiệt lớn. Hòa tan một phần trong dung dịch acetone, alcohol, methanol
Trạng thái dung dịch:
- Thấp hơn 32.5°C: Kết tinh thành Na2CO3.10H2O
- Từ 32.5 – 37.5°C: Tạo thành tạo Na2CO3.7H2O
- Từ 37.5°C đến dưới 107°C: Biến đổi thành Na2CO3.H2O
- Từ 107°C: Trở thành natri cacbonat khan do nước hoàn toàn bị bốc hơi hết.
Tính ăn mòn: Không ăn mòn thủy tinh nhưng dung dịch natri cacbonat đặc nóng có thể ăn mòn thépTrong không khí, decahiđrat Na2CO3.10H2O dễ xảy ra hiện tượng thoát nước để trở thành dạng bột có màu trắng Na2CO3.5H2O
- 2.2 Tính chất hóa học
Natri cacbonat (Na2CO3) có thể phản ứng với HCl loãng để giải phóng cacbon đioxit.
-
Na2CO3 + 2HCl loãng 2NaCl + H2O + CO2
- Natri cacbonat (Na2CO3) hấp thụ carbon dioxide và nước để tạo ra natri hydro cacbonat–
-
Na2CO3 (bão hòa) + H2O + CO2 2NaHCO3
- Phản ứng với hydro florua-
-
Na2CO3 + 2HF 2NaF + H2O + CO2
- 3.Vai trò
Natri cacbonat - Na2CO3 có 2 dạng là: dạng nặng và dạng nhẹ.
Dạng nặng (khối lượng riêng là 1 kg/dm3): Được dùng trong công nghiệp chế tạo thủy tinh.
Natri cacbonat chiếm 13 – 15% trong tổng số các nguyên liệu sản xuất thủy tinh, dùng để nấu thủy tinh, hạ nhiệt độ nung chảy cát silic trong và làm tăng thêm tính mềm dẻo. Dù chỉ giữ vị trí thứ 2 về khối lượng chất đưa vào nhưng chi phí của nó lại chiếm tới 50 – 60% tổng chi phí nguyên liệu sản xuất.
Dạng nhẹ (khối lượng riêng là 0,5kg/dm3)
3.1 Trong công nghiệp sản xuất
Trong ngành công nghiệp sản xuất các loại chất tẩy rửa, Natri cacbonat được sử dụng làm chất độn và chất phụ gia với nhu cầu sử dụng chiếm khoảng 10 -12% sản lượng Na2CO3 trên toàn thế giới.
Na2CO3 là chất đầu vào để sản xuất nhiều hợp chất của natri như xút ăn da, thủy tinh tan, cromat, dicromat, borac, chúng chiếm đến 30% nhu cầu. Đôi khi, dung dịch Natri cacbonat lỏng còn được dùng để thay thế cho Na2CO3
Dung dịch natri cacbonat được dùng để làm sạch lớp dầu mỡ tồn tại trên bề mặt các chi tiết của máy móc trước khi tiến hành phun sơn hoặc tráng kim loại.
Hỗ trợ loại bỏ lưu huỳnh tronh xử lý nước thải và khí thải.
Na2CO3 được dùng trong sản xuất cao su tổng hợp, chất nổ, tinh chế dầu.
3. 3 Trong công nghiệp thực phẩm
Na2CO3 tinh khiết (bột nở) được sử dụng làm chất tạo xốp, giòn cho nhiều loại bánh như quẩy, muffin, cookies, biscuits
Người ta còn dùng chúng để làm giảm độ axit, độ chua của nước chanh, sốt cà chua.
Có thể làm rút ngắn thời gian nấu, giúp các loại đậu nhanh chín bằng cách ngâm chúng trong dung dịch Natri cacbonat. Việc này khắc phục đáng kể tình trạng đầy bụng khi săn các loại đậu.
Natri cacbonat làm mềm nhanh chóng các món hầm.
4. Ứng dụng
Natri cacbonat (Na2CO3) thường được sử dụng cho các mục đích sau:
Natri cacbonat (hoặc soda giặt) là một chất làm sạch. Nhiều loại bột xà phòng khô có chứa natri cacbonat.
Nó được sử dụng để loại bỏ cả độ cứng tạm thời và vĩnh viễn của nước.
Nó được sử dụng trong sản xuất thủy tinh, xà phòng và giấy.
Nó còn được sử dụng trong sản xuất các hợp chất natri như borax.
Na2CO3 có nhiều ứng dụng trong ẩm thực.
Na2CO3 cũng được sử dụng làm bazơ mạnh trong nhiều ứng dụng khác nhau.
 \
\
5. Điều chế
5.1 Trong tự nhiên
Natri cacbonat tồn tại trong tro của rong biển ở một số vùng đại dương miền Tây Nam Tây Ban Nha (25–30% ) hoặc các hồ muối, mỏ muối dưới dạng Na2CO3.nH2O, Na2CO3.NaHCO3.2H2O ở những khu vực thung lũng có mưa nhiều, không khí khô và gần núi đá vôi.
Sản xuất từ các loại đá quặng trong tự nhiên: Quặng natri cacbonat được tìm thấy nhiều nhất ở Botswana, Trung Quốc, Ai Cập, Ấn Độ, Kenia, Mêxicô, Pêru, Nam Phi, Thổ Nhĩ Kỳ và Mỹ. Trên thế giới có hơn 60 loại quặng natri cacbonat, chiếm 1/3 sản lượng natri cacbonat.
Tuy nhiên, natri cacbonat thu được lại không có độ tinh khiết cao vì có chứa nhiều tạp chất như muối clorua, sunfat và các chất không tan.
Hiện nay, các hồ, mỏ muối lớn phần lớn có ở châu Phi, châu Mỹ, châu Âu, Ấn Độ như Iagafdi, Bora, Tơ-ron, vùng Cát Biên, Segadin, Lu-na.

Để khai thác natri cacbonat từ sâu trong lòng đất, người ta cho nước nóng xuống giếng khoan với mục đích hoà tan natri cacbonat đến khi đạt mức nồng độ là 32 độ Bo-mê thì đưa lên mặt đất, sau đó mang đi đem hòa tan rồi kết tinh phân đoạn để thu được sản phẩm tinh khiết.
5.2 Trong công nghiệp
Phương pháp Leblanc hay còn gọi là phương pháp sunfat:
Nung hỗn hợp natri sunfat với than và đá vôi trong điều kiện nhiêt độ 1000oC
Na2SO4 + 2C → Na2S + 2CO2
Na2S + CaCO3 → Na2CO3 + CaS
Mang hỗn hợp sản phẩm được tạo ra hòa tan với nước để tách CaS do nó không tan. CaS có thể tiếp tục được sử dụng để sản xuất lưu huỳnh.
Phương pháp Solvay sử dụng amoniac:
NaCl + NH3 + CO2 + H2O ↔ NaHCO3 + NH4Cl
NaHCO3 ít tan trong nước được tách ra, nhiệt phân tạo thành Na2CO3
2NaHCO3 ↔ Na2CO3 + CO2 + H2O
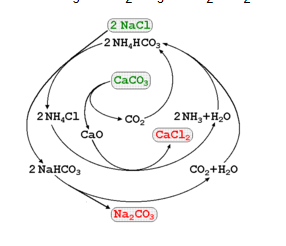
Công nghệ Solvay
Các sản phẩm phụ sau phản ứng lại tiếp tục được chế hóa lại để sử dụng lại cho quá trình điều chế Na2CO3 tiếp theo.
6. Bài tập liên quan
Bài 1: Nung 100 gam hỗn hợp gồm Na2CO3 và NaHCO3 cho đến khi khối lượng hỗn hợp không đổi được 69 gam chất rắn. Phần trăm khối lượng của mỗi chất tương ứng trong hỗn hợp ban đầu là
A. 15,4% và 84,6%
B. 22,4% và 77,6%
C. 16% và 84%
D. 24% và 76%
Hướng dẫn
Chỉ có NaHCO3 bị phân hủy. Đặt x là số mol NaHCO3
2NaHCO3 Na2CO3 + CO2 + H2O
x 0,5x
Theo phương trình và giả thiết ta có: 84x – 106.0,5x = 100 – 69
→ x = 1
Vậy NaHCO3 chiếm 84% và Na2CO3 chiếm 16%
Bài 2 : Nhỏ từ từ đến hết 100 ml dung dịch X gồm K2CO3 1,5M và NaHCO3 1M vào 200 ml dung dịch HCl 1M, sinh ra V lít khí (đktc). Giá trị của V là
A. 2,80.
B. 3,36.
C. 5,60.
D. 6,72.
Hướng dẫn
Ta có:
Ta thấy:
H+ hết
Tỉ lệ:
Gọi số mol của thành lần lượt là 3x và 2x mol
Phương trình hóa học:
→ 6x + 2x = 0,2 → x = 0,025
Theo phương trình:
lít
Chọn A.
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)

