Muối amoni là gì? Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của muối amoni
Tổng hợp Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Muối amoni giúp bạn nắm vững kiến thức và học tốt Hóa học.
MUỐI AMONI
- Là tinh thể ion gồm cation và anion gốc axit.
Thí dụ: NH4Cl (amoni clorua), NH4NO3 (amoni nitrat).
I. Tính chất vật lý
- Tất cả các muối amoni đều tan nhiều trong nước.
- Khi tan trong nước, điện li hoàn toàn thành các ion.
NH4Cl →+ Cl-
1. Tác dụng với dung dịch kiềm
- Dung dịch đậm đặc của muối amoni phản ứng với dung dịch kiềm khi đun nóng sinh ra khí amoniac.
Thí dụ:
NH4Cl + NaOH NH3↑ + NaCl + H2O
Phương trình ion rút gọn là:
+→ NH3↑ + H2O
→ Phản ứng này để nhận biết ion amoni và điều chế amoniac trong phòng thí nghiệm.
2. Phản ứng nhiệt phân
Các muối amoni dễ bị phân hủy bởi nhiệt.
- Muối amoni chứa gốc của axit không có tính oxi hóa khi nung nóng bị phân hủy thành NH3.
Thí dụ:
NH4Cl (r)NH3↑ + HCl↑
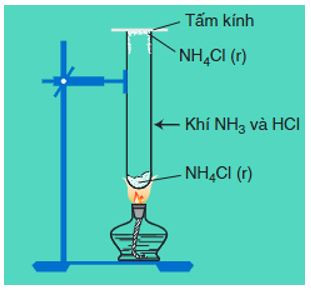
Hình 5: Sự phân hủy của NH4Cl
- Các muối amoni cacbonat và amoni hiđrocacbonat bị phân hủy dần dần ngay ở nhiệt độ thường, khi đun nóng thì phản ứng xảy ra nhanh hơn.
(NH4)2CO3 (r)NH3↑ + NH4HCO3 (r)
NH4HCO3 (r)NH3↑ + CO2↑ + H2O
Lưu ý: NH4HCO3 (bột nở) được dùng làm xốp bánh.
- Muối amoni chứa gốc của axit có tính oxi hóa như axit nitrơ, axit nitric khi bị nhiệt phân cho ra N2, N2O.
Thí dụ:
NH4NO2N2 + 2H2O
NH4NO3N2O + 2H2O
⇒ Những phản ứng này được sử dụng để điều chế các khí N2 và N2O trong phòng thí nghiệm.
Xem thêm các bài tổng hợp lý thuyết Hóa học lớp 11 khác:
Lý thuyết Bài 9: Axit nitric và muối nitrat
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)
