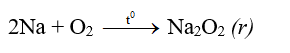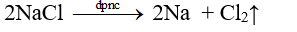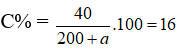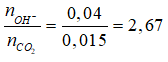Kim loại kiềm là gì? Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Kim loại kiềm
Tổng hợp Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Kim loại kiềm giúp bạn nắm vững kiến thức và học tốt Hóa học.
Kim loại kiềm là gì?
1. Định nghĩa kim loại kiềm
1.1 Vị trí của kim loại kiềm trong bảng tuần hoàn
- Sáu nguyên tố hóa học đứng sau nguyên tố khí hiếm là liti (Li), natri (Na), kali (K), rubiđi (Rb), xesi (Cs), franxi (Fr) được gọi là các kim loại kiềm.
- Các kim loại kiềm thuộc nhóm IA, đứng ở đầu mỗi chu kì (trừ chu kì I).
2.2 Cấu tạo và tính chất của kim loại kiềm
- Cấu hình electron: Kim loại kiềm là những nguyên tố s. Lớp e ngoài cùng của nguyên tử chỉ có 1e, ở phân lớp ns1 (n là số thứ tự chu kì). So với những electron khác trong nguyên tử thì electron ns1 ở xa hạt nhân nguyên tử nhất, do đó dễ tách khỏi nguyên tử. Các cation M+ của kim loại kiềm có cấu hình electron của nguyên tử khí hiếm đứng trước.
- Năng lượng ion hóa: Các nguyên tử kim loại kiềm có năng lượng ion hóa I1 nhỏ nhất so với các kim loại khác cùng chu kì. Do vậy các kim loại kiềm có tính khử rất mạnh:
M → M+ + e
- Năng lượng ion hóa I2 của các nguyên tử kim loại kiềm lớn hơn năng lượng ion hóa I1 nhiều lần (từ 6 đến 14 lần). Vì vậy, trong các phản ứng hóa học nguyến tử kim loại kiềm chỉ nhường 1 electron.
- Trong nhóm kim loại kiềm, năng lượng ion hóa I1 giảm dần từ Li đến Cs.
- Số oxi hóa: Trong các hợp chất, nguyên tố kim loại kiềm chỉ có số oxi hóa +1.
- Thế điện cực chuẩn: Thế điện cực chuẩn của kim loại kiềm rất âm.
2. Tính chất của Kim loại
2.1 Tính chất vật lí
a) Nhiệt độ nóng chảy và nhiệt độ sôi
- Nhiệt độ nóng chảy và nhiệt độ sôi của các kim loại kiềm thấp hơn nhiều so với các kim loại khác. Tính chất này là do liên kết kim loại trong mạng tinh thể kim loại kém bền vững.
b) Khối lượng riêng
- Khối lượng riêng của các kim loại kiềm cũng nhỏ hơn so với các kim loại khác. Khối lượng riêng của các kim loại nhỏ là do nguyên tử của các kim loại kiềm có bán kính lớn và do có cấu tạo mạng tinh thể của chúng kém đặc khít.
c) Tính cứng
- Các kim loại kiềm đều mềm, chúng có thể cắt bằng dao. Tính chất này là do liên kết kim loại trong mạng tinh thể yếu.
2.2 Tính chất hóa học
Các nguyên tử kim loại kiềm đều có năng lượng ion hóa I1 thấp và thế điện cực chuẩn E0 có giá trị rất âm. Vì vậy kim loại kiềm có tính khử rất mạnh.
a) Tác dụng với phi kim
- Hầu hết các kim loại kiềm có thể khử được các phi kim.
- Thí dụ: kim loại Na cháy trong môi trường khí oxi khô tạo ra natri peoxit Na2O2. Trong hợp chất peoxit, oxi có số oxi hóa -1:
b) Tác dụng với axit
- Các kim loại kiềm đều có thể khử dễ dàng ion H+ của dung dịch axit (HCl, H2SO4 loãng) thành khí H2 (phản ứng gây nổ nguy hiểm):
2Li + 2HCl → 2LiCl + H2↑
- Dạng tổng quát:
2M + 2H+ → 2M+ + H2↑
c) Tác dụng với nước
- Kim loại kiềm khử được nước dễ dàng, giải phóng khí hiđro:
2Na + 2H2O → 2NaOH (dd) + H2↑
- Dạng tổng quát:
2M + 2H2O → 2MOH (dd) + H2↑
- Do vậy, các kim loại kiềm được bảo quản bằng cách ngâm chìm trong dầu hỏa.
3. Điều chế Kim loại kiềm.
- Kim loại kiềm dễ bị oxi hóa thành ion dương, do vậy trong tự nhiên kim loại kiềm chỉ tồn tại ở dạng hợp chất.
- Điều chế kim loại kiềm bằng cách khử ion của chúng:
M+ + e → M
- Tuy nhiên, không có chất nào khử được ion kim loại kiềm.
- Phương pháp thường dùng để điều chế kim loại kiềm là điện phân nóng chảy muối halogenua của kim loại kiềm.
- Thí dụ: Điện phân muối NaCl
Phương trình điện phân:
4. Ứng dụng
- Kim loại kiềm có nhiều ứng dụng quan trọng.
- Chế tạo hợp kim có nhiệt độ nóng chảy thấp dùng trong thiếp bị báo cháy,...
- Các kim loại kali, natri dùng làm chất trao đổi nhiệt trong một vài lò phản ứng hạt nhân.
- Kim loại xesi dùng chế tạo tế bào quang điện.
- Kim loại kiềm được dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt luyện.
- Kim loại kiềm được dùng nhiều trong tổng hợp hữu cơ.
5.Một số hợp chất quan trọng của kim loại kiềm
5.1. NaOH (Natri hidroxit)
NaOH hay xút ăn da là chất rắn không màu, dễ nóng chả (nhiệt độ nóng chảy của NaOH là 322 độ), hút ẩm mạnh (dễ chảy rữa), tan nhiều trong nước và tỏa ra một lượng nhiệt lớn. Khi tan, NaOH phân ly hoàn toàn thành ion. NaOH tác dụng được với oxit axit, axit và muối.
NaOH là hóa chất quan trọng, đứng thứ hai chỉ sau H2SO4 (axit sunfuric), ứng dụng trong công nghiệp chế biến xà phòng, chế phẩm nhuộm, tơ nhận tạo, tinh chế quặng nhôm trong công nghiệp luyện nhôm và dùng trong công nghiệp chế biến dầu mỏ ...
5.2. NaHCO3 (Natri hi)drocacbonat
NaHCO3 là chất rắn màu trắng, ít tan trong nước, dễ bị nhiệt phân hủy tạo ra Na2CO3 và khí CO2. NaHCO3 có tính lưỡng tính khi vừa tác dụng được với dung dịch axit, vừa tác dụng được với dung dịch bazơ do dựa theo hai phản ứng của gốc HCO3-:
HCO3- + H+ -> CO2 + H2O
H+ CO3(2-) + OH- -> H2O + CO3(2-)
Nhờ đặc tính này, NaHCO3 được dùng trong công nghiệp dược phẩm như chế thuốc đau dạ dày theo cơ chế khi đi vào trong dạ dày, nó sẽ tác dụng hầu hết với các hợp chất và thức ăn dư thừa tính axit và bazơ là nguyên nhân dẫn đến các cơn đau. Trong công nghiệp thực phẩm, NaHCO3 được gọi là bột nở, được sử dụng nhiều trong quá trình làm bánh do dễ tác dụng H+ trong axit hoặc nước sinh ra khí CO2 đẩy bánh phồng lên. Ngoài ra NaHCO3 cũng có tác dụng tẩy rửa rất tốt nhờ tính chất lưỡng cực của nó.
6. Bài tập liên quan
Bài 1: Để thu được dung dịch NaOH 16% thì cần thêm bao nhiêu gam H2O vào 200 gam dung dịch NaOH 20% ?
Hướng dẫn
Gọi khối lượng nước thêm vào a gam.
Khối lượng NaOH trong 200 gam dung dịch là: 200.20% = 40 gam.
Nồng độ NaOH sau khi thêm nước:
→ a = 50 gam.
Bài 2: Cho 20,7 gam cacbonat của kim loại R hóa trị I tác dụng với một lượng dư dung dịch HCl. Sau phản ứng thu được 22,35 gam muối. Kim loại R là?
Hướng dẫn
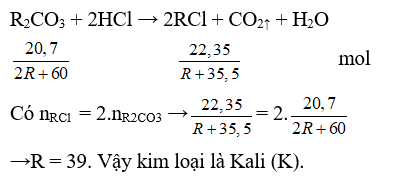
Bài 3: Hấp thụ hoàn toàn 0,336 lít khí CO2 (đktc) vào 200 ml dung dịch gồm NaOH 0,1M và KOH 0,1M thu được dung dịch X. Cô cạn toàn bộ dung dịch X thu được bao nhiêu gam chất rắn khan?
Hướng dẫn
nkhí = 0,015 mol, nNaOH = 0,02 mol, nKOH = 0,02 mol, nOH- = 0,04 mol
Có
Sau phản ứng chỉ thu được muối trung hòa, kiềm dư.
Bảo toàn C có
Số mol OH- dư = 0,04 – 2.0,015 = 0,01 mol
mx = mion = mNa+ + mK+ + mCO32- + mOH-
→ mX = 0,02.23 + 0,02.39 + 0,015.60 + 0,01.17 = 2,31 gam.
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)