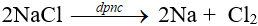Kim loại kiềm là gì? Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của kim loại kiềm
Tổng hợp Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Kim loại kiềm giúp bạn nắm vững kiến thức và học tốt Hóa học.
Kim loại kiềm
I. Ví trí, cấu tạo
1. Vị trí của kim loại kiềm trong bảng tuần hoàn
- Các kim loại kiềm gồm Li, Na, K, Rb, Cs, Fr.
- Các kim loại kiềm đứng đầu mỗi chu kì (trừ chu kì 1).
2. Cấu tạo
- Cấu hình electron nguyên tử: ns1.
- Các kim loại kiềm có năng lượng ion hóa I1 nhỏ nhất so với các kim loại khác. Từ Li đến Fr, I1 giảm dần.
- Cấu tạo đơn chất: các đơn chất nhóm IA đều có cấu tạo mạng lập phương tâm khối.
II. Tính chất vật lý
- Liên kết kim loại yếu
- Là những kim loại rất nhẹ và mềm, dẫn điện và dẫn nhiệt tốt.
- Nhiệt độ nóng chảy và nhiệt độ sôi thấp, giảm từ Li đến Fr.
- Độ cứng nhỏ
III. Tính chất hóa học
- Các kim loại kiềm có tính khử mạnh: M → M+ + 1e.
- Trong mọi hợp chất, kim loại kiềm có số oxi hóa +1.
1. Tác dụng với phi kim: O2, halogen, S,...
Chú ý:
- Tác dụng với oxi khô tạo peoxit: 2Na + O2 → Na2O2 (r)
- Tác dụng với oxi không khí khô ở nhiệt độ phòng tạo Na2O.
2. Tác dụng với axit: 2M + 2H+ → 2M+ + H2
Na + HCl → NaCl + 1/2 H2↑
Na dư + H2O → NaOH + 1/2 H2↑
3. Tác dụng với nước: 2M + 2H2O → 2MOH(dd) + H2
Na + H2O → NaOH + 1/2 H2
4. Tác dụng với dd muối
Khi cho Na tác dụng với dd muối CuSO4 sẽ có bọt khí và kết tủa Cu(OH)2 màu xanh.
2Na + 2H2O → 2NaOH + H2↑
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2↓
Chú ý: Khi cho kim loại kiềm vào dung dịch muối, đầu tiên kim loại kiềm sẽ tác dụng với nước sau đó bazo sinh ra có thể tác dụng với muối.
IV. Ứng dụng, điều chế
1. Ứng dụng:
- Chế tạo hợp kim có nhiệt độ nóng chảy thấp dùng trong thiết bị báo cháy.
- K, Na dùng làm chất trao đổi nhiệt trong các lò phản ứng hạt nhân.
- Cs dùng chế tạo tế bào quang điện.
- Dùng để điều chế một số kim loại quí hiếm bằng phương pháp nhiệt luyện.
- Dùng làm xúc tác trong nhiều phản ứng hữu cơ.
2. Điều chế:
Điện phân nóng chảy muối halogenua hoặc hiđroxit của kim loại kiềm trong điều kiện không có không khí.
Ví dụ:
Xem thêm các phần Lý thuyết Hóa học lớp 12 khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)