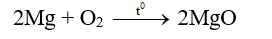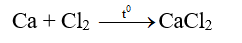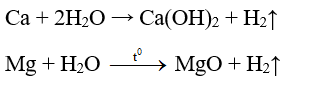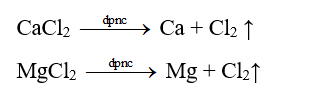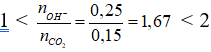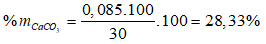Kim loại kiềm thổ là gì? Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Kim loại kiềm thổ
Tổng hợp Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Kim loại kiềm thổ giúp bạn nắm vững kiến thức và học tốt Hóa học.
Kim loại kiềm thổ là gì?
1. Định nghĩa về kim loại kiềm thổ
1.1 Vị trí của kim loại kiềm thổ trong bảng tuần hoàn
- Kim loại kiềm thổ thuộc nhóm IIA của bảng tuần hoàn, gồm các nguyên tố beri (Be), magie (Mg), canxi (Ca), stronti (Sr), bari (Ba) và rađi (Ra). Trong mỗi chu kì, nguyên tố kim loại kiềm thổ đứng sau nguyên tố kim loại kiềm.
1.2 Cấu tạo và tính chất của kim loại kiềm thổ
- Cấu hình electron: Kim loại kiềm thổ là những nguyên tố s. Lớp ngoài cùng của nguyên tử có 2e ở phân lớp ns2. So với những electron khác trong nguyên tử thì hai eletron ns2 ở xa hạt nhân hơn cả, chúng dễ tách khỏi nguyên tử.
- Các cation M2+ của kim loại kiềm thổ có cấu hình electron của nguyên tử khí hiếm đứng trước nó trong bảng tuần hoàn.
- Số oxi hóa: Các kim loại kiềm thổ có điện tích duy nhất là 2+. Vì vậy, trong các hợp chất, nguyên tố kim loại kiềm thổ có số oxi hóa là +2.
- Thế điện cực chuẩn: Các cặp oxi hóa – khử M2+/M của kim loại kiềm thổ đều có thế điện cực chuẩn rất âm.
2. Tính chất kim loại kiềm thổ
2.1 Tính chất vật lí
- Nhiệt độ nóng chảy và nhiệt độ sôi tương đối thấp (trừ beri )
- Độ cứng tuy có cao hơn kim loại kiềm, nhưng nhìn chung kim loại kiềm thổ có độ cứng thấp.
- Khối lượng riêng tương đối nhỏ, chúng là những kim loại nhẹ hơn nhôm (trừ bari ).
2.2 Tính chất hóa học
a) Tác dụng với phi kim
- Khi đối nóng, các kim loại kiềm thổ đều bốc cháy trong không khí tạo ra oxit.
- Tác dụng với halogen tạo muối halogen.
b) Tác dụng với axit
- Các kim loại kiềm thổ đều khử được H+ trong các dung dịch axit (H2SO4 loãng, HCl) thành khí hiđro.
Ca + HCl → CaCl2 + H2↑
c) Tác dụng với nước
- Ca, Sr, Ba tác dụng với nước ở nhiệt độ thường tạo thành dung dịch bazơ. Mg tác dụng chậm với nước ở nhiệt độ thường tạo ra Mg(OH)2, tác dụng nhanh với hơi nước ở nhiệt độ cao tạo thành MgO. Be không tác dụng với nước dù ở nhiệt độ cao.
3. Điều chế kim loại
- Trong tự nhiên, kim loại kiềm thổ chỉ tồn tại dưới dạng ion M2+ trong các hợp chất. Phương pháp cơ bản điều chế kim loại kiềm thổ là điện phân muối nóng chảy của chúng.
4. Ứng dụng
- Kim loại Be được dùng làm chất phụ gia để chế tạo những hợp kim có tính đàn hồi cao, bền chắc, không bị ăn mòn.
- Kim loại Mg có nhiều ứng dụng hơn cả, được dùng để chế tạo những hợp kim có đặc tính cứng, nhẹ, bền. Những hợp kim này được dùng để chế tạo máy bay, tên lửa, ôtô ,... Kim loại Mg còn được dùng để tổng hợp nhiều hợp chất hữu cơ. Bột Mg trộn với chất oxi hóa dùng để chế tạo chất chiếu sáng ban đêm.
- Kim loại Ca dùng làm chất khử để tách oxi, lưu huỳnh ra khỏi thép. Canxi còn được dùng để làm khô một số hợp chất hữu cơ.
5. Một số hợp chất của Canxi
5.1 Canxi Hidroxit Ca(OH)2
- Tính chất vật lý: là chất rắn màu trắng, ít tan trong nước
- Tính chất hóa học: Mang đầy đủ tính chất của một dung dịch kiềm (tác dụng với axit, oxit axit, muối)
5.2 Canxi Cacbonat CaCO3
- Tính chất vật lý: chất rắn màu trắng, không tan trong nước
- Tính chất hóa học : đây là muối của axit yếu, không bền nên tác dụng được với nhiều axit vô cơ, giải phóng khí cacbonic :
CaCO3 + 2HCl → CaCl2 + H2O + CO2
CaCO3 + 2CH3COOH → Ca(CH3COO)2 + H2O + CO2
+ Canxi cacbonat tan dần trong nước có chứa khí cacbon dioxit, tạo ra muối tan là canxi hidrocacbonat (Ca(HCO3)2):
CaCO3 + H2O + CO2 Ca(HCO3)2
=> Phản ứng thuận: Giải thích sự xâm thực của nước mưa đối với đá vôi
+ Phản ứng nghịch: Giải thích sự hình thành thạch nhũ có trong hang động.
5.3 Canxi Sunfat CaSO4
Tính chất:
- Canxi sunfat là chất rắn, màu trắng, tan ít trong nước (độ tan ở 25oC là 0,15 g/100 gam H2O).
- Tuỳ theo lượng nước kết tinh trong muối canxi sunfat, ta có 3 loại :
+ CaSO4.2H2O có trong tự nhiên là thạch cao sống, bền ở nhiệt độ thường.
+ CaSO4.2H2O hoặc CaSO4.0,5H2Olà thạch cao nung
+ CaSO4 có tên là thạch cao khan: không tan và không tác dụng với nước.
5.4 Nước cứng
- Định nghĩa: Nước cứng là nước có chứa nhiều cation Ca2+, Mg2+. Nước chứa ít hoặc không chứa các ion trên được gọi là nước mềm.
- Phân loại:
+ Nước cứng tạm thời:là nước có chứa các ion: Ca2+, Mg2+, HCO3-
+ Nước cứng vĩnh cửu: là nước có chứa các ion: Ca2+, Mg2+, SO42-, Cl-
+ Nước cứng toàn phần: là nước có cả tính cứng tạm thời và tính cứng vĩnh cửu
=> Nước tự nhiên thường là nước cứng toàn phần.
- Tác hại của nước cứng:
+ Làm giảm bọt, giảm khả năng tẩy rửa của xà phòng, khiến thức ăn lâu chín và giảm mùi vị.
+ Nước cứng cũng gây tác hại cho các ngành sản xuất, làm hỏng nhiều dung dịch cần pha chế.
- Biện pháp làm mềm nước cứng
+ Nguyên tắc : Làm giảm nồng độ các cation Ca2+, Mg2+ trong nước cứng.
- Phương pháp kết tủa
+ Nước cứng tạm thời : Đun sôi
Ca(HCO3)2 CaCO3¯ + CO2 + H2O
Mg(HCO3)2 MgCO3¯ + CO2 + H2O
+ Nước cứng vĩnh cửu:Dùng dung dịch Na2CO3, Na3PO4.
Ca2+ + → CaCO3 ¯
3Ca2+ + → Ca3(PO4)2 ¯
- Phương pháp trao đổi ion
5.5 Nhận biết ion Ca2+, Mg2+ trong dung dịch.
Để chứng minh sự có mặt của ion Ca2+, Mg2+ ta dùng dung dịch chứa muối cacbonat để tạo ra kết tủa CaCO3 hoặc MgCO3. Sau đó sục khí CO2 dư vào dung dịch, nếu kết tủa tan chứng tỏ có mặt của Ca2+ hoặc Mg2+ trong dung dịch ban đầu
6. Bài tập liên quan
Bài 1: Hấp thụ hoàn toàn 3,36 lít CO2 (đktc) vào 125ml dd Ba(OH)2 1M, thu được dung dịch X. Coi thể tích dung dịch không thay đổi, nồng độ mol chất tan trong dung dịch X là?
Hướng dẫn
nkhí = 0,15 mol; nOH- = 0,25 mol
Có
→ Sau phản ứng thu được hai muối BaCO3 x mol; Ba(HCO3)2 y mol.
Bảo toàn Ba → x + y = 0,125
Bảo toàn C → x + 2y = 0,15
Giải hệ được x = 0,1 và y = 0,025.
Chất tan trong dung dịch X là Ba(HCO3)2 0,025 mol
→ CM = 0,025 : 0,125 = 0,2M.
Bài 2: Khi nung 30g hỗn hợp CaCO3 và MgCO3 thì khối lượng chất rắn thu được sau phản ứng chỉ bằng một nửa khối lượng ban đầu. Thành phần % theo khối lượng các chất ban đầu là bao nhiêu?
Hướng dẫn
Gọi số mol CaCO3 và MgCO3 trong hỗn hợp lần lượt là x và y mol
→ 100x + 84y = 30
Phương trình hóa học:
CaCO3 (x) → CaO (x) + CO2 (x mol)
MgCO3 (y) → MgO (y) + CO2 (y mol)
Áp dụng định luật bảo toàn khối lượng:
mhh trước = mcr sau + mkhí → mkhí = 30 – 15 = 15 gam.
→ nkhí = 15/44 → x + y = 15/44.
Giải hệ có x = 0,085 và y = 0,226
Bài 3: Dẫn V lít CO2 (đktc) vào 2 lít dung dịch Ca(OH)2 0,1M thì được 10 gam kết tủa. Giá trị của V là bao nhiêu?
Hướng dẫn
nCa(OH)2 = 0,2 mol > n↓ = 0,1 mol
Trường hợp 1: Ca(OH)2 dư
CO2 (0,1) + Ca(OH)2 → CaCO3↓ (0,1 mol) + H2O
V = 0,1.22,4 = 2,24 lít.
Trường hợp 2: Sau phản ứng thu được CaCO3 0,1 mol và Ca(HCO3)2 y mol
Bảo toàn Ca → y = 0,2 – 0,1 = 0,1 mol
Bảo toàn C → nkhí = 2.y + n↓ = 2.0,1 + 0,1 = 0,3 mol
→ V = 0,3.22,4 = 6,72 lít.
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2024) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2024)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2024)