Natri (Na) là gì? Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Na
Tổng hợp Tính chất hóa học, tính chất vật lí, nhận biết, điều chế, ứng dụng của Natri (Na) giúp bạn nắm vững kiến thức và học tốt Hóa học.
Natri (Na) là gì?
1. Định nghĩa
- Natri là nguyên tố phổ biến nhất thứ 6 trong vỏ Trái Đất, và có mặt trong nhiều loại khoáng vật như felspat, sodalit và đá muối.
- Kí hiệu: Na
- Cấu hình electron: 1s22s22p63s1 hay [Ne]3s1
- Số hiệu nguyên tử: 11
- Khối lượng nguyên tử: 23 g/mol
- Vị trí trong bảng tuần hoàn
+ Ô: 11
+ Nhóm: IA
+ Chu kì: 3
- Đồng vị: 22Na, 23Na.
- Độ âm điện: 0,93.
2. Tính chất của Natri (Na)
2.1. Tính chât vật lí & nhận biết
- Kim loại kiềm màu trắng – bạc, nhẹ, rất mềm, dễ nóng chảy.
- Có khối lượng riêng là 0,968 g/cm3; có nhiệt độ nóng chảy là 97,830C và sôi ở 8860C.
- Nhận biết: Đốt cháy các hợp chất của Natri sẽ cho ngọn lửa có màu vàng.
2.2 Tính chất hóa học
- Natri có tính khử rất mạnh: Na → Na+ + 1e
a. Tác dụng với phi kim
4Na + O2 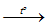
2Na + Cl2 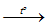
- Khi đốt trong không khí hay trong oxi, Na cháy tạo thành các oxit (oxit thường, peoxit và supeoxit) và cho ngọn lửa có màu vàng đặc trưng.
b. Tác dụng với axit
- Natri dễ dàng khử ion H+ trong dung dịch axit loãng (HCl, H2SO4 loãng...) thành hidro tự do.
2Na + 2HCl → 2NaCl + H2.
2Na + H2SO4 → Na2SO4 + H2.
c. Tác dụng với nước
- Natri đều tác dụng mãnh liệt với nước tạo thành dung dịch kiềm và giải phóng khí hidro.
2Na + 2H2O → 2NaOH + H2.
d. Tác dụng với hidro
- Natri tác dụng với hidro ở áp suất khá lớn và nhiệt độ khoảng 350 – 400oC tạo thành natri hidrua.
2Na (lỏng) + H2 (khí) 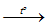
3. Trạng thái tự nhiên
- Trong tự nhiên, Na có 13 đồng vị của natri đã được biết đến. Đồng vị ổn định duy nhất là 23Na.
- Natri chiếm khoảng 2,6% theo khối lượng của vỏ Trái Đất, làm nó trở thành nguyên tố phổ biến thứ tám nói chung và là kim loại kiềm phổ biến nhất.
4. Điều chế
- Điện phân muối halogenua hay hidroxit nóng chảy.
2NaCl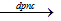
5. Ứng dụng
- Natri là thành phần quan trọng trong sản xuất este và các hợp chất hữu cơ. Kim loại kiềm này là thành phần của clorua natri (NaCl) (muối ăn) là một chất quan trọng cho sự sống.
Các ứng dụng khác:
• Trong một số hợp kim để cải thiện cấu trúc của chúng.
• Trong xà phòng (trong hợp chất với các axít béo).
• Để làm trơn bề mặt kim loại.
• Để làm tinh khiết kim loại nóng chảy.
• Trong các đèn hơi natri, một thiết bị cung cấp ánh sáng từ điện năng có hiệu quả.
• Như là một chất lỏng dẫn nhiệt trong một số loại lò phản ứng nguyên tử.
6. Các hợp chất quan trọng của Natri
- Natri hidroxit: NaOH
- Natri hiđrocacbonat: NaHCO3
- Natri cacbonat: Na2CO3
7. Bài tập liên quan
Bài 1: Có 3 lọ không nhãn, mỗi lọ đựng một chất rắn sau: NaOH, Ba(OH)2, NaCl. Hãy trình bày cách nhận biết chất đựng trong mỗi lọ bằng phương pháp hóa học. Viết các phương trình hóa học nếu có.
Hướng dẫn
Lấy mẫu thử từng chất và đánh số thứ tưh. Hòa tan các mẫu thử và H2o rồi thử các dụng dịch:
+ Dùng quỳ tím cho vào từng chất thử:
- Mẫu nào làm quỳ tím hóa xanh đó là NaOH và Ba(OH)2.
- Còn lại là NaCl không có hiện tượng
+ Cho H2SO4 vào các mẫu thử NaOH và Ba(OH)2
- Mẫu nào có kết tủa trắng đó là sản phẩm Ba(OH)2
PTHH: Ba(OH)2+ H2SO4 --> BaSO4 + 2H2O
- Còn lại là NaOH
Bài 2: Hòa tan mg hỗn hợp Na và Al vào nước thu được 8,96 lit khí hidro (đktc) và 1,35g chất rắn không tan. Tính khối lượng m?
Hướng dẫn
Còn chất rắn chưa tan à Al chưa tan hết
Phương trình hóa học
2Na + 2H2O → 2NaOH + H2
x x/2
2NaOH + 2Al + 2H2O → NaAlO2 + 3H2
x x 3x/2
số mol H2 = x/2 + 3x/2 = 0,4 à x = 0,2 mol
khối lượng m là: m = 23. 0,2 + 27. 0,2 + 1,35 = 11,35g
Bài 3: Cho 4,41 gam hỗn hợp 3 muối: K2CO3; Na2CO3 và BaCO3 tác dụng vừa đủ với dung dịch HCl. Cô cạn dung dịch sau phản ứng thu được 4,74 gam muối khan.Thể tích khí CO2 sinh ra là bao nhiêu?
Hướng dẫn
CO32- + 2H+ → H2O + CO2↑
x 2x
mmuối cacbonat = mKL + mcacbonat = mKL + 60*x = 4,41 (1)
mmuối clorua = mKL + mclorua = mKL + 35,5*2x = 4,74 (2)
=> (2)-(1) = 11x = 0,33
=> x= 0,03 mol
=> VCO2 = 0,672 lít
Bài 3: Hòa tan hoàn toàn 7,3 gam hỗn hợp X gồm Na và Al bằng nước thu được 0,25 mol H2. Số mol Na trong X là bao nhiêu?
Hướng dẫn
Nếu số mol của Al = số mol của Na → số mol Na = số mol Al = 0,125 mol
→ m = 0,125.27 + 0,125.23 = 6,25 < 7. Như vậy, Al tan hết và NaOH dư
2Na + 2H2O → 2NaOH + H2
x x/2
2NaOH + 2Al + 2H2O →NaAlO2 + 3H2
y y 3y/2
→ số mol H2 = x/2 + 3y/2 = 0,25 (1)
23x + 27y = 7,3 (2)
Giải hệ (1) và (2) x = 0,2 mol và y = 0,1 mol
→ số mol Na = 0,2 mol
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
