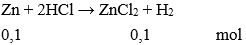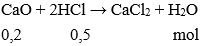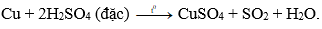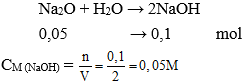TOP 40 câu Trắc nghiệm Luyện tập chương 1: Các hợp chất vô cơ (có đáp án 2024) - Hóa học 9
Bộ 40 bài tập trắc nghiệm Hóa học lớp 9 Bài 13: Luyện tập chương 1: Các hợp chất vô cơ có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 9.
Trắc nghiệm Hóa học 9 Bài 13: Luyện tập chương 1: Các hợp chất vô cơ
Bài giảng Hóa học 9 Bài 13: Luyện tập chương 1: Các hợp chất vô cơ
Câu 1: Công thức hoá học của sắt(II) oxit là
A. Fe2O3
B. Fe3O4
C. Fe3O2
D. FeO
Đáp án: D
Giải thích: Công thức hoá học của sắt (II) oxit là FeO.
Câu 2: Dãy chất nào sau đây là oxit lưỡng tính?
A. Al2O3, ZnO, Cr2O3
B. Al2O3, MgO, PbO
C. CaO, ZnO, Na2O
D. PbO2, Al2O3, K2O
Đáp án: A
Giải thích:
Oxit lưỡng tính là oxit vừa tác dụng dung dịch axit, vừa tác dụng với dung dịch bazơ.
Dãy chất là oxit lưỡng tính là Al2O3, ZnO, Cr2O3
Câu 3: Hòa tan hoàn toàn 8,1 gam một oxit kim loại hóa trị II cần vừa đủ 0,2 mol axit HCl. Oxit đó là
A. MgO
B. FeO
C. CuO
D. ZnO
Đáp án: D
Giải thích:
Gọi công thức của oxit là MO
Phương trình phản ứng:
MO+2HCl→MCl2+H2O0,1
Số mol của MO là:
nMO = 0,1 mol
MMO = = 81 g/mol
Suy ra MM + MO = 81
MM = 81 – MO
MM = 81 – 16 = 65 g/mol
Suy ra M là Zn
Vậy công thức oxit là ZnO
Câu 4: Vôi sống có công thức hóa học là
A. CaO
B. Ca
C. Ca(OH)2
D. CaCO3
Đáp án: A
Giải thích: Vôi sống có công thức hóa học là CaO.
Câu 5: Cho 11,2 gam kim loại sắt tác dụng vừa đủ với dung dịch axit sunfuric loãng. Thể tích khí hiđro thu được ở đktc là
A. 2,24 lít
B. 4,48 lít
C. 5,60 lít
D. 6,05 lít
Đáp án: B
Giải thích:
Số mol Fe là:
nFe = 0,2 mol
Phương trình phản ứng:
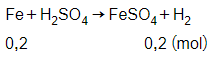
Theo phương trình phản ứng ta có:
= 0,2 mol
Thể tích khí hiđro thu được ở đktc là:
= 0,2.22,4 = 4,48 lít.
Câu 6: Phương trình hóa học nào sau đây đúng?
A. K2O + H2O → KOH
B. KOH + CO2 → K2CO3 + H2O
C. K2CO3 + H2SO4 → K2SO4 + CO2 + H2O
D. K2SO4 + BaCl2 → BaSO4 + KCl
Đáp án: C
Giải thích:
Phương trình hóa học đúng là:
K2CO3 + H2SO4 → K2SO4 + CO2 + H2O
Các phản ứng A, B, D đều chưa cân bằng.
Câu 7: Hòa tan hết CaCO3 cần vừa đủ 100 ml dung dịch HCl 2M, sau phản ứng thu được khối lượng muối là
A. 8,6 gam
B. 9,8 gam
C. 10,2 gam
D. 11,1 gam
Đáp án: D
Giải thích:
Số mol HCl là:
nHCl = 0,2 mol
Phương trình phản ứng:
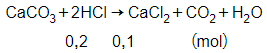
Theo phương trình phản ứng ta có:
= 0,1 mol
Khối lượng CaCl2 là:
= 0,1.111 = 11,1 gam.
Câu 8: Dung dịch Ca(OH)2 không có tính chất hoá học nào sau đây?
A. Làm đổi màu quỳ tím
B. Tác dụng với oxit axit tạo thành muối và nước
C. Bị nhiệt phân hủy khi đun nóng tạo thành oxit bazơ và nước
D. Tác dụng với axit tạo thành muối và nước
Đáp án: C
Giải thích:
Dung dịch Ca(OH)2 không có tính chất: bị nhiệt phân hủy khi đun nóng tạo thành oxit bazơ và nước
Vì dung dịch Ca(OH)2 là bazơ tan.
Câu 9: Để có được dung dịch KCl 40%, thì khối lượng KCl cần lấy hoà tan vào 150 gam nước là
A. 100 gam
B. 150 gam
C. 200 gam
D. 90 gam
Đáp án: A
Giải thích:
Ta có:
Suy ra 0,6mKCl = 60
Vậy mKCl = 100 gam
Câu 10: Diêm tiêu kali được dùng để chế tạo thuốc nổ đen, đồng thời được dùng làm phân bón. Công thức hóa học của diêm tiêu kali là
A. KNO3
B. KCl
C. K2CO3
D. K2SO4
Đáp án: A
Giải thích: Diêm tiêu kali được dùng để chế tạo thuốc nổ đen, đồng thời được dùng làm phân bón. Công thức hóa học của diêm tiêu kali là KNO3.
Câu 11: Phương trình hóa học nào sau đây đúng?
A. CaCO3 + HCl → CaCl2 + CO + H2O
B. CaCO3 + HCl → CaO + Cl2 + H2O
C. CaCO3 + HCl → Ca(OH)2 + CO2 + HCl
D. CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Đáp án: D
Giải thích:
Phương trình hóa học viết đúng là:
CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Câu 12: Thả một mảnh nhôm vào ống nghiệm chứa dung dịch CuSO4. Xảy ra hiện tượng
A. Có chất khí bay ra, dung dịch không đổi màu
B. Không có dấu hiệu phản ứng
C. Có chất rắn màu trắng bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần
D. Có chất rắn màu đỏ bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần
Đáp án: D
Giải thích:
Nhôm đứng trước đồng trong dãy điện hóa do đó sẽ đẩy đồng ra khỏi muối
Phương trình phản ứng:
3CuSO4 + 2Al → 3Cu + Al2(SO4)3
Hiện tượng: Có chất rắn màu đỏ bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
Câu 13: Dãy bazơ nào sau đây gồm các bazơ không tan?
A. NaOH, KOH, Cu(OH)2
B. Ca(OH)2, Mg(OH)2, Ba(OH)2
C. Mg(OH)2, Fe(OH)3, Al(OH)3
D. Al(OH)3, KOH, Zn(OH)2
Đáp án: C
Giải thích:
Dãy gồm các bazơ không tan là:
Mg(OH)2, Fe(OH)3, Al(OH)3
Câu 14: Cho 0,3 mol CuCl2 phản ứng với một dung dịch có hòa tan 32 gam NaOH, thu được m gam kết tủa. Giá trị của m là
A. 26,7 gam
B. 27,9 gam
C. 28,6 gam
D. 29,4 gam
Đáp án: D
Giải thích:
Số mol NaOH là:
nNaOH = 0,8 mol
Phương trình phản ứng:
CuCl2 + 2NaOH → Cu(OH)2 + 2NaCl
Xét
CuCl2 phản ứng hết, NaOH dư.
Theo phương trình phản ứng ta có:
= 0,3 mol
Vậy khối lượng Cu(OH)2 là:
= 0,3.98 = 29,4 gam.
Câu 15: Để một mẫu natri hidroxit trên tấm kính trong không khí, sau vài ngày thấy có chất rắn màu trắng phủ ngoài. Nếu nhỏ vài giọt dung dịch HCl vào chất rắn trắng thấy có chất khí thoát ra, khí này làm đục nước vôi trong. Chất rắng màu trắng là sản phẩm phản ứng natri hidroxit với
A. Cacbon đioxit trong không khí
B. Oxi trong không khí
C. Hơi nước trong không khí
D. Cacbon đioxit và oxi trong không khí
Đáp án: A
Giải thích:
Phương trình phản ứng:
2NaOH + CO2 → Na2CO3 + H2O
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Câu 16: Có 3 lọ mất nhãn đựng riêng biệt 3 dung dịch của 3 chất: HCl, Na2SO4, NaOH . Chỉ dùng một hóa chất nào sau đây để phân biệt chúng ?
A. Dung dịch BaCl2
B. Quỳ tím
C. Dung dịch Ba(OH)2
D. Zn
Đáp án: B
Giải thích:
Sử dụng quỳ tím:
+ Quỳ tím chuyển sang màu đỏ → HCl
+ Quỳ tím chuyển sang màu xanh → NaOH
+ Quỳ tím không chuyển màu → Na2SO4.
Câu 17: Khi cho từ từ dung dịch NaOH cho đến dư vào ống nghiệm đựng dung dịch hỗn hợp gồm HCl và một ít phenolphtalein. Hiện tượng quan sát được trong ống nghiệm là:
A. Màu đỏ mất dần.
B. Không có sự thay đổi màu
C. Màu đỏ từ từ xuất hiện.
D. Màu xanh từ từ xuất hiện.
Đáp án: C
Giải thích:
Trong dung dịch sau phản ứng có NaOH dư làm cho phenolphtalein chuyển sang màu đỏ.
Câu 18: Cho 0,1mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
A. 13,6 g
B. 1,36 g
C. 20,4 g
D. 27,2 g
Đáp án: A
Giải thích:
→ mmuối = 0,1.(65 + 35,5.2) = 13,6 gam.
Câu 19: Cho 0,2 mol Canxi oxit tác dụng với 500ml dung dịch HCl 1M. Khối lượng muối thu được là:
A. 2,22 g
B. 22,2 g
C. 23,2 g
D. 22,3 g
Đáp án: B
Giải thích:
nHCl = 0,5.1 = 0,5 mol
Có 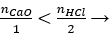
mmuối = 0,2. (40 + 71) = 22,2 gam.
Câu 20: Dung dịch axit clohiđric tác dụng với sắt tạo thành:
A. Sắt (II) clorua và khí hiđrô.
B. Sắt (III) clorua và khí hiđrô.
C. Sắt (II) Sunfua và khí hiđrô.
D. Sắt (II) clorua và nước.
Đáp án: A
Giải thích:
Fe + 2HCl → FeCl2 + H2
Câu 21: Dung dịch muối tác dụng với dung dịch axit clohiđric là:
A. Zn(NO3)2
B. NaNO3.
C. AgNO3.
D. Cu(NO3)2.
Đáp án: C
Giải thích:
AgNO3 + HCl → AgCl ↓ + HNO3
Câu 22: Axit sunfuric đặc nóng tác dụng với đồng kim loại sinh ra khí:
A. CO2.
B. SO2.
C. SO3.
D. H2S.
Đáp án: B
Giải thích:
Câu 23: Dãy các kim loại đều tác dụng với dung dịch axit clohiđric:
A. Al, Cu, Zn, Fe.
B. Al, Fe, Mg, Ag.
C. Al, Fe, Mg, Cu.
D. Al, Fe, Mg, Zn.
Đáp án: D
Giải thích:
Cu và Ag không tác dụng với axit HCl.
Câu 24: Thuốc thử để nhận biết dung dịch Ca(OH)2 là
A. K2CO3
B. KCl
C. KOH
D. KNO3
Đáp án: A
Giải thích:
Ca(OH)2 + K2CO3 → CaCO3 ↓ + 2KOH
Câu 25: Hòa tan 3,1 gam Na2O vào nước được 2 lít dung dịch. Nồng độ mol của dung dịch thu được là:
A. 0,05 M
B. 0,1 M
C. 0,3M
D. 0,4M
Đáp án: A
Giải thích:
Số mol Na2O = 3,1 : 62 = 0,05 mol
Các câu hỏi trắc nghiệm Hóa học lớp 9 có đáp án, chọn lọc khác:
Trắc nghiệm Tính chất vật lí của kim loại có đáp án
Trắc nghiệm Tính chất hóa học của kim loại có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
- Trắc nghiệm Toán lớp 12 có đáp án
- Trắc nghiệm Sinh học lớp 12 có đáp án
- Trắc nghiệm Hóa học lớp 12 có đáp án
- Trắc nghiệm Ngữ văn lớp 12 có đáp án
- Trắc nghiệm Tiếng Anh lớp 12 có đáp án
- Trắc nghiệm Địa lí lớp 12 có đáp án
- Trắc nghiệm Vật Lí lớp 12 có đáp án
- Trắc nghiệm Công nghệ lớp 12 có đáp án
- Trắc nghiệm Giáo dục công dân lớp 12 có đáp án
- Trắc nghiệm Lịch sử lớp 12 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 12 có đáp án