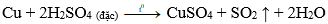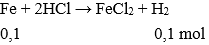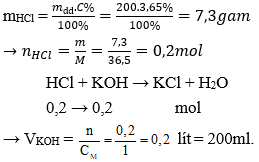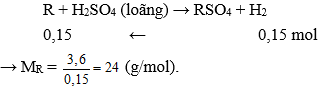TOP 40 câu Trắc nghiệm Một số axit quan trọng (có đáp án 2024) – Hóa học 9
Bộ 40 bài tập trắc nghiệm Hóa học lớp 9 Bài 4: Một số axit quan trọng có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 9.
Trắc nghiệm Hóa học 9 Bài 4: Một số axit quan trọng
Bài giảng Hóa học 9 Bài 4: Một số axit quan trọng (Phần A: Axit Clohidric)
Bài giảng Hóa học 9 Bài 4: Một số axit quan trọng (Phần B: Axit Sunfuric)
Câu 1: Chất nào dưới đây không dùng để phân biệt dung dịch Na2SO4 và dung dịch H2SO4 loãng?
A. MgO
B. Mg(OH)2
C. Mg
D. Cu
Đáp án: D
Giải thích:
Chất không dùng để phân biệt dung dịch Na2SO4 và dung dịch H2SO4 loãng là Cu.
Vì Cu không phản ứng với dung dịch Na2SO4 và dung dịch H2SO4 loãng.
Câu 2: Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách:
A. Cho cả nước và axit vào cùng một lúc
B. Rót từng giọt nước vào axit
C. Rót từ từ axit vào nước và khuấy đều
D. Cả 3 cách trên đều được
Đáp án: C
Giải thích: Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách: rót từ từ axit vào nước và khuấy đều bằng đũa thủy tinh.
Câu 3: Để hòa tan vừa hết 6,72 gam sắt phải dùng bao nhiêu ml hỗn hợp dung dịch HCl 0,2M và H2SO4 0,5M?
A. 100 ml
B. 150 ml
C. 250 ml
D. 200 ml
Đáp án: D
Giải thích:
Số mol của Fe là:
nFe = 0,12 mol
Gọi thể tích dung dịch hỗn hợp axit cần dùng là V (lít)
Số mol của HCl là:
nHCl = 0,2V (mol)
Số mol của H2SO4 là:
nH2SO4nH2SO4= 0,5V (mol)
Phương trình phản ứng:
Fe+2HCl→FeCl2+H20,1V 0,2V (mol)Fe+H2SO4→FeSO4+H20,5V 0,5V (mol)
Suy ra số mol của Fe là:
nFe = 0,1V + 0,5V = 0,6V = 0,12 mol
Suy ra V = 0,2 lít = 200 ml.
Câu 4: Kim loại nào sau đây không tác dụng với dung dịch axit H2SO4 loãng?
A. K
B. Mg
C. Zn
D. Ag
Đáp án: D
Giải thích:
K, Mg, Zn đều tác dụng với dung dịch axit H2SO4 loãng.
Ag đứng sau H trong dãy hoạt động hóa học nên không tác dụng với dung dịch axit H2SO4 loãng.
Câu 5: Ứng dụng của axit clohidric được dùng để
A. Điều chế các muối clorua
B. Làm sạch bề mặt kim loại trước khi hàn
C. Chế biến thực phẩm, dược phẩm
D. A, B, C đều đúng
Đáp án: D
Giải thích:
Ứng dụng của axit clohidric được dùng để
+ Điều chế các muối clorua
+ Làm sạch bề mặt kim loại trước khi hàn
+ Chế biến thực phẩm, dược phẩm.
Câu 6: Cho 8,1 gam kẽm oxit tác dụng vừa đủ với dung dịch axit HCl, sau phản ứng thu được m gam muối. Giá trị của m là
A. 12,6 gam
B. 13,6 gam
C. 14,6 gam
D. 15,6 gam
Đáp án: B
Giải thích:
Số mol của ZnO là:
nZnO = 8,181 = 0,1 mol
Phương trình phản ứng:
ZnO+2HCl→ZnCl2+H2O0,1 0,1 (mol)
Theo phương trình phản ứng ta có
nZnCl2 = 0,1 mol
Vậy khối lượng của ZnCl2 cần tìm là:
m = 0,1.136 = 13,6 gam.
Câu 7: Chất nào sau đây khi tác dụng với H2SO4 loãng sinh ra dung dịch có màu xanh lam?
A. Zn
B. CaO
C. K2O
D. CuO
Đáp án: D
Giải thích:
CuO khi tác dụng với H2SO4 loãng sinh ra dung dịch có màu xanh lam (CuSO4)
Phương trình phản ứng:
CuO + H2SO4 → CuSO4 + H2O
Câu 8: Cho 1,08 gam nhôm tác dụng với axit clohidric dư, sau phản ứng thu được V lít khí H2 ở đktc. Giá trị của V là
A. 2,224 lít
B. 1,344 lít
C. 3,336 lít
D. 4,448 lít
Đáp án: B
Giải thích:
Số mol của nhôm là:
nAl = 1,0827= 0,04 mol
Phương trình phản ứng:
2Al+6HCl→2AlCl3+3H20,04 0,06(mol)
Theo phương trình phản ứng ta có:
nH2 = 0,06 mol
Vậy thể tích khí H2 thu được ở đktc là:
V = 0,06.22,4 = 1,344 lít.
Câu 9: Chất nào sau đây tác dụng với dung dịch HCl loãng sinh ra chất khí cháy được trong không khí?
A. Na2O
B. MgO
C. Zn
D. Ca(OH)2
Đáp án: C
Giải thích:
Zn tác dụng với dung dịch HCl loãng sinh ra chất khí cháy được trong không khí (chất khí đó là H2)
Phương trình phản ứng:
Zn + 2HCl → ZnCl2 + H2
Câu 10: Oxit tác dụng được với axit clohiđric là
A. SO2
B. NO2
C. P2O5
D. BaO
Đáp án: D
Giải thích:
Phương trình phản ứng:
BaO + 2HCl → BaCl2 + H2O
Câu 11: Hòa tan hết 16,8 gam kim loại A hóa trị II trong dung dịch axit HCl, sau phản ứng thu được 6,72 lít khí H2 ở đktc. Kim loại A là
A. Fe
B. Mg
C. Cu
D. Zn
Đáp án: A
Giải thích:
Số mol khí H2 là:
nH2=6,7222,4 = 0,3 mol
Phương trình phản ứng:
A+2HCl→ACl2+H20,3 0,3(mol)
Theo phương trình phản ứng ta có:
nA = 0,3 mol
⇒MA = 16,80,3= 56 g/mol
Vậy A là kim loại sắt (Fe).
Câu 12: Ứng dụng của axit sunfuric là
A. Chế biến dầu mỏ
B. Sản xuất muối, axit
C. Chất tẩy rửa
D. Cả A, B, C đều đúng
Đáp án: D
Giải thích: Ứng dụng của axit sunfuric là: Chế biến dầu mỏ, sản xuất muối, axit, chất tẩy rửa. Ngoài ra còn có các ứng dụng khác như: luyện kim, phẩm nhuộm, phân bón, tơ sợi, chất dẻo, …
Câu 13: Tính chất nào không phải là tính chất hóa học của axit clohidric?
A. Tác dụng với nhiều kim loại (Mg, Al, Zn, …)
B. Tác dụng với bazơ
C. Tác dụng với oxit bazơ
D. Làm đổi màu quỳ tím thành xanh
Đáp án: D
Giải thích:
- Tính chất hóa học của axit clohidric là:
+ Làm đổi màu quỳ tím thành đỏ
+ Tác dụng với nhiều kim loại (Mg, Al, Zn, …)
+ Tác dụng với bazơ
+ Tác dụng với oxit bazơ
+ Tác dụng với một số muối
Câu 14: Trung hòa 100ml dung dịch H2SO4 2M bằng dung dịch NaOH 80%. Tính khối lượng dung dịch NaOH cần dùng.
A. 18 gam
B. 19 gam
C. 20 gam
D. 21 gam
Đáp án: C
Giải thích:
Số mol H2SO4 là:
nH2SO4 = 2.0,1 = 0,2 mol
Phương trình phản ứng:
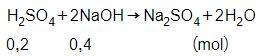
Theo phương trình phản ứng ta có số mol của NaOH là:
nNaOH = 0,4 mol
Khối lượng NaOH cần dùng:
mNaOH = 0,4.40 = 16 gam
Khối lượng dung dịch NaOH 80% là:
mdd=mNaOH.100%C%=16.100%80%⇒mdd=20 gam
Câu 15: Nhỏ từ từ dung dịch BaCl2 vào dung dịch K2SO4 ta thấy xuất hiện
A. Chất kết tủa màu đỏ
B. Xuất hiện kết tủa màu trắng
C. Xuất hiện kết tủa màu xanh lam
D. Có bọt khí thoát ra khỏi dung dịch
Đáp án: B
Giải thích:
Nhỏ từ từ dung dịch BaCl2 vào dung dịch K2SO4 quan sát thấy xuất hiện kết tủa màu trắng (BaSO4).
Phương trình phản ứng:
BaCl2 + K2SO4 → BaSO4 ↓ + 2KCl
Câu 16: Dung dịch axit clohiđric tác dụng với sắt tạo thành:
A. Sắt (II) clorua và khí hiđro.
B. Sắt (III) clorua và khí hiđro.
C. Sắt (II) Sunfua và khí hiđro.
D. Sắt (II) clorua và nước.
Đáp án: A
Giải thích:
Fe + 2HCl → FeCl2 + H2 (↑)
Câu 17: Oxit tác dụng với axit clohiđric là
A. SO2.
B. CO2.
C. CuO.
D. CO.
Đáp án: C
Giải thích:
CuO + 2HCl → CuCl2 + H2O
Câu 18: Muốn pha loãng axit sunfuric đặc ta phải:
A. Rót nước vào axit đặc.
B. Rót từ từ nước vào axit đặc.
C. Rót nhanh axit đặc vào nước.
D. Rót từ từ axit đặc vào nước.
Đáp án: D
Câu 19: Axit sunfuric đặc nóng tác dụng với đồng kim loại sinh ra khí:
A. CO2.
B. SO2.
C. SO3.
D. H2S.
Đáp án: B
Giải thích:
Câu 20: Để nhận biết dung dịch axit sunfuric và dung dịch axit clohiđric ta dùng thuốc thử:
A. NaNO3.
B. KCl.
C. MgCl2.
D. BaCl2.
Đáp án: D
Giải thích:
BaCl2 + HCl → không phản ứng
BaCl2 + H2SO4 → BaSO4 (↓ trắng) + 2HCl
Câu 21: Cặp chất tác dụng với dung dịch axit clohiđric là
A. NaOH, BaCl2 .
B. NaOH, BaCO3.
C. NaOH, Ba(NO3)2.
D. NaOH, BaSO4.
Đáp án: B
Giải thích:
NaOH + HCl → NaCl + H2O
BaCO3 + 2HCl → BaCl2 + CO2 ↑ + H2O
Câu 22: Cho 5,6 g sắt tác dụng với axit clohiđric dư, sau phản ứng thể tích khí H2 thu được (ở đktc):
A. 1,12 lít .
B. 2,24 lít.
C. 11,2 lít.
D. 22,4 lít.
Đáp án: B
Giải thích:
nFe = 5,6 : 56 = 0,1 mol
→ Vkhí = 0,1.22,4 = 2,24 lít.
Câu 23: Trung hoà 200g dung dịch HCl 3,65% bằng dung dịch KOH 1M . Thể tích dung dịch KOH cần dùng là:
A. 100 ml .
B. 300 ml.
C. 400 ml.
D. 200 ml.
Đáp án: D
Giải thích:
Câu 24: Hoà tan hết 3,6 g một kim loại hoá trị II bằng dung dịch H2SO4 loãng được 3,36 lít H2 (đktc). Kim loại là:
A. Zn .
B. Mg.
C. Fe.
D. Ca.
Đáp án: B
Giải thích:
nkhí = 3,36 : 22,4 = 0,15 mol
Gọi kim loại là R (hóa trị II)
Vậy kim loại cần tìm là Magie (Mg).
Câu 25: Trung hoà 100 ml dung dịch H2SO4 1M bằng V (ml) dung dịch NaOH 1M. V là:
A. 50 ml.
B. 200 ml.
C. 300 ml.
D. 400 ml.
Đáp án: B
Giải thích:
Số mol H2SO4 = 0,1.1 = 0,1 mol
Các câu hỏi trắc nghiệm Hóa học lớp 9 có đáp án, chọn lọc khác:
Trắc nghiệm Luyện tập tính chất hóa học của oxit và axit có đáp án
Trắc nghiệm Tính chất hóa học của bazo có đáp án
Trắc nghiệm Một số bazo quan trọng có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
- Trắc nghiệm Toán lớp 12 có đáp án
- Trắc nghiệm Sinh học lớp 12 có đáp án
- Trắc nghiệm Hóa học lớp 12 có đáp án
- Trắc nghiệm Ngữ văn lớp 12 có đáp án
- Trắc nghiệm Tiếng Anh lớp 12 có đáp án
- Trắc nghiệm Địa lí lớp 12 có đáp án
- Trắc nghiệm Vật Lí lớp 12 có đáp án
- Trắc nghiệm Công nghệ lớp 12 có đáp án
- Trắc nghiệm Giáo dục công dân lớp 12 có đáp án
- Trắc nghiệm Lịch sử lớp 12 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 12 có đáp án