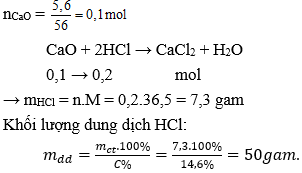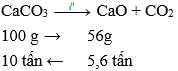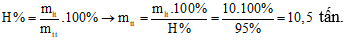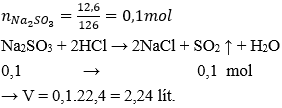TOP 40 câu Trắc nghiệm Một số oxit quan trọng (có đáp án 2024) – Hóa học 9
Bộ 40 bài tập trắc nghiệm Hóa học lớp 9 Bài 2: Một số oxit quan trọng có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 9.
Trắc nghiệm Hóa học 9 Bài 2: Một số oxit quan trọng
Bài giảng Hóa học 9 Bài 2: Một số oxit quan trọng (Phần A: Canxi oxit)
Bài giảng Hóa học 9 Bài 2: Một số oxit quan trọng (Phần B: Lưu huỳnh đioxit)
Câu 1: CaO là oxit
A. Oxit bazơ
B. Oxit axit
C. Oxit trung tính
D. Oxit lưỡng tính
Đáp án: A
Giải thích: CaO là oxit bazơ.
Câu 2: Cho 9,6 gam lưu huỳnh đioxit tác dụng với nước, thu được 200 ml dung dịch axit sunfurơ. Nồng độ mol của dung dịch axit thu được là
A. 0,25M
B. 0,45M
C. 0,50M
D. 0,75M
Đáp án: D
Giải thích:
200 ml = 0,2 lít
Số mol của SO2 là:
Phương trình phản ứng:
Theo phương trình phản ứng ta có số mol của là:
= 0,15 mol
Vậy nồng độ mol của H2SO3 là:
CM = = 0,75M.
Câu 3: CaO dùng làm chất khử chua đất trồng là ứng dụng của tính chất hóa học nào?
A. Tác dụng với oxit axit
B. Tác dụng với oxit bazơ
C. Tác dụng với axit
D. Tác dụng với bazơ
Đáp án: C
Giải thích: CaO dùng làm chất khử chua đất trồng là ứng dụng của tính chất hóa học là tác dụng với axit.
Câu 4: Khí SO2 phản ứng được với các chất trong dãy nào sau đây?
A. KOH, CaO, H2O
B. CaO, NO2, BaCl2
C. NaOH, CaCl2, Na2SO4
D. KOH, NaCl, P2O5
Đáp án: A
Giải thích:
SO2 mang đầy đủ tính chất của một oxit axit.
SO2 phản ứng được với KOH, CaO, H2O.
Phương trình hóa học minh họa:
SO2 + 2KOH dư → K2SO3 + H2O
SO2 + CaO CaSO3
SO2 + H2O → H2SO3
Câu 5: Cho 3,36 lít khí lưu huỳnh đioxit (SO2) ở đktc qua 14 gam canxi oxit (CaO), thu được m gam CaSO3. Giá trị của m là
A. 16 gam
B. 17 gam
C. 18 gam
D. 19 gam
Đáp án: C
Giải thích:
Số mol của SO2 là:
= 0,15 mol
Số mol của CaO là:
nCaO = = 0,25 mol
Phương trình phản ứng:
SO2 + CaO → CaSO3
Ta có:
SO2 phản ứng hết
Theo phương trình phản ứng, ta có:
0,15 mol
Vậy khối lượng của CaSO3 là:
m = 0,15.120 = 18 gam.
Câu 6: Phương trình hóa học nào sau đây dùng để điều chế canxi oxit (CaO)?
A. CaCO3 (r) → CaO (r) + CO2 (k)
B. Ca(OH)2 (dd) → CaO (r) + H2O (h)
C. CaSO4 (r) → CaO (r) + SO2 (k)
D. CaSO4 (r) → CaO (r) + SO2 (k)
Đáp án: A
Giải thích:
Phương trình hóa học dùng để điều chế CaO là:
CaCO3 (r) → CaO (r) + CO2 (k)
Câu 7: Hòa tan hết 11,2 gam CaO vào dung dịch HCl 20%. Khối lượng dung dịch HCl đã dùng là
A. 71 gam
B. 73 gam
C. 75 gam
D. 77 gam
Đáp án: B
Giải thích:
Số mol của CaO là:
nCaO = 0,2 mol
Phương trình phản ứng:
Theo phương trình phản ứng, ta có:
nHCl = 0,4 mol
Suy ra khối lượng của HCl là:
mHCl = 0,4.36,5 = 14,6 gam
Khối lượng dung dịch HCl đã dùng là:
mdd(HCl) = = 73 gam.
Câu 8: Cho hai chất rắn màu trắng: CaO và P2O5, hãy cho biết thuốc thử nào dùng để phân biệt hai chất rắn trên?
A. Nước và quỳ tím
B. Dung dịch NaCl
C. Dung dịch KOH
D. Quỳ tím khô
Đáp án: A
Giải thích:
CaO là oxit bazơ tan trong nước tạo thành dung dịch bazơ, làm quỳ tím chuyển sang màu xanh.
CaO + H2O → Ca(OH)2
P2O5 là oxit axit tan trong nước tạo thành dung dịch axit, làm quỳ tím chuyển sang màu đỏ.
P2O5 + 3H2O → 2H3PO4
Câu 9: Lưu huỳnh đioxit được tạo thành từ cặp chất nào sau đây
A. CaSO3 và KCl
B. CaSO4 và HCl
C. CaSO3 và KOH
D. CaSO3 và HCl
Đáp án: D
Giải thích:
Phương trình phản ứng:
CaSO3 + 2HCl → CaCl2 + SO2 + H2O
Câu 10: Để phân biệt 2 lọ mất nhãn đựng CaO và MgO ta dùng:
A. HCl
B. H2O, quỳ tím.
C. HNO3
D. không phân biệt được.
Đáp án: B
Giải thích:
- CaO + H2O → Ca(OH)2
Ca(OH)2 (dd) làm xanh quỳ tím.
- MgO không phản ứng với nước, không tan trong nước, không làm quỳ tím chuyển màu.
Câu 11: Để thu được 5,6 tấn vôi sống với hiệu suất phản ứng đạt 95% thì lượng CaCO3 cần dùng là
A. 9,5 tấn
B. 10,5 tấn
C. 10 tấn
D. 9,0 tấn
Đáp án: B
Giải thích:
CaCO3 CaO + CO2
100 g → 56g
10 tấn ← 5,6 tấn
Do hiệu suất phản ứng là 95% nên lượng CaCO3 cần dùng là tấn.
Câu 12: Ứng dụng nào sau đây không phải của canxi oxit?
A. Khử chua cho đất
B. Khử độc môi trường
C. Sát trùng diệt nấm
D. Sản xuất cao su
Đáp án: D
Giải thích: Ứng dụng không phải của canxi oxit là sản xuất cao su.
Câu 13: Hòa tan 3,16 gam kali sunfit (K2SO3) vào dung dịch axit clohiđric dư. Thể tích khí SO2 thu được ở đktc là:
A. 0,448 lít
B. 0,224 lít
C. 0,112 lít
D. 0,336 lít
Đáp án: A
Giải thích:
Số mol của K2SO3 là:
= 0,02 mol
Phương trình phản ứng:
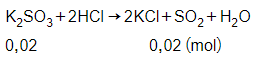
Theo phương trình phản ứng ta có:
= 0,02 mol
Vậy thể tích khí SO2 thu được ở đktc là:
V = 0,02.22,4 = 0,448 lít.
Câu 14: Chất nào dưới đây góp phần nhiều nhất vào sự hình thành mưa axit?
A. O3
B. CO2
C. SO2
D. H2
Đáp án: C
Giải thích: Trong số các đáp án, chất chủ yếu gây nên mưa axit là: SO2.
Câu 15: Trong phòng thí nghiệm, oxit nào được dùng làm chất hút ẩm (chất làm khô)?
A. MgO
B. CuO
C. CaO
D. ZnO
Đáp án: C
Giải thích:
Trong phòng thí nghiệm, oxit được dùng làm chất hút ẩm (chất làm khô) là: CaO
Vì nó tác dụng với nước tạo thành Ca(OH)2
Phương trình phản ứng:
CaO + H2O → Ca(OH)2
Câu 16: Oxit được dùng làm chất hút ẩm (chất làm khô) trong phòng thí nghiệm là
A. CuO
B. ZnO
C. PbO
D. CaO
Đáp án: D
Câu 17: Sản phẩm của phản ứng phân hủy canxi cacbonat bởi nhiệt là:
A. CaO và CO
B. CaO và CO2
C. CaO và SO2
D. CaO và P2O5
Đáp án: B
Giải thích:
Câu 18: Để phân biệt 2 lọ mất nhãn đựng CaO và MgO ta dùng:
A. HCl
B. H2O, quỳ tím.
C. HNO3
D. không phân biệt được.
Đáp án: B
Giải thích:
CaO + H2O → Ca(OH)2
Ca(OH)2 (dd) làm xanh quỳ tím.
MgO không phản ứng với nước, không tan trong nước, không làm quỳ tím chuyển màu.
Câu 19: Cặp chất tác dụng với nhau sẽ tạo ra khí lưu huỳnh đioxit là
A. CaCO3 và HCl
B. Na2SO3 và H2SO4
C. CuCl2 và KOH
D. K2CO3 và HNO3
Đáp án: B
Giải thích:
Na2SO3 + H2SO4 → Na2SO4 + SO2 ↑ + H2O
Câu 20: Chất nào sau đây góp phần nhiều nhất vào sự hình thành mưa axit ?
A. CO2
B. SO2
C. N2
D. O3
Đáp án: B
Câu 21: Dãy các chất tác dụng với lưu huỳnh đioxit là
A. Na2O, CO2, NaOH, Ca(OH)2
B. CaO, K2O, KOH, Ca(OH)2
C. HCl, Na2O, Fe2O3, Fe(OH)3
D. Na2O, CuO, SO3, CO2
Đáp án: B
Câu 22: Vôi sống có công thức hóa học là
A. Ca
B. Ca(OH)2
C. CaCO3
D. CaO
Đáp án: D
Câu 23: Hòa tan hết 5,6 gam CaO vào dung dịch HCl 14,6% . Khối lượng dung dịch HCl đã dùng là:
A. 50 gam
B. 40 gam
C. 60 gam
D. 73 gam
Đáp án: A
Giải thích:
Câu 24: Để thu được 5,6 tấn vôi sống với hiệu suất phản ứng đạt 95% thì lượng CaCO3 cần dùng là
A. 9,5 tấn
B. 10,5 tấn
C. 10 tấn
D. 9,0 tấn
Đáp án: B
Giải thích:
Do hiệu suất phản ứng là 95% nên lượng CaCO3 cần dùng là:
Câu 25: Hòa tan 12,6 gam natrisunfit vào dung dịch axit clohiđric dư. Thể tích khí SO2 thu được ở đktc là:
A. 2,24 lít
B. 3,36 lit
C. 1,12 lít
D. 4,48 lít
Đáp án: A
Giải thích:
Các câu hỏi trắc nghiệm Hóa học lớp 9 có đáp án, chọn lọc khác:
Trắc nghiệm Tính chất hóa học của axit có đáp án
Trắc nghiệm Một số axit quan trọng có đáp án
Trắc nghiệm Luyện tập tính chất hóa học của oxit và axit có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
- Trắc nghiệm Toán lớp 12 có đáp án
- Trắc nghiệm Sinh học lớp 12 có đáp án
- Trắc nghiệm Hóa học lớp 12 có đáp án
- Trắc nghiệm Ngữ văn lớp 12 có đáp án
- Trắc nghiệm Tiếng Anh lớp 12 có đáp án
- Trắc nghiệm Địa lí lớp 12 có đáp án
- Trắc nghiệm Vật Lí lớp 12 có đáp án
- Trắc nghiệm Công nghệ lớp 12 có đáp án
- Trắc nghiệm Giáo dục công dân lớp 12 có đáp án
- Trắc nghiệm Lịch sử lớp 12 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 12 có đáp án