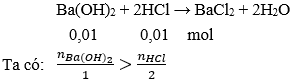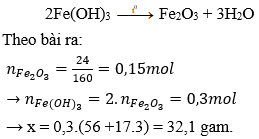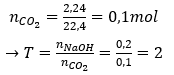TOP 40 câu Trắc nghiệm Tính chất hóa học của bazo (có đáp án 2024) – Hóa học 9
Bộ 40 bài tập trắc nghiệm Hóa học lớp 9 Bài 7: Tính chất hóa học của bazo có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 9.
Trắc nghiệm Hóa học 9 Bài 7: Tính chất hóa học của bazo
Bài giảng Hóa học 9 Bài 7: Tính chất hóa học của bazo
Câu 1: Tính chất hóa học của bazơ là
A. Tác dụng với chất chỉ thị màu
B. Tác dụng với oxit axit, axit
C. Tác dụng với dung dịch muối
D. A, B, C đều đúng
Đáp án: D
Giải thích:
Tính chất hóa học của bazơ là
+ Tác dụng với chất chỉ thị màu
+ Tác dụng với oxit axit
+ Tác dụng với axit
+ Tác dụng với dung dịch muối
+ Bazơ không tan bị nhiệt phân hủy thành oxit và nước.
Câu 2: Để nhận biết dd KOH và dd Ba(OH)2 ta dùng thuốc thử là:
A. Phenolphtalein
B. Quỳ tím
C. dd H2SO4
D. dd HCl
Đáp án: C
Giải thích:
Sử dụng dung dịch H2SO4
+ Nếu không có hiện tượng gì xuất hiện là KOH
2KOH + H2SO4 → K2SO4 + 2H2O
+ Nếu có kết tủa trắng xuất hiện là Ba(OH)2
Ba(OH)2 + H2SO4 → BaSO4 (↓ trắng) + 2H2O
Câu 3: Cho các bazơ sau: KOH, Ca(OH)2, Mg(OH)2, Al(OH)3, Zn(OH)2, Cu(OH)2. Những bazơ tác dụng được với dung dịch HCl là
A. KOH, Cu(OH)2
B. Ca(OH)2, Zn(OH)2
C. Mg(OH)2, Al(OH)3
D. Cả A, B, C đều đúng
Đáp án: D
Giải thích:
Tất cả các bazơ đều tác dụng được với dung dịch axit HCl.
Phương trình phản ứng:
KOH + HCl → KCl + H2O
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Zn(OH)2 + 2HCl → ZnCl2 + 2H2O
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
Al(OH)3 + 3HCl → AlCl3 + 3H2O
Câu 4: Cho 200ml dung dịch Ca(OH)2 1M tác dụng vừa đủ với dung dịch HCl, thu được m gam muối. Giá trị của m là
A. 22,2 gam
B. 24,2 gam
C. 25,4 gam
D. 23,6 gam
Đáp án: A
Giải thích:
Số mol của Ca(OH)2 là:
= 1.0,2 = 0,2 mol
Phương trình phản ứng:
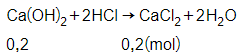
Theo phương trình phản ứng ta có:
= 0,2 mol
Vậy khối lượng của CaCl2 là:
m = 0,2.111 = 22,2 gam.
Câu 5: Cho các chất dưới đây, dãy chất nào toàn là dung dịch kiềm?
A. NaOH, KOH, Mg(OH)2
B. Cu(OH)2, Zn(OH)2, Ba(OH)2
C. Al(OH)3, Ca(OH)2, KOH
D. Ca(OH)2, NaOH, KOH
Đáp án: D
Giải thích: Dãy chất toàn là dung dịch kiềm là: Ca(OH)2, NaOH, KOH.
Câu 6: Cho 24,8 gam natri oxit (Na2O) tác dụng với nước, thu được 0,4 lít dung dịch bazơ (NaOH) xM. Giá trị của x là
A. 1M
B. 2M
C. 3M
D. 4M
Đáp án: B
Giải thích:
Số mol của Na2O là:
= 0,4 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có:
nNaOH = 0,8 mol
Vậy nồng độ mol của NaOH là:
x = CM = = 2M
Câu 7: Cặp chất không tồn tại trong một dung dịch (chúng xảy ra phản ứng với nhau) là
A. CuSO4 và KOH
B. CuSO4 và NaCl
C. MgCl2 và Ba(NO3)2
D. AlCl3 và Mg(NO3)2
Đáp án: A
Giải thích: CuSO4 + 2KOH → Cu(OH)2 ↓ + K2SO4
Câu 8: Nhiệt phân hoàn toàn m gam Fe(OH)3 đến khối lượng không đổi thu được 32 gam chất rắn. Giá trị của m là
A. 42,8 gam
B. 43,2 gam
C. 44,5 gam
D. 45,1 gam
Đáp án: A
Giải thích:
Số mol của Fe2O3 là:
= 0,2 mol
Phương trình phản ứng:
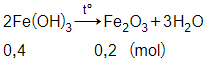
Theo phương trình phản ứng ta có
= 0,4 mol
Vậy khối lượng của Fe(OH)3 cần tìm là:
m = 0,4.107 = 42,8 gam.
Câu 9: Nhóm các chất vừa tác dụng với H2SO4 vừa tác dụng được với dung dịch KOH là
A. NaOH, Ca(OH)2
B. Zn(OH)2, Al(OH)3
C. Mg(OH)2, KOH
D. Ba(OH)2, Cu(OH)2
Đáp án: B
Giải thích:
Al(OH)3, Zn(OH)2 là hai hidroxit lưỡng tính nên vừa tác dụng được với dung dịch H2SO4 và vừa tác dụng được với dung dịch KOH
Phương trình phản ứng:
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Al(OH)3 + KOH → KAlO2 + 2H2O
Zn(OH)2 + H2SO4 → ZnSO4 + 2H2O
Zn(OH)2 + 2KOH → K2ZnO2 + 2H2O
Câu 10: Cho 150 ml dung dịch Ba(OH)2 4M vào 200 ml dung dịch H2SO4 2M. Khối lượng kết tủa thu được là
A. 90,8 gam
B. 91,6 gam
C. 92,4 gam
D. 93,2 gam
Đáp án: D
Giải thích:
Số mol của Ba(OH)2 là:
= 0,15.4 = 0,6 mol
Số mol của H2SO4 là:
= 0,2.2 = 0,4 mol
Phương trình phản ứng:
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
Xét
Suy ra Ba(OH)2 dư, H2SO4 phản ứng hết
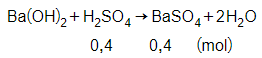
Theo phương trình phản ứng ta có:
= 0,4 mol
Vậy khối lượng của BaSO4 là:
= 0,4.233 = 93,2 gam.
Câu 11: Bazơ nào sau đây bị nhiệt phân hủy?
A. Cu(OH)2
B. NaOH
C. Ca(OH)2
D. KOH
Đáp án: A
Giải thích:
Bazơ bị nhiệt phân hủy là: Cu(OH)2
Phương trình phản ứng:
Cu(OH)2 CuO + H2O
Câu 12: Nhiệt phân hoàn toàn 9,8 gam Cu(OH)2 thu được một chất rắn màu đen, dùng khí H2 dư khử chất rắn màu đen đó thu được một chất rắn màu đỏ có khối lượng là
A. 4,6 gam
B. 5,4 gam
C. 6,4 gam
D. 7,2 gam
Đáp án: C
Giải thích:
Số mol của Cu(OH)2 là:
= 0,1 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có:
nCuO = 0,1 mol
Suy ra số mol Cu là:
nCu = 0,1 mol
Vậy khối lượng của Cu là:
mCu = 0,1.64 = 6,4 gam.
Câu 13: Dung dịch chất nào sau đây đổi màu quỳ tím thành xanh?
A. HCl
B. H2O
C. H2SO4
D. NaOH
Đáp án: D
Giải thích: Dung dịch NaOH (dung dịch bazơ) làm quỳ tím chuyển màu xanh.
Câu 14: Phản ứng hoá học nào sau đây tạo ra oxit bazơ?
A. Cho dung dịch KOH phản ứng với dung dịch H2SO4
B. Cho dung dịch NaOH dư phản ứng với SO2
C. Nung nóng Fe(OH)3
D. Cho dung dịch NaOH phản ứng với dung dịch HCl
Đáp án: C
Giải thích:
2Fe(OH)3 Fe2O3 + 3H2O
Oxit ba zơ: Fe2O3.
Câu 15: Trung hòa 300 ml dung dịch H2SO4 0,5M bằng dung dịch NaOH 30%. Khối lượng dung dịch NaOH cần dùng là
A. 40 gam
B. 45 gam
C. 50 gam
D. 55 gam
Đáp án: A
Giải thích:
Số mol của H2SO4 là:
= 0,5.0,3 = 0,15 mol
Phương trình phản ứng:
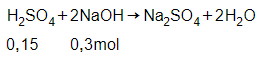
Theo phương trình phản ứng, ta có:
nNaOH = 0,3 mol
Khối lượng của NaOH là:
mNaOH = 0,3.40 = 12 gam
Khối lượng dung dịch NaOH cần dùng là:
Câu 16: Dung dịch KOH phản ứng với dãy oxit nào sau đây?
A. CO2; SO2; P2O5; Fe2O3
B. Fe2O3; SO2; SO3; MgO
C. P2O5; CO2; SO2 ; SO3
D. P2O5; CO2; CuO; SO3
Đáp án: C
Giải thích:
P2O5; CO2; SO2 ; SO3 là các oxit axit nên phản ứng được với KOH.
Câu 17: Dãy các bazơ bị nhiệt phân huỷ tạo thành oxit bazơ tương ứng và nước là
A. Cu(OH)2; Zn(OH)2; Al(OH)3; Mg(OH)2
B. Cu(OH)2; Zn(OH)2; Al(OH)3; NaOH
C. Fe(OH)3; Cu(OH)2; KOH; Mg(OH)2
D. Fe(OH)3; Cu(OH)2; Ba(OH)2; Mg(OH)2
Đáp án: A
Giải thích:
Cu(OH)2 ; Zn(OH)2; Al(OH)3; Mg(OH)2 là các bazơ không tan nên bị nhiệt phân hủy.
Câu 18: Dung dịch KOH không có tính chất hoá học nào sau đây?
A. Làm quỳ tím hoá xanh
B. Tác dụng với oxit axit tạo thành muối và nước
C. Tác dụng với axit tạo thành muối và nước
D. Bị nhiệt phân huỷ tạo ra oxit bazơ và nước
Đáp án: D
Giải thích:
KOH là bazơ tan nên không bị nhiệt phân hủy.
Câu 19: Để nhận biết dd KOH và dd Ba(OH)2 ta dùng thuốc thử là:
A. Phenolphtalein
B. Quỳ tím
C. dd H2SO4
D. dd HCl
Đáp án: C
Giải thích:
Sử dụng dung dịch H2SO4
+ Nếu không có hiện tượng gì xuất hiện là KOH
2KOH + H2SO4 → K2SO4 + 2H2O
+ Nếu có kết tủa trắng xuất hiện là Ba(OH)2
Ba(OH)2 + H2SO4 → BaSO4 (↓ trắng) + 2H2O
Câu 20: Để điều chế dung dịch Ba(OH)2, người ta cho:
A. BaO tác dụng với dung dịch HCl
B. BaCl2 tác dụng với dung dịch Na2CO3
C. BaO tác dụng với dung dịch H2O
D. Ba(NO3)2 tác dụng với dung dịch Na2SO4
Đáp án: C
Giải thích:
BaO + H2O → Ba(OH)2
Câu 21: Cặp chất không tồn tại trong một dung dịch (chúng xảy ra phản ứng với nhau) là
A. CuSO4 và KOH
B. CuSO4 và NaCl
C. MgCl2 và Ba(NO3)2
D. AlCl3 và Mg(NO3)2
Đáp án: A
Giải thích:
CuSO4 + 2KOH → Cu(OH)2 ↓ + K2SO4
Câu 22: Cho 100ml dung dịch Ba(OH)2 0,1M vào 100ml dung dịch HCl 0,1M. Dung dịch thu được sau phản ứng:
A. Làm quỳ tím hoá xanh
B. Làm quỳ tím hoá đỏ
C. Phản ứng được với magiê giải phóng khí hidrô
D. Không làm đổi màu quỳ tím
Đáp án: A
Giải thích:
Số mol Ba(OH)2 = 0,1.0,1 = 0,01 mol;
số mol HCl = 0,1.0,1 = 0,01 mol
→ Ba(OH)2 dư, dung dịch sau phản ứng làm quỳ tím chuyển sang màu xanh.
Câu 23: Nhiệt phân hoàn toàn x gam Fe(OH)3 đến khối lượng không đổi thu được 24g chất rắn. Giá trị của x là:
A. 16,05g
B. 32,10g
C. 48,15g
D. 72,25g
Đáp án: B
Giải thích:
Câu 24: Nhỏ một giọt quỳ tím vào dung dịch KOH, dung dịch có màu xanh, nhỏ từ từ dung dịch HCl cho tới dư vào dung dịch có màu xanh trên thì:
A. Màu xanh vẫn không thay đổi.
B. Màu xanh nhạt dần rồi mất hẳn
C. Màu xanh nhạt dần, mất hẳn rồi chuyển sang màu đỏ
D. Màu xanh đậm thêm dần
Đáp án: C
Câu 25: Sục 2,24 lít khí CO2 vào dung dịch chứa 0,2 mol NaOH. Dung dịch thu được sau phản ứng chứa:
A. NaHCO3
B. Na2CO3
C. Na2CO3 và NaOH
D. NaHCO3 và NaOH
Đáp án: B
Giải thích:
Vậy sau phản ứng CO2 và NaOH đều hết, sản phẩm thu được là Na2CO3.
Các câu hỏi trắc nghiệm Hóa học lớp 9 có đáp án, chọn lọc khác:
Trắc nghiệm Một số bazo quan trọng có đáp án
Trắc nghiệm Tính chất hóa học của muối có đáp án
Trắc nghiệm Một số muối quan trọng có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
- Trắc nghiệm Toán lớp 12 có đáp án
- Trắc nghiệm Sinh học lớp 12 có đáp án
- Trắc nghiệm Hóa học lớp 12 có đáp án
- Trắc nghiệm Ngữ văn lớp 12 có đáp án
- Trắc nghiệm Tiếng Anh lớp 12 có đáp án
- Trắc nghiệm Địa lí lớp 12 có đáp án
- Trắc nghiệm Vật Lí lớp 12 có đáp án
- Trắc nghiệm Công nghệ lớp 12 có đáp án
- Trắc nghiệm Giáo dục công dân lớp 12 có đáp án
- Trắc nghiệm Lịch sử lớp 12 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 12 có đáp án