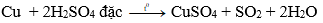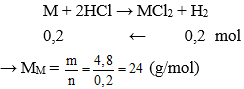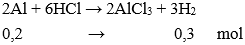TOP 40 câu Trắc nghiệm Dãy hoạt động của kim loại (có đáp án 2024) - Hóa học 9
Bộ 40 bài tập trắc nghiệm Hóa học lớp 9 Bài 17: Dãy hoạt động của kim loại có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 9.
Trắc nghiệm Hóa học 9 Bài 17: Dãy hoạt động hóa học của kim loại
Bài giảng Hóa học 9 Bài 17: Dãy hoạt động hóa học của kim loại
Câu 1: Dãy kim loại được sắp xếp theo chiều hoạt động hóa học giảm dần là
A. Na, Mg, Zn.
B. Al, Zn, Na.
C. Mg, Al, Na.
D. Pb, Al, Mg.
Đáp án: A
Giải thích:
Dãy hoạt động hóa học của một số kim loại:
K, Na, Mg, Al, Zn, Fe, Pb, (H), Cu, Ag, Au.
→ Dãy kim loại được sắp xếp theo chiều hoạt động hóa học giảm dần là:
Na, Mg, Zn.
Câu 2: Dãy kim loại tác dụng được với dung dịch Cu(NO3)2 tạo thành Cu kim loại là
A. Al , Zn, Fe
B. Zn, Pb, Au
C. Mg, Fe, Ag
D. Na, Mg, Al
Đáp án: A
Giải thích:
Các kim loại tác dụng được với Cu(NO3)2 tạo thành Cu kim loại phải đứng trước Cu trong dãy hoạt động hóa học của kim loại và các kim loại đó phải không tác dụng với nước.
Phương trình hóa học minh họa:
2Al + 3Cu(NO3)2 → 2Al(NO3)3 + 3Cu
Zn + Cu(NO3)2 → Zn(NO3)2 + Cu
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Câu 3: Dãy hoạt động hóa học của kim loại không cho biết
A. Mức độ hoạt động hóa học của các kim loại giảm dần từ trái qua phải.
B. Kim loại kiềm và kim loại kiềm thổ đều phản ứng với nước ở điều kiện thường tạo thành kiềm và giải phóng khí H2.
C. Kim loại đứng trước H phản ứng với một số dung dịch axit (HCl, H2SO4 loãng, …) giải phóng khí H2.
D. Kim loại đứng trước (trừ Na, K,…) đẩy kim loại đứng sau ra khỏi dung dịch muối.
Đáp án: B
Giải thích:
Dãy hoạt động hóa học của kim loại cho biết
- Mức độ hoạt động hóa học của các kim loại giảm dần từ trái qua phải.
- Kim loại đứng trước Mg phản ứng với nước ở điều kiện thường tạo thành kiềm và giải phóng khí H2.
- Kim loại đứng trước H phản ứng với một số dung dịch axit (HCl, H2SO4 loãng, …) giải phóng khí H2.
- Kim loại đứng trước (trừ Na, K,…) đẩy kim loại đứng sau ra khỏi dung dịch muối.
Câu 4: Từ Cu và hoá chất nào dưới đây để thu được CuSO4 ?
A. MgSO4
B. Al2(SO4)3
C. H2SO4 loãng
D. H2SO4 đặc, nóng
Đáp án: D
Giải thích:
Cu không phản ứng với MgSO4; Al2(SO4)3, H2SO4 loãng.
Cu + 2H2SO4 đặc CuSO4 + SO2 + 2H2O
Câu 5: Có một mẫu dung dịch MgSO4 bị lẫn tạp chất là ZnSO4, có thể làm sạch mẫu dung dịch này bằng kim loại
A. Zn.
B. Mg.
C. Fe.
D. Cu.
Đáp án: B
Giải thích:
Cho một lượng dư Mg phản ứng với mẫu dung dịch. Đến khi phản ứng xảy ra hoàn toàn, lọc bỏ kim loại ta được dung dịch MgSO4 tinh khiết.
Phương trình hóa học:
Mg + ZnSO4 MgSO4 + Zn
Câu 6: Nếu hoà tan hết cùng một khối lượng Al và Zn bởi dung dịch HCl thì
A. Al giải phóng hiđro nhiều hơn Zn .
B. Zn giải phóng hiđro nhiều hơn Al.
C. Al và Zn giải phóng cùng một lượng hiđro.
D. Lượng hiđro do Al sinh ra bằng 2,5 lần do Zn sinh ra .
Đáp án: A
Giải thích:
Giả sử mAl = mZn = m gam
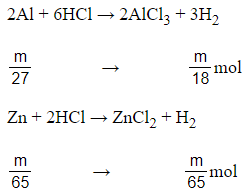
Có > . Vậy nếu hoà tan hết cùng một khối lượng Al và Zn bởi dung dịch HCl thì Al giải phóng hiđro nhiều hơn Zn.
Câu 7: Ngâm một lá kẽm (Zn) trong 20 gam dung dịch muối CuSO4 10% cho đến khi kẽm không tan được nữa thì dừng phản ứng. Khối lượng lá kẽm đã tham gia phản ứng là
A. 8,125 gam.
B. 0,8125 gam.
C. 2,125 gam.
D. 0,2125 gam.
Đáp án: B
Giải thích:
Phương trình hóa học:
Zn + CuSO4 ZnSO4 + Cu
0,0125 ← 0,0125 (mol)
mZn pư = 0,0125.65= 0,8125 gam
Câu 8: Ngâm lá sắt (Fe) có khối lượng 56 gam vào dung dịch AgNO3, sau một thời gian lấy lá sắt ra rửa nhẹ cân được 57,6 gam . Vậy khối lượng bạc (Ag) sinh ra là
A. 10,8 gam.
B. 21,6 gam.
C. 1,08 gam.
D. 2,16 gam.
Đáp án: D
Giải thích:
Đặt số mol Fe phản ứng là a
Phương trình hóa học:
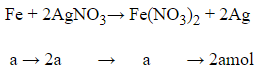
Bảo toàn khối lượng:
mFe + m Ag sinh ra – mFe(phản ứng) = 57,6
56 + 108.2a − 56a = 57,6
a = 0,01 mol
→ nAg = 2.a = 0,02 mol
→ mAg sinh ra = 0,02.108 = 2,16 gam
Câu 9: Cho 4,8 gam kim loại M có hóa trị II vào dung dịch HCl dư, thấy thoát ra 4,48 lít khí hiđro (ở đktc). Vậy kim loại M là
A. Ca.
B. Mg.
C. Fe.
D. Ba.
Đáp án: B
Giải thích:
Phương trình hóa học:
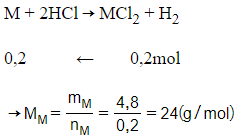
M là Magie (Mg)
Câu 10: Cho 1 viên natri (Na) vào dung dịch CuSO4, hiện tượng xảy ra là
A. Viên natri tan dần, sủi bọt khí, dung dịch không đổi màu.
B. Viên natri tan dần,không có khí thoát ra, có kết tủa màu xanh.
C. Viên natri tan, có khí không màu thoát ra, xuất hiện kết tủa màu xanh.
D. Không có hiện tượng.
Đáp án: C
Giải thích:
Natri tan dần, có khí không màu thoát ra, xuất hiện kết tủa màu xanh.
Phương trình hóa học:
2Na + 2H2O 2NaOH + H2
![]()
Câu 11: Phản ứng hóa học không chính xác là
A. Fe + CuSO4 FeSO4 + Cu.
B. Fe + 2AgNO3Fe(NO3)2 + 2Ag.
C. Cu + MgSO4 CuSO4 + Mg.
D. Cu + 2AgNO3Cu(NO3)2 + 2Ag
Đáp án: C
Giải thích: Phản ứng C sai vì Cu là kim loại đứng sau Mg trong dãy hoạt động hóa học của kim loại, nên Cu không thể đẩy được Mg ra khỏi muối MgSO4.
Câu 12: Kim loại được dùng để phân biệt 3 dung dịch: NaCl, CuCl2, Na2SO4 là
A. Mg.
B. Ba.
C. Fe.
D. Al.
Đáp án: B
Giải thích:
- Trích mẫu thử, cho vào mỗi mẫu thử một ít Ba.
- Hiện tượng:
+ Ba tan dần, có khí thoát ra → dung dịch là NaCl
Ba + 2H2O → Ba(OH)2 + H2↑
+ Có khí thoát ra, đồng thời xuất hiện kết tủa xanh → dung dịch là CuCl2.
Ba + 2H2O → Ba(OH)2 + H2↑
![]()
+ Có khí thoát ra, đồng thời xuất hiện kết tủa trắng → dung dịch là Na2SO4.
Ba + 2H2O → Ba(OH)2 + H2↑
![]()
Ngoài ra, có thể quan sát màu dung dịch để nhận ra CuCl2 (dd màu xanh); hai dung dịch còn lại không màu. Sau đó tiếp tục dùng kim loại Ba để nhận ra 2 dung dịch không màu này.
Câu 13: Cho 27,6 gam hỗn hợp 2 kim loại Mg và Ag tác dụng với dung dịch HCl vừa đủ, sau phản ứng thấy thoát ra 5,6 lít khí (ở đktc). Thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu lần lượt là
A. 21,74% và 78,26%.
B. 20,74% và 79,26%.
C. 21,47% và 78,62%.
D. 20,47% và 78,26%
Đáp án: A
Giải thích:
Cho Mg và Ag tác dụng với HCl chỉ có Mg phản ứng.
Mg + 2HClMgCl2 + H2
0,25 ← 0,25 mol
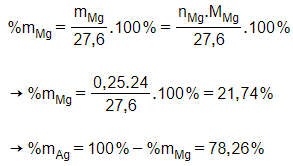
Câu 14: Hiện tượng gì xảy ra khi cho 1 thanh đồng vào dung dịch H2SO4 loãng?
A. Thanh đồng tan dần, khí không màu thoát ra
B. Thanh đồng tan dần, dung dịch chuyển thành màu xanh lam
C. Không hiện tượng
D. Có kết tủa trắng
Đáp án: C
Giải thích: Do đồng đứng sau H trong dãy hoạt động hóa học của kim loại nên không tác dụng được với dung dịch H2SO4 loãng.
Câu 15: Cho 10,5 gam hỗn hợp 2 kim loại Cu, Zn vào dung dịch H2SO4 loãng, dư người ta thu được 2,24 lít khí (ở đktc). Khối lượng chất rắn còn lại sau khi phản ứng kết thúc là
A. 3.
B. 4.
C. 5.
D. 6.
Đáp án: B
Giải thích:
Hỗn hợp Zn và Cu tác dụng với dung dịch H2SO4, chỉ có Zn phản ứng.
Phương trình hóa học:
Zn + H2SO4(loãng)ZnSO4 + H2
Theo phương trình:
Khối lượng kẽm (Zn) phản ứng là:
mZn = nZn . MZn = 0,1.65 = 6,5gam
Khối lượng chất rắn (Cu) còn lại là:
mCu = m(Hỗn hợp) – mZn(phản ứng)
mCu = 10,5 – 6,5 = 4 gam
Câu 16: Dãy kim loại được sắp xếp theo chiều hoạt động hóa học giảm dần:
A. Na, Mg, Zn
B. Al, Zn, Na
C. Mg, Al, Na
D. Pb, Al, Mg
Đáp án: A
Câu 17: Từ Cu và hoá chất nào dưới đây để thu được CuSO4 ?
A. MgSO4
B. Al2(SO4)3
C. H2SO4 loãng
D. H2SO4 đặc, nóng
Đáp án: D
Giải thích:
Câu 18: Có một mẫu dung dịch MgSO4 bị lẫn tạp chất là ZnSO4, có thể làm sạch mẫu dung dịch này bằng kim loại
A. Zn
B. Mg
C. Fe
D. Cu
Đáp án: B
Giải thích:
Sử dụng một lượng dư kim loại Mg
Mg + ZnSO4 → MgSO4 + Zn ↓
Lọc bỏ kim loại thu được dung dịch MgSO4 tinh khiết.
Câu 19: Dãy kim loại tác dụng được với dung dịch Cu(NO3)2 tạo thành Cu kim loại:
A. Al , Zn, Fe
B. Zn, Pb, Au
C. Mg, Fe , Ag
D. Na, Mg , Al
Đáp án: A
Giải thích:
Các kim loại tác dụng được với Cu(NO3)2 tạo thành Cu kim loại phải đứng trước Cu trong dãy hoạt động hóa học của kim loại và các kim loại đó phải không tác dụng với nước.
→ A thỏa mãn.
Câu 20: Có một mẫu Fe bị lẫn tạp chất là nhôm, để làm sạch mẫu sắt này bằng cách ngâm nó với
A. Dung dịch NaOH dư
B. Dung dịch H2SO4 loãng
C. Dung dịch HCl dư
D. Dung dịch HNO3 loãng .
Đáp án: A
Giải thích:
Sử dụng một lượng dư dung dịch NaOH
2Al + 2H2O + 2NaOH → 2NaAlO2 + 3H2
Lọc lấy kim loại rửa sạch thu được Fe tinh khiết.
Chú ý: Một số kim loại như Al, Zn … có thể tác dụng được với dung dịch kiềm.
Câu 21: Cho 4,8 gam kim loại M có hóa trị II vào dung dịch HCl dư , thấy thoát ra 4,48 lít khí hiđro (ở đktc). Vậy kim loại M là :
A. Ca
B. Mg
C. Fe
D. Ba
Đáp án: B
Giải thích:
nkhí = 4,48 : 22,4 = 0,2 mol
Vậy kim loại cần tìm là Mg.
Câu 22: Hiện tượng gì xảy ra khi cho 1 thanh đồng vào dung dịch H2SO4 loãng?
A. Thanh đồng tan dần, khí không màu thoát ra
B. Thanh đồng tan dần, dung dịch chuyển thành màu xanh lam
C. Không hiện tượng
D. Có kết tủa trắng.
Đáp án: C
Giải thích:
Đồng đứng sau H trong dãy hoạt động hóa học của kim loại nên không tác dụng với H2SO4 loãng.
Câu 23: Hiện tượng xảy ra khi cho 1 lá nhôm vào dung dịch H2SO4 đặc, nguội:
A. Khí mùi hắc thoát ra
B. Khí không màu và không mùi thoát ra
C. Lá nhôm tan dần
D. Không có hiện tượng
Đáp án: D
Giải thích:
Chú ý: Một số kim loại như Al, Fe, Cr … không tác dụng với H2SO4 đặc, nguội.
Câu 24: Cho 5,4 gam nhôm vào dung dịch HCl dư , thể tích khí thoát ra (ở đktc) là:
A. 4,48 lít
B. 6,72 lít
C. 13,44 lít
D. 8,96 lít
Đáp án: B
Giải thích:
Số mol Al = 5,4 : 27 = 0,2 mol
→ Vkhí = 0,3.22,4 = 6,72 lít.
Câu 25: Cho 1 viên Natri vào dung dịch CuSO4, hiện tượng xảy ra:
A. Viên Natri tan dần, sủi bọt khí, dung dịch không đổi màu
B. Viên Natri tan dần,không có khí thoát ra, có kết tủa màu xanh
C. Viên Natri tan, có khí không màu thoát ra, xuất hiện kết tủa màu xanh
D. Không có hiện tượng.
Đáp án: C
Giải thích:
Viên Natri tan, có khí không màu thoát ra, xuất hiện kết tủa màu xanh lam
PTHH:
2Na + 2H2O → 2NaOH + H2 ↑
2NaOH + CuSO4 → Cu(OH)2 (↓ xanh) + Na2SO4.
Các câu hỏi trắc nghiệm Hóa học lớp 9 có đáp án, chọn lọc khác:
Trắc nghiệm Hợp kim sắt: Gang, thép có đáp án
Trắc nghiệm Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
- Trắc nghiệm Toán lớp 12 có đáp án
- Trắc nghiệm Sinh học lớp 12 có đáp án
- Trắc nghiệm Hóa học lớp 12 có đáp án
- Trắc nghiệm Ngữ văn lớp 12 có đáp án
- Trắc nghiệm Tiếng Anh lớp 12 có đáp án
- Trắc nghiệm Địa lí lớp 12 có đáp án
- Trắc nghiệm Vật Lí lớp 12 có đáp án
- Trắc nghiệm Công nghệ lớp 12 có đáp án
- Trắc nghiệm Giáo dục công dân lớp 12 có đáp án
- Trắc nghiệm Lịch sử lớp 12 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 12 có đáp án