TOP 40 câu Trắc nghiệm Đồng và hợp chất của đồng (có đáp án 2024) - Hóa học 12
Bộ 40 bài tập trắc nghiệm Hóa học lớp 12 Bài 35: Đồng và hợp chất của đồng có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 12.
Trắc nghiệm Hóa học 12 Bài 35: Đồng và hợp chất của đồng
Câu 1: Cho các tính chất sau:
(a) là kim loại có màu đỏ.
(b) là kim loại nhẹ.
(c) nóng chảy ở nhiệt độ cao.
(d) tương đối cứng.
(e) dễ kéo dài và dát mỏng.
(g) dẫn điện tốt.
(h) dẫn nhiệt kém.
Có bao nhiêu tính chất vật lí là tính chất vật lí của kim loại đồng?
A. 3.
B. 4.
C. 5.
D. 6.
Đáp án: B
Giải thích:
Tính chất vật lí của kim loại đồng:
- Là kim loại màu đỏ, dẻo, dễ kéo sợi và dát mỏng (có thể dát mỏng đến 0,0025 mm, mỏng hơn giấy viết 5 - 6 lần).
- Có độ dẫn điện và dẫn nhiệt rất cao (chỉ kém bạc).
- Khối lượng riêng lớn 8,98 g/cm3.
- Nhiệt độ nóng chảy cao 1083oC.
→ Có 4 tính chất vật lí là tính chất vật lí của đồng: (a), (c), (e), (g)
Câu 2: Để nhận biết ion nitrat, thường dùng Cu và dung dịch axit sufuric loãng đun nóng là vì
A. phản ứng tạo ra kết tủa màu vàng và dung dịch có màu xanh.
B. phản ứng tạo ra dung dịch có màu xanh và khí không mùi làm xanh giấy quỳ ẩm.
C. phản ứng tạo ra kết tủa màu xanh.
D. phản ứng tạo dung dịch có màu xanh và khí không màu hóa nâu trong không khí.
Đáp án: D
Giải thích:
Xảy ra phản ứng:
![]()
Dung dịch Cu2+ có màu xanh; khí NO không màu nhưng hóa nâu trong không khí.
Câu 3: Cho Cu (Z = 29), vị trí của Cu trong bảng tuần hoàn là
A. ô 29, chu kỳ 4, nhóm IB.
B. ô 29, chu kỳ 4, nhóm IA.
C. ô 29, chu kỳ 4, nhóm VIIIB.
D. ô 29, chu kỳ 4, nhóm IIB.
Đáp án: A
Giải thích:
Cấu hình electron của Cu là:
1s22s22p63s23p63d104s1
Vậy Cu ở ô 29 (Z = 29), chu kỳ 4 (do có 4 lớp electron), nhóm IB (1 electron hóa trị, nguyên tố d).
Câu 4: Trong các hợp chất, đồng có số oxi hóa phổ biến là
A. +1.
B. +2.
C. -2.
D. +1 và +2.
Đáp án: D
Giải thích:
Trong các hợp chất, đồng có số oxi hóa phổ biến là +1 và +2.
Câu 5: Hợp kim Cu – Zn (45% Zn) được gọi là
A. đồng thau.
B. đồng thanh.
C. đồng bạch.
D. đuy ra.
Đáp án: A
Giải thích:
Đồng thau là hợp kim Cu – Zn (45% Zn).
Câu 6: Cho 3,2 gam Cu tác dụng với 100ml dung dịch hỗn hợp (HNO3 0,8M + H2SO4 0,2M), sản phẩm khử duy nhất của HNO3 là NO. Thể tích khí NO (đktc) là
A. 0,672 lít.
B. 0,336 lít.
C. 0,747 lít.
D. 1,792 lít.
Đáp án: A
Giải thích:
nCu = 3,2 : 64 = 0,05 mol
nH+= 0,8.0,1 + 2.0,2.0,1
= 0,12 mol
nNO3−= 0,8.0,1 = 0,08 mol
![]()
→ Sau phản ứng H+ hết đầu tiên
→ nNO = 2.nH+8
= 2.0,128 = 0,03 mol
→ VNO = 0,03.22,4 = 0,672 lít.
Câu 7: Đồng thuộc ô 29 trong bảng tuần hoàn, vậy cấu hình electron của Cu+ và Cu2+ lần lượt là
A. [Ar]3d10; [Ar]3d9.
B. [Ar]3d94s1; [Ar]3d84s1.
C. [Ar]3d94s1; [Ar]3d9.
D. [Ar]3d84s2; [Ar]3d84s1.
Đáp án: A
Giải thích:
Đồng có cấu hình electron là [Ar]3d104s1
→ Cấu hình electron của Cu+ và Cu2+ lần lượt là:
[Ar]3d10; [Ar]3d9.
Câu 8: Tổng hệ số là các số nguyên, tối giản của tất cả các chất trong phương trình phản ứng giữa Cu với dung dịch HNO3 đặc, nóng là
A. 8.
B. 10.
C. 11.
D. 9.
Đáp án: B
Giải thích:
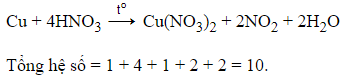
Câu 9: Nhúng một thanh sắt nặng 100 gam vào 100 ml dung dịch hỗn hợp gồm Cu(NO3)2 0,2M và AgNO3 0,2M. Sau một thời gian lấy thanh kim loại ra, rửa sạch làm khô cân được 101,72 gam (giả thiết các kim loại tạo thành đều bám hết vào thanh sắt). Khối lượng sắt đã phản ứng là
A. 2,16 gam.
B. 0,84 gam.
C. 1,72 gam.
D. 1,40 gam.
Đáp án: D
Giải thích:
![]()
= nAg = 0,1.0,2 = 0,02 mol
= nFe phản ứng (1)
mtăng (1) = 0,02.108 – 0,01.56
= 1,6 gam
Theo bài ra
mKL tăng = 101,72 – 100 = 1,72 gam.
Tiếp tục có phản ứng:
Đặt số mol Fe phản ứng (2) là a mol
Fe (a) + Cu2+ → Fe2+ (a mol) + Cu (2)
mtăng (2) = 64a – 56a
= 1,72 – 1,6
→ a = 0,015 mol
→ mFe = (0,01 + 0,015).56
= 1,4 gam.
Câu 10: Nhận định nào sau đây là sai?
A. Đồng dẻo, dễ kéo sợi.
B. Đồng là kim loại có màu đen.
C. Đồng có thể dát mỏng hơn giấy viết từ 5 đến 6 lần.
D. Đồng dẫn nhiệt, điện tốt.
Đáp án: B
Giải thích:
Đồng là kim loại có màu đỏ.
Câu 11: Cho Cu và dung dịch H2SO4 loãng tác dụng với chất X (một loại phân bón hóa học), thấy thoát ra khí không màu hóa nâu trong không khí. Mặt khác, khi X tác dụng với dung dịch NaOH thì có khí mùi khai thoát ra. Chất X là
A. amophot.
B. ure.
C. natri nitrat.
D. amoni nitrat.
Đáp án: D
Giải thích:
Amoni nitrat NH4NO3
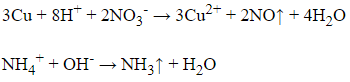
Câu 12: Nhúng một thanh Cu vào dung dịch AgNO3, sau một thời gian lấy ra, rửa sạch, sấy khô, đem cân thì khối lượng thanh đồng thay đổi thế nào ?
A. Tăng.
B. Giảm.
C. Không thay đổi.
D. không xác định được.
Đáp án: A
Giải thích:
Giả sử có 1 mol Cu tham gia phản ứng
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag↓
nAg = 2nCu = 2 mol
→ Khối lượng thanh đồng tăng = 2.108 - 64 = 152 gam.
Câu 13: Cho Cu tác dụng với từng dung dịch sau: HCl (1), HNO3 (2), AgNO3 (3), Fe(NO3)2 (4), Fe(NO3)3 (5), Na2S (6). Cu phản ứng được với
A. 2, 3, 5, 6.
B. 2, 3, 5.
C. 1, 2, 3.
D. 2, 3.
Đáp án: B
Giải thích:
Câu 14: Để loại CuSO4 lẫn trong dung dịch FeSO4, cần dùng thêm lượng dư chất nào sau đây?
A. Al.
B. Fe.
C. Zn.
D. Ni.
Đáp án: B
Giải thích:
Thêm lượng dư Fe.
Phương trình phản ứng:
Fe + CuSO4 → FeSO4 + Cu
Kết thúc phản ứng, lọc bỏ kim loại thu được dung dịch FeSO4 tinh khiết,
Câu 15: Hòa tan hết 3,04 gam hỗn hợp bột Fe và Cu trong dung dịch HNO3 loãng thu được 0,896 lít khí NO (đktc). Phần trăm của Fe và Cu trong hỗn hợp lần lượt là
A. 63,2% và 36,8%.
B. 36,8% và 63,2%.
C. 50% và 50%.
D. 36,2% và 63,8%.
Đáp án: B
Giải thích:
Gọi số mol của Fe và Cu trong hỗn hợp lần lượt là x và y mol
→ mhh = 3,04
→ 56x + 64y = 3,04. (1)
Áp dụng định luật bảo toàn electron ta có:
3.nFe + 2.nCu = 3.nNO
→ 3x + 2y = 0,12 (2)
Giải hệ phương trình (1) và (2) được x = 0,02 và y = 0,03
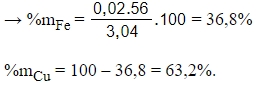
Câu 16: Chất lỏng Boocđo là hỗn hợp CuSO4 và vôi tôi trong nước theo một tỉ lệ nhất định, chất lỏng này phải hơi có tính kiềm (vì nếu CuSO4 dư sẽ thấm vào mô thực vật gây hại lớn cho cây). Boocđo là một chất diệt nấm cho cây rất hiệu quả nên được các nhà làm vườn ưa dùng, hơn nữa việc pha chế nó cũng rất đơn giản. Để phát hiện CuSO4 dư nhanh, có thể dùng phản ứng hóa học nào sau đây?
A. Glixerol tác dụng với CuSO4 trong môi trường kiềm.
B. Sắt tác dụng với CuSO4.
C. Amoniac tác dụng với CuSO4.
D. Bạc tác dụng với CuSO4.
Đáp án: B
Giải thích:
Chất lỏng Boocđo gồm những hạt rất nhỏ muối đồng(II) sunfat, bazơ không tan và canxi sunfat.
![]()
Để thử nhanh thuốc diệt nấm này tức là phát hiện đồng(II) sunfat dư, người ta dùng đinh sắt: sắt tan ra, có kim loại Cu đỏ xuất hiện.
Fe + CuSO4 → FeSO4 + Cu↓
Câu 17: Cho m gam hỗn hợp X gồm Al, Cu vào dung dịch HCl dư, sinh ra 3,36 lít khí (ở đktc). Nếu cho m gam hỗn hợp X trên vào lượng dư axit nitric đặc, nguội, sinh ra 6,72 lít khí NO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của m là
A. 10,5.
B. 11,5.
C. 12,3.
D. 15,6.
Đáp án: C
Giải thích:
Gọi số mol Al và Cu trong m gam hỗn hợp X lần lượt là a và b mol
Trường hợp 1: Cho X vào HCl dư, chỉ có Al phản ứng
2Al + 6HCl → 2AlCl3 + 3H2 (0,15 mol)
→ nAl = 23nH2 = 23.0,15
= 0,1 mol
Trường hợp 2: Cho X vào HNO3 đặc, nguội Al bị thụ động, chỉ có Cu phản ứng
![]()
→ nCu = 12nNO2=12.0,3
= 0,15 mol
→ m = mAl + mCu
= 0,1.27 + 0,15.64 = 12,3 gam.
Câu 18: Trong tự nhiên, nguyên tố đồng có hai đồng vị là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,54. Phần trăm tổng số nguyên tử của đồng vị 65Cu là
A. 73%.
B. 27%.
C. 54%.
D. 50%.
Đáp án: B
Giải thích:
Gọi phần trăm số nguyên tử của 2 đồng vị 63Cu và 65Cu lần lượt là x và y (%)
→ x + y = 100 (1)
Nguyên tử khối trung bình của đồng là 63,54
→ 63x+65y100 = 63,54 (2)
Từ (1) và (2) ta được x = 73 và y = 27.
Câu 19: Kim loại Cu phản ứng được với dung dịch:
A. FeSO4.
B. AgNO3
C. KNO3.
D. HCl.
Đáp án: B
Giải thích:
Kim loại Cu chỉ phản ứng với dung dịch AgNO3
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Câu 20: Khối lượng tinh thể đồng (II) sunfat ngậm nước (CuSO4.5H2O) cần lấy để pha được 250 ml dung dịch CuSO4 0,15M là
A. 6,000 g.
B. 9,375 g.
C. 9,755 g.
D. 8,775 g.
Đáp án: B
Giải thích:
nCuSO4= 0,25.0,15
= 0,0375 mol
→ nCuSO4.5H2O = nCuSO4
=0,0375 mol
→ mCuSO4.5H2O = 0,0375.250
= 9,375 gam
Câu 21: Cho 4,32 g hỗn hợp X gồm Zn, Fe và Cu vào cốc đựng dung dịch chứa 0,082 mol CuSO4. Sau phản ứng thu được dung dịch Y và kết tủa Z. Kết tủa Z là
A. Cu, Zn.
B. Cu, Fe.
C. Cu, Fe, Zn.
D. Cu.
Đáp án: D
Giải thích:
4,3265<nFe,Zn<4,3256
→ 0,0664 < nFe, Zn < 0,077
Ta thấy chỉ có Zn và Fe phản ứng hết với CuSO4 mà nFe, Zn < nCuSO4 nên Zn và Fe phản ứng hết.
→ CuSO4 dư → Kết tủa chỉ có Cu
Câu 22: Cho dung dịch CuSO4 tác dụng vừa đủ với dung dịch Ba(OH)2 dư thu được 33,1 g kết tủa. Số mol CuSO4 và khối lượng chất rắn thu được sau khi nung kết tủa trên đến khối lượng không đổi là:
A. 0,1 mol; 33,1 g.
B. 0,1 mol; 31,3 g.
C. 0,12 mol; 23,3 g.
D. 0,08 mol; 28,2 g.
Đáp án: B
Giải thích:
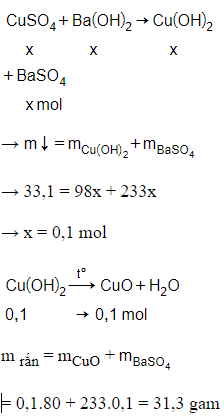
Câu 23: Đồng(II) oxit có thể điều chế bằng cách
A. nhiệt phân Cu(OH)2.
B. nhiệt phân Cu(NO3)2.
C. nhiệt phân Cu(OH)2.CuCO3.
D. cả A, B, C đều đúng.
Đáp án: D
Giải thích:
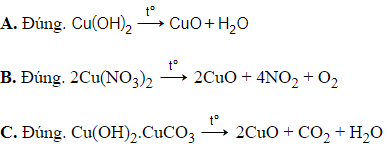
→ Cả cách A, B, C đều đúng.
Câu 24: Hoà tan 3,23 gam hỗn hợp gồm CuCl2 và Cu(NO3)2 vào nước được dung dịch X. Nhúng thanh kim loại Mg vào dung dịch X đến khi dung dịch mất màu xanh rồi lấy thanh Mg ra, cân lại thấy tăng thêm 0,8 gam. Khối lượng muối tạo ra trong dung dịch là:
A. 1,15 gam
B. 1,43 gam
C. 2,43 gam
D. 4,13 gam
Đáp án: C
Giải thích:
Khối lượng kim loại tăng 0,8 gam
→ khối lượng muối trong dung dịch giảm 0,8 gam
→ mmuối = 3,23 – 0,8 = 2,43 gam.
Câu 25: Cho 19,3 gam hỗn hợp bột gồm Zn và Cu có tỉ lệ mol tương ứng là 1 : 2 vào dung dịch chứa 0,2 mol Fe2(SO4)3. Sau khi các phản ứng xảy ra hoàn toàn, thu được m gam kim loại. Giá trị của m là:
A. 12,80
B. 12,00
C. 6,40
D. 16,53
Đáp án: C
Giải thích:
Theo bài ra có nZn = 0,1 mol;
nCu = 0,2 mol; nFe3+ = 0,4 mol
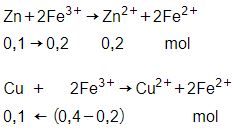
→ nCu dư = 0,2 – 0,1 = 0,1 mol
→ mCu = 0,1.64 = 6,4 gam
Câu 26: Điện phân (với điện cực trơ) 200 ml dung dịch CuSO4 nồng độ x mol/l, sau một thời gian thu được dung dịch Y vẫn còn màu xanh, có khối lượng giảm 8 gam so với khối lượng ban đầu. Cho 16,8 gam bột sắt vào Y, sau khi các phản ứng xảy ra hoàn toàn, thu được 12,4 gam kim loại. Giá trị của x là:
A. 1,25
B. 2,25
C. 1,50
D. 3,25
Đáp án: A
Giải thích:
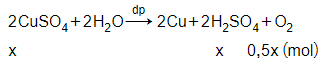
Gọi số mol Cu sinh ra là x mol
→ số mol O2 là 0,5x mol
→ mgiảm = mCu + mO2
→ 8 = 64x + 32.0,5x
→ x = 0,1 mol
→ Dung dịch Y chứa H2SO4: 0,1 mol và CuSO4 dư y mol
Khi cho 0,3 mol Fe vào dung dịch Y thu được dung dịch chứa FeSO4: 0,1 + y (mol)
→ Hỗn hợp kim loại gồm Fe dư:
0,3 – (0,1 + y) mol và Cu: y mol
→ 56 [0,3 – (0,1 + y)] + 64y = 12,4
→ y = 0,15 mol
→ Tổng số mol CuSO4 = x + y = 0,25 mol
→ x = 1,25.
Câu 27: Điện phân dung dịch X chứa hỗn hợp các muối sau: NaCl, CuCl2, FeCl3, ZnCl2. Kim loại cuối cùng thoát ra ở catot trước khi có khí thoát ra là:
A. Fe.
B. Cu.
C. Na.
D. Zn
Đáp án: D
Giải thích:
Cation có tính oxi hóa mạnh nhất sẽ bị khử trước
Sắp xếp theo thứ tự giảm dần tính oxi hóa:
Fe3+ > Cu2+ > Fe2+ > Zn2+
Na+ không bị điện phân.
→ Kim loại cuối cùng thoát ra là Zn
Câu 28: Cho hỗn hợp Al và Fe vào dung dịch chứa AgNO3 và Cu(NO3)2 được dung dịch X và chất rắn Y gồm 3 kim loại. Vậy chất rắn Y gồm:
A. Al, Fe, Cu
B. Fe, Cu, Ag
C. Al, Cu, Ag
D. Al, Fe, Ag
Đáp án: B
Giải thích:
Kim loại nào có tính khử yếu nhất sẽ bị đẩy ra trước.
→ Chất rắn Y gồm: Ag, Cu, Fe (dư).
Câu 29: Cho a mol hỗn hợp Fe, Cu tác dụng hết với a mol khí clo, sau phản ứng hoàn toàn thu được chất rắn X. Cho X vào nước thu được dung dịch Y. Thành phần chất tan có trong dung dịch Y là:
A. CuCl2, FeCl2 và FeCl3
B. FeCl2 và FeCl3
C. CuCl2 và FeCl3
D. CuCl2 và FeCl2
Đáp án: D
Giải thích:
Bảo toàn electron ta thấy:
2.nCl2 = 2(nFe + nCu) = 2a
→ Fe chỉ bị oxi hóa thành Fe(II)
→ Chất rắn Y gồm: FeCl2 và CuCl2
Câu 30: Xác định hàm lượng Sn có trong hợp kim Cu-Sn. Biết rằng trong hợp kim này, ứng với 1 mol Sn thì có 5 mol Cu
A. 27,1%
B. 29,5%
C. 30,7%
D. 23,7%
Đáp án: A
Giải thích:
Hàm lượng Sn có trong hợp kim này là:
%mSn = 119.1
= 27,1%
Các câu hỏi Trắc nghiệm Hóa học lớp 12 có đáp án, chọn lọc khác:
Trắc nghiệm Sơ lược về niken, kẽm, chì, thiếc có đáp án
Trắc nghiệm Luyện tập: Tính chất của sắt và hợp chất của sắt có đáp án
Trắc nghiệm Luyện tập: Tính chất hóa học của crom, đồng và hợp chất của chúng có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
