TOP 40 câu Trắc nghiệm Nhận biết một số ion trong dung dịch (có đáp án 2024) - Hóa học 12
Bộ 40 bài tập trắc nghiệm Hóa học lớp 12 Bài 40: Nhận biết một số ion trong dung dịch có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 12.
Trắc nghiệm Hóa học 12 Bài 40: Nhận biết một số ion trong dung dịch
Câu 1: Để phân biệt các dung dịch: Na2CO3, Na2S, Na2SO3, Na2SO4 người ta dùng thuốc thử nào sau đây:
A. Ba(OH)2
B. BaCl2
C. HCl
D. Quỳ tím
Đáp án: C
Giải thích:
Các muối cần nhận biết đều là muối của Na+, chúng chỉ khác nhau gốc axit, do đó thuốc thử cần dùng là thuốc thử có thể giúp nhận ra được các gốc axit này.
Khi đó thuốc thử thường dùng là các dung dịch axit mạnh như HCl, H2SO4,...Ta có cách nhận biết và hiện tượng quan sát được như sau: Khi cho dung dịch HCl vào các mẫu thử thì:
+ Mẫu thử phản ứng với dung dịch HCl và giải phóng khí không màu không mùi là Na2CO3
Na2CO3 + 2HCl → 2NaCl + 2CO2↑+ H2O
+ Mẫu thử phản ứng với dung dịch HCl giải phóng khí mùi trứng thối là Na2S
Na2S + 2HCl → 2NaCl + H2S↑
+ Mẫu thử phản ứng với dung dịch HCl giải phóng khí mùi hắc là Na2SO3
Na2SO3 + 2HCl → 2NaCl + 2SO2 + H2O↑
+ Mẫu thử không phản ứng mà chỉ tan trong dung dịch HCl là Na2SO4.
Câu 2: Thuốc thử nào dưới đây nhận biết được 3 dung dịch riêng biệt Na2CO3, MgCl2 và Al(NO3)3 (chỉ dùng một lần thử với mỗi dung dịch)?
A. dung dịch NaOH.
B. dung dịch HCl.
C. dung dịch BaCl2.
D. dung dịch H2SO4.
Đáp án: A
Giải thích:
Trích mẫu thử của 3 dung dịch ra 3 ống nghiệm có đánh số.
Sử dụng dung dịch NaOH nhỏ vào từng mẫu thử.
+ Nếu không xuất hiện hiện tượng gì → Na2CO3
+ Nếu xuất hiện kết tủa trắng không tan khi NaOH dư → MgCl2
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
+ Nếu xuất hiện kết tủa keo trắng, kết tủa tan khi NaOH dư → Al(NO3)3
Al(NO3)3 + 3NaOH → Al(OH)3↓ + 3NaNO3
Al(OH)3 ↓+ NaOH → NaAlO2 + 2H2O
Câu 3: Phân biệt các dung dịch sau: (NH4)2SO4, NaNO3, NH4NO3, Na2CO3 bằng phương pháp hoá học với hoá chất duy nhất là
A. NaOH
B. Ba(OH)2
C. HCl
D. H2SO4
Đáp án: B
Giải thích:
Trích mẫu thử của 4 dung dịch ra 4 ống nghiệm có đánh số.
Sử dụng dung dịch Ba(OH)2 nhỏ vào từng mẫu thử.
+ Nếu xuất hiện kết tủa trắng, kèm theo khí mùi khai thoát ra → (NH4)2SO4
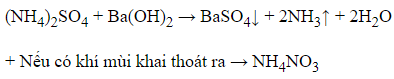
NH4+ + OH- → NH3↑ + H2O
+ Nếu có kết tủa trắng → Na2CO3
Ba2+ + CO32- → BaCO3↓
+ Không hiện tượng → NaNO3
Câu 4: Có 4 dung dịch mất nhãn riêng biệt sau: NaOH, H2SO4, HCl, Na2CO3. Chỉ dùng thêm hoá chất nào sau đây để phân biệt 4 dung dịch trên
A. Dung dịch BaCl2.
B. Dung dịch phenolphtalein.
C. Dung dịch NaHCO3.
D. Quỳ tím.
Đáp án: A
Giải thích:
Trích mẫu thử của 4 dung dịch ra 4 ống nghiệm có đánh số.
Sử dụng dung dịch BaCl2 nhỏ vào từng mẫu thử.
+ Nếu xuất hiện kết tủa trắng
→ H2SO4; Na2CO3 (nhóm I)
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
+ Nếu không có hiện tượng xuất hiện
→ NaOH; HCl (nhóm II)
Lấy lần lượt hóa chất ở nhóm II, cho vào từng kết tủa ở nhóm I
+ Nếu không xuất hiện hiện tượng gì ở mỗi kết tủa
→ Mẫu thử ở nhóm II là NaOH
+ Mẫu thử nhóm II là HCl: Nếu 1 kết tủa tan, có khí thoát ra (→ kết tủa là BaCO3 → mẫu thử ban đầu là Na2CO3); 1 kết tủa không tan (→ kết tủa là BaSO4 → mẫu thử ban đầu là H2SO4)
BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O
Câu 5: Có 6 chất rắn riêng biệt gồm CuO, FeO, Fe3O4, MnO2, Ag2O và hỗn hợp (Fe + FeO). Có thể dùng dung dịch chứa chất nào sau đây để phân biệt 6 chất rắn trên?
A. H2SO4 đặc, nguội
B. HCl, đun nóng
C. HNO3 loãng
D. H2SO4 loãng
Đáp án: B
Giải thích:
Thuốc thử cần dùng là dung dịch HCl, đun nóng
+) CuO + HCl → dung dịch màu xanh dương
CuO + 2HCl → CuCl2 + H2O
+) FeO + HCl → dung dịch màu xanh nhạt (gần như không màu)
FeO + 2HCl → FeCl2 + H2O
+) Fe3O4 + HCl → dung dịch màu vàng
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
+) MnO2 + HCl → tạo khí màu vàng lục
MnO2 + 4HCl → MnCl2 + Cl2↑ + 2H2O
+) Ag2O + HCl → chất rắn chuyển nâu đen sang trắng
Ag2O↓ (đen) + 2HCl → 2AgCl↓ (trắng) + H2O
+) (Fe + FeO ) + HCl → khí, dung dịch màu xanh nhạt
Fe + 2HCl → FeCl2 + H2↑
FeO + 2HCl → FeCl2 + H2O
Câu 6: Muối ăn bị lẫn các tạp chất là Na2SO4, MgCl2, CaCl2 và CaSO4, để thu được NaCl tinh khiết, người ta lần lượt dùng các dung dịch
A. NaOH dư, Na2CO3 dư, H2SO4 dư, rồi cô cạn.
B. BaCl2 dư, Na2CO3 dư, HCl dư, rồi cô cạn.
C. Na2CO3 dư, HCl dư, BaCl2 dư, rồi cô cạn.
D. Ba(OH)2 dư, Na2SO4 dư, HCl dư, rồi cô cạn.
Đáp án: B
Giải thích:
Bước 1. Dùng dung dịch BaCl2
Ba2+ + SO42− → BaSO4
Lọc kết tủa được dung dịch gồm:
Na+, Mg2+, Ca2+, Ba2+, Cl-
Bước 2. Thêm dung dịch Na2CO3 dư
R2+ + CO32− → RCO3
(R2+ là Mg2+, Ba2+, Ca2+)
Lọc kết tủa thu được dung dịch gồm:
Na+, CO32−, Cl-
Bước 3. Dùng dung dịch HCl
CO32− + 2H+ → CO2 + H2O
Cô cạn dung dịch thu được NaCl
Câu 7: Để phân biệt dung dịch NaNO3 với Na2SO4 có thể dùng thuốc thử nào sau đây?
A. Quỳ tím.
B. Ba(NO3)2.
C. BaCO3.
D. Fe.
Đáp án: B
Giải thích:
Trích mẫu thử của 2 dung dịch ra 2 ống nghiệm có đánh số
Nhỏ dung dịch Ba(NO3)2 vào hai mẫu thử:
+ Xuất hiện kết tủa trắng: Na2SO4
Ba(NO3)2 + Na2SO4 → BaSO4↓ + NaNO3
+ Không có hiện tượng gì: NaNO3
Câu 8: Để phân biệt các dung dịch riêng biệt: CuSO4, FeCl3, Al2(SO4)3, K2CO3, (NH4)2SO4, NH4NO3, người ta có thể dùng thuốc thử nào sau đây?
A. Kim loại K
B. Kim loại Ba
C. Dung dịch NaOH
D. Dung dịch BaCl2
Đáp án: B
Giải thích:
Trích các mẫu thử của 6 dung dịch ra 6 ống nghiệm có đánh số.
Thả vào mỗi ống nghiệm một mẩu Ba. Khi đó Ba phản ứng với nước trong dung dịch sinh ra Ba(OH)2 và giải phóng khí H2 trước.
Ba + 2H2O → Ba(OH)2 + H2↑
+ Ống nghiệm xuất hiện kết tủa trắng, lẫn kết tủa xanh → CuSO4.
CuSO4 + Ba(OH)2 → Cu(OH)2↓ + BaSO4↓.
+ Ống nghiệm xuất hiện kết tủa nâu đỏ → FeCl3
2FeCl3 + 3Ba(OH)2 → 3BaCl2 + 2Fe(OH)3↓
+ Ống nghiệm xuất hiện kết tủa, sau đó kết tủa tan một phần → Al2(SO4)3
Al2(SO4)3 + 3Ba(OH)2 → 3BaSO4↓ + 2Al(OH)3↓
2Al(OH)3 + Ba(OH)2 → Ba(AlO2)2 + 4H2O
+ Ống nghiệm chỉ xuất hiện kết tủa trắng
→ K2CO3
K2CO3 + Ba(OH)2 → 2KOH + BaCO3↓
+ Ống nghiệm xuất hiện kết tủa trắng đồng thời có khí mù khai bay ra
→ (NH4)2SO4.
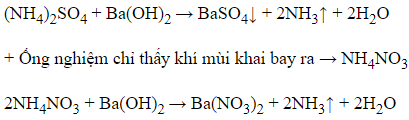
Câu 9: Chọn một thuốc thử dưới đây để nhận biết được các dung dịch sau: HCl, KI, ZnBr2, Mg(NO3)2.
A. Dung dịch AgNO3
B. Dung dịch NaOH
C. Giấy quỳ tím
D. Dung dịch NH3
Đáp án: A
Giải thích:
Sử dụng dung dịch AgNO3 để nhận biết:
+ Dung dịch phản ứng với AgNO3 làm xuất hiện kết tủa trắng là HCl:
AgNO3 + HCl → AgCl↓ + HNO3
+ Dung dịch phản ứng với AgNO3 làm xuất hiện kết tủa vàng đậm là KI:
AgNO3 + KI → AgI↓ + KNO3
+ Dung dịch phản ứng với AgNO3 làm xuất hiện kết tủa vàng nhạt là ZnBr2:
2AgNO3 + ZnBr2 → Zn(NO3)2 + 2AgBr↓
+ Dung dịch khi cho AgNO3 không có hiện tượng gì là Mg(NO3)2
Câu 10: Thuốc thử duy nhất dùng để phân biệt 4 dung dịch BaCl2, H2SO4, HCl, NaCl bị mất nhãn là:
A. dung dịch AgNO3
B. quỳ tím
C. dung dịch Ba(OH)2
D. dung dịch NaCl
Đáp án: B
Giải thích:
- Dùng quỳ tím phân 4 mẫu thử thành 2 nhóm:
+ Nhóm 1: Nhóm các mẫu thử làm quỳ tím hóa đỏ: H2SO4 và HCl.
+ Nhóm 2: Nhóm mẫu thử không làm đổi màu quỳ tím: BaCl2 và NaCl.
- Lấy lần lượt các mẫu thử thuộc nhóm 1 cho vào các mẫu thử thuộc nhóm 2, mẫu thử nào phản ứng với nhau tạo kết tủa trắng là H2SO4 (nhóm 1) và BaCl2 (nhóm 2).
H2SO4 + BaCl2 → BaSO4↓ + HCl
Câu 11: Hoá chất nào sau đây có thể sử dụng để phân biệt 3 dung dịch sau: NaCl, CaCl2 và A1Cl3.
A. Na2CO3
B. H2SO4 loãng
C. dung dịch Na2SO4
D. dung dịch HCl
Đáp án: A
Giải thích:
Hiện tượng khi cho dung dịch Na2CO3 vào các mẫu thử:
+ Mẫu thử không có hiện tượng: NaCl.
+ Mẫu thử xuất hiện kết tủa trắng là CaCl2:
Ca2+ + CO2−3→CaCO3 ↓
+ Mẫu thử xuất hiện khí không màu và kết tủa keo trắng là A1Cl3:
![]()
Câu 12: Để phân biệt các dung dịch NaOH, NaCl, CuCl2, FeCl3, FeCl2, NH4Cl, A1Cl3, MgCl2. Ta chỉ cần dùng một thuốc thử duy nhất, thuốc thử không thõa mãn là:
A. Dung dịch H2SO4 loãng
B. Dung dịch Na2CO3
C. Quỳ tím
D. Dung dịch KOH
Đáp án: A
Giải thích:
A. Khi cho dung dịch H2SO4 loãng vào các mẫu thử thì tất cả các mẫu thử đều không quan sát được hiện tượng. Do đó dung dịch H2SO4 loãng không phải là thuốc thử thỏa mãn.
B. Sử dụng dung dịch Na2CO3 làm thuốc thử thì ban đầu ta nhận biết được như sau:
+ Mẫu thử phản ứng với dung dịch Na2CO3 tạo kết tủa đỏ nâu và giải phóng khí không màu là:
![]()
+ Mẫu thử phản ứng với dung dịch Na2CO3 tạo kết tủa keo trắng và giải phóng khí không màu là:
![]()
+ Các mẫu thử phản ứng với dung dịch Na2CO3 tạo kết tủa là: CuCl2, FeCl2 và MgCl2.
CuCl2 + Na2CO3 → CuCO3↓+ 2NaCl
FeCl2 + Na2CO3 → FeCO3↓+ 2NaCl
MgCl2 + Na2CO3 → MgCO3↓+ 2NaCl
+ Các mẫu thử không phản ứng với dung dịch Na2CO3 (quan sát không thấy hiện tượng gì) gồm NaCl, NaOH và NH4Cl.
- Sử dụng dung dịch FeCl3 vừa nhận biết được ở trên để phân biệt 3 dung dịch NaCl, NaOH va NH4Cl, mẫu thử phản ứng với dung dịch FeCl3 tạo kết tủa đỏ nâu là NaOH, mẫu thử không phản ứng là NaCl và NH4Cl: FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
- Sử dụng dung dịch NaOH vừa nhận biết được để phân biệt 2 dung dịch NaCl và NH4Cl, mẫu thử phản ứng với dung dịch NaOH và giải phóng khí mùi khai là NH4Cl:
NH4Cl + NaOH → NaCl + NH3↑ + H2O
- Sử dụng dung dịch NaOH vừa nhận biết được ở trên để nhận biết các thuốc thử còn lại (CuCl2, FeCl2 và MgCl2):
+ Mẫu thử phản ứng với dung dịch NaOH tạo kết tủa màu xanh lam là CuCl2
CuCl2 + 2NaOH → Cu(OH)2↓+ 2NaCl
+ Mẫu thử phản ứng với dung dịch NaOH tạo kết tủa màu trắng xanh là FeCl2
FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl
+ Mẫu thử phản ứng với dung dịch NaOH tạo kết tủa màu trắng là MgCl2
MgCl2 + 2NaOH → Mg(OH)2↓ +2NaCl
C. Khi sử dụng quỳ tím làm thuốc thử, ban đầu ta phân các mẫu thử thành 3 nhóm:
+ Nhóm mẫu thử làm quỳ tím hóa xanh là NaOH.
+ Nhóm mẫu thử làm quỳ tím không đổi màu là NaCl.
+ Nhóm mẫu thử làm quỳ tím hóa đỏ gồm CuCl2, FeCl3, FeCl2, NH4Cl, AlCl3 và MgCl2.
- Sử dụng dung dịch NaOH vừa nhận được ở trên để nhận biết các mẫu thử còn lại:
+ Mẫu thử phản ứng với dung dịch NaOH tạo kết tủa màu xanh lam là CuCl2
CuCl2 + 2NaOH → Cu(OH)2↓ +2NaCl
+ Mẫu thử phản ứng với dung dịch NaOH tạo kết tủa màu đỏ nâu là FeCl3
FeCl3 + 3NaOH → Fe(OH)3↓ +2NaCl
+ Mẫu thử phản ứng với dung dịch NaOH tạo kết tủa màu trắng xanh là FeCl2
FeCl2 + 2NaOH → Fe(OH)2↓ +2NaCl
+ Mẫu thử phản ứng với dung dịch NaOH giải phóng khí mùi khai là NH4Cl:
NH4Cl + NaOH → NaCl + NH3↑ + H2O
+ Mẫu thử phản ứng với dung dịch NaOH tạo kết tủa keo trắng, sau đó kết tủa tan trong thuốc thử dư là AlCl3:
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
+ Mẫu thử phản ứng với dung dịch NaOH tạo kết tủa màu trắng là MgCl2:
MgCl2 + 2NaOH → Mg(OH)2↓ +2NaCl
D. Khi sử dụng dung dịch KOH làm thuốc thử thì các hiện tượng và nhận biết là:
+ Chất tác dụng với dung dịch KOH xuất hiện kết tủa xanh lam là CuCl2
CuCl2 + 2KOH → Cu(OH)2↓+ 2KCl
+ Chất tác dụng với dung dịch KOH xuất hiện kết tủa đỏ nâu là FeCl3
FeCl3 + 3KOH → Fe(OH)3↓ + 2KCl
+ Chất tác dụng với dung dịch KOH xuất hiện kết tủa trắng xanh, hóa nâu trong không khí là FeCl2
FeCl2 + 2KOH → Fe(OH)2↓ +2KCl
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
+ Chất tác dụng với dung dịch KOH xuất hiện khí mùi khai là NH4Cl:
NH4Cl + KOH → KCl + NH3↑ + H2O
+ Chất tác dụng với dung dịch KOH xuất hiện kết tủa keo trắng, sau đó kết tủa này tan trong dung dịch KOH dư là AlCl3
AlCl3 + 3KOH → Al(OH)3 + 3KCl
Al(OH)3 + KOH → KAlO2 + 2H2O
+ Chất tác dụng với dung dịch KOH xuất hiện kết tủa trắng là MgCl2 :
MgCl2 + 2KOH → Mg(OH)2↓+ 2KCl
+ Chất khi cho dung dịch KOH vào thì không có hiện tượng (không phản ứng) là NaOH và NaCl
Sau đó cho dung dịch CuCl2 vào hai mẫu thử còn lại, mẫu thử phản ứng với CuCl2 xuất hiện kết tủa xanh lam là NaOH, mẫu thử mà không hiện tượng là NaCl :
CuCl2 + 2NaOH → Cu(OH)2↓+2NaCl
+ Khi đổ dung dịch HNO3 loãng vào các mẫu thử thì thuốc thử phản ứng xuất hiện khí không màu hóa nâu trong không khí là FeCl2:
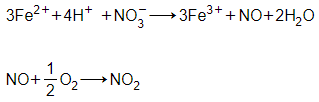
Trong đó NO là khí không màu và NO2 là khí màu nâu đỏ.
+ Chọn dung dịch FeCl2 vừa nhận biết được ở trên làm thuốc thử để nhận biết các dung dịch còn lại. Khi đổ dung dịch FeCl2 vào các mẫu thử thì mẫu thử phản ứng tạo kết tủa trắng xanh là NaOH, các mẫu thử còn lại không có hiện tượng:
FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl
+ Dùng dung dịch NaOH vừa nhận biết được để làm thuốc thử nhận biết các dung dịch còn lại:
Dung dịch phản ứng tạo kết tủa xanh lam là CuCl2:
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Dung dịch phản ứng tạo kết tủa đỏ nâu là FeCl3:
FeCl3 + 3NaOH → Fe(OH)3↓ + 2NaCl
Dung dịch phản ứng giải phóng khí không màu mùi khai là NH4Cl:
NH4Cl + NaOH → NaCl + NH3↑+ H2O
Dung dịch phản ứng tạo kết tủa keo trắng và tan trong kiềm dư là AlCl3:
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
Dung dịch phản ứng tạo kết tủa trắng là MgCl2:
MgCl2 + 2NaOH → Mg(OH)2↓ + 2NaCl
- Dung dịch không có hiện tượng là NaCl.
Câu 13: Có thể phân biệt 3 dung dịch: KOH, HCl, H2SO4 (loãng) bằng một thuốc thử là
A. giấy quỳ tím
B. Zn
C. Al
D. BaCO3
Đáp án: D
Giải thích:
Trích mẫu thử của ba dung dịch ra ba ống nghiệm có đánh số
Các hiện tượng và nhận biết:
+) Dung dịch không hòa tan được BaCO3 là KOH.
+) Dung dịch hòa tan được BaCO3 và giải phóng khí không màu là HCl:
BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O
+) Dung dịch hòa tan được BaCO3, giải phóng khí không màu đồng thời xuất hiện kết tủa trắng không tan trong mẫu thử dư là dung dịch H2SO4 :
BaCO3 + H2SO4 → BaSO4↓+ CO2↑ + H2O
Câu 14: Cho các dung dịch sau: Na2CO3, NH4NO3, NaNO3, phenolphtalein. Chỉ dùng một hóa chất nào sau đây để phân biệt được tất cả dung dịch trên:
A. BaCl2
B. Ba(OH)2
C. HCl
D. Tất cả đều sai
Đáp án: B
Giải thích:
Sử dụng dung dịch Ba(OH)2 làm thuốc thử thì ta nhận biết được các chất như sau:
+ Dung dịch phản ứng với thuốc thử làm xuất hiện kết tủa trắng là Na2CO3:
Na2CO3 + Ba(OH)2 → BaCO3↓ + 2NaOH
+ Dung dịch phản ứng với thuốc thử giải phóng khí mùi khai là NH4NO3 :
![]()
+ Dung dịch mà khi cho thuốc thử vào chuyển sang màu đỏ là phenolphatlein.
+ Dung dịch mà khi cho thuốc thử vào không có hiện tượng là NaNO3.
Câu 15: Có 3 lọ riêng biệt đựng ba dung dịch không màu, mất nhãn là HCl, HNO3, H2SO4. Có thể dùng thuốc thử nào dưới đây để phân biệt 3 dung dịch trên?
A. giấy quỳ tím, dung dịch bazơ
B. dung dịch BaCl2; Cu
C. dung dịch AgNO3; Na2CO3
D. dung dịch phenolphtalein
Đáp án: B
Giải thích:
Trích mẫu thử của 3 dung dịch ra 3 ống nghiệm có đánh số.
+ Mẫu thử phản ứng với BaCl2 xuất hiện kết tủa trắng là H2SO4.
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
+ Mẫu thử hòa tan Cu giải phóng khí không màu hóa nâu trong không khí là HNO3.
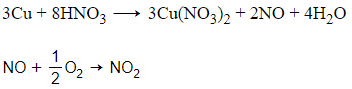
+ Mẫu thử còn lại là HCl.
Câu 16: Nhận biết 3 dung dịch FeCl3, FeCl2, AlCl3 ở 3 bình mất nhãn mà chỉ dùng một thuốc thử. Thuốc thử đó là:
A. Dung dịch NaOH
B. Dung dịch KOH
C. Dung dịch Ba(OH)2
D. Cả A, B, C đều đúng
Đáp án: D
Giải thích:
Trích mẫu thử của ba dung dịch ra 3 ống nghiệm có đánh số
Ta sử dụng ion OH- để nhận biết các dung dịch trên
Hiện tượng quan sát và nhận biết khi cho dung dịch chứa OH- vào các mẫu thử :
+ Xuất hiện kết tủa nâu đỏ → FeCl3
Fe3+ + 3OH- → Fe(OH)3↓
+ Xuất hiện kết tủa trắng xanh → FeCl2
Fe2+ + 2OH- → Fe(OH)2↓
+ Xuất hiện kết tủa keo trắng tan trong OH- dư → Al3+
Al3+ + 3OH- → Al(OH)3↓
Al(OH)3 + OH- → AlO2− + 2H2O
→ Cả ba thuốc thử NaOH, KOH, Ba(OH)2 đều có thể sử dụng được.
Câu 17: Chỉ dùng dung dịch nào dưới đây để phân biệt các dung dịch mất nhãn không màu: NH4NO3, NaCl, (NH4)2SO4, Mg(NO3)2, FeCl2 ?
A. BaCl2
B. NaOH
C. AgNO3
D. Ba(OH)2
Đáp án: D
Giải thích:
- Đánh số thứ tự từng lọ mất nhãn, trích mỗi lọ một ít sang ống nghiệm đánh số tương ứng.
- Sử dụng dung dịch Ba(OH)2
+ Có khí mùi khai bay ra: NH4NO3
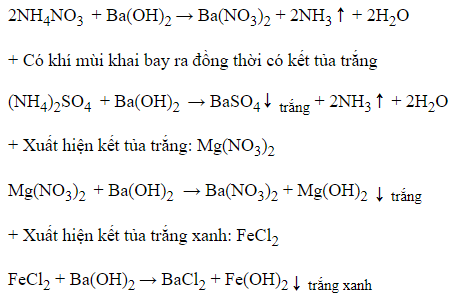
+ Không có hiện tượng gì: NaCl
Câu 18: Để phân biệt các dung dịch hóa chất riêng biệt KOH, (NH4)2SO4, NH4Cl, Na2SO4 người ta có thể dùng hóa chất nào sau đây:
A. dung dịch BaCl2
B. dung dịch Ba(OH)2
C. dung dịch AgNO3
D. Ca(OH)2
Đáp án: B
Giải thích:
Sử dụng dung dịch Ba(OH)2
+ Không hiện tượng: KOH.
+ Xuất hiện kết tủa trắng đồng thời có khí mùi khai: (NH4)2SO4
Phương trình hóa học:
![]()
+ Chỉ có khí mùi khai: NH4Cl
Phương trình hóa học:
2NH4Cl + Ba(OH)2 → BaCl2 + 2NH3↑+ 2H2O
+ Chỉ có kết tủa trắng: Na2SO4
Phương trình hóa học:
Na2SO4 + Ba(OH)2 → BaSO4 (↓ trắng) + 2NaOH
Câu 19: Có bốn dung dịch đựng riêng biệt trong bốn ống nghiệm không dán nhãn: K2CO3, FeCl2, NaCl, CrCl3. Nếu chỉ dùng một thuốc thử duy nhất là dung dịch Ba(OH)2 thì nhận biết được tối đa bao nhiêu dung dịch trong số các dung dịch trên?
A. 3
B. 4
C. 2
D. 1
Đáp án: B
Giải thích:
Cho Ba(OH)2 phản ứng lần lượt với từng chất:
- Có kết tủa trắng xuất hiện, không tan trong Ba(OH)2 dư: dung dịch là K2CO3.
Ba(OH)2 + K2CO3 → BaCO3↓ + 2KOH
- Có kết tủa trắng xanh xuất hiện, để lâu kết tủa chuyển màu nâu đỏ: dung dịch là FeCl2.
FeCl2 + Ba(OH)2 → BaCl2 + Fe(OH)2↓
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3↓
- Có kết tủa trắng xuất hiện, tan khi thêm dư Ba(OH)2: dung dịch là CrCl3.
3Ba(OH)2 + 2CrCl3 → 2Cr(OH)3↓ + 3BaCl2
2Cr(OH)3 + Ba(OH)2 → Ba(CrO2)2 + 4H2O
- Không có hiện tượng gì: dung dịch là NaCl.
Câu 20: Cho 4 lọ dung dịch riêng biệt X, Y, Z, T chứa các chất khác nhau trong số 4 chất: (NH4)2CO3, NaHCO3, NaNO3, NH4NO3. Thực hiện nhận biết bốn dung dịch trên bằng dung dịch Ba(OH)2 thu được kết quả sau:
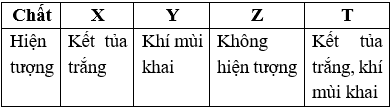
Nhận xét nào sau đây đúng?
A. Z là dung dịch NH4NO3
B. Y là dung dịch NaHCO3
C. X là dung dịch NaNO3
D. T là dung dịch (NH4)2CO3
Đáp án: D
Giải thích:
+) X + Ba(OH)2 → Kết tủa trắng
→ X là NaHCO3.
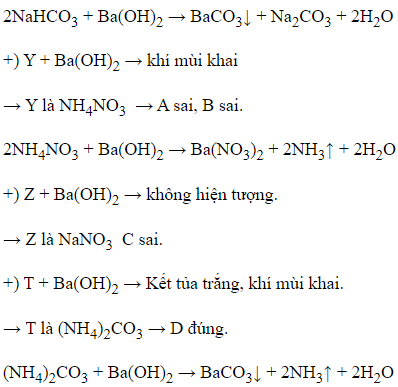
Câu 21: Thuốc thử dùng để phân biệt 3 dung dịch riêng biệt NaCl, NaHSO4, HCl là
A. BaCl2.
B. BaCO3.
C. NH4Cl.
D. (NH4)2CO3.
Đáp án: B
Giải thích:
Dùng BaCO3 vì:
![]()
BaCO3 + 2HCl → BaCl2 + CO2↑ + H2O
BaCO3 không tác dụng với NaCl.
Câu 22: Chỉ dùng một thuốc thử nào sau đây có thể phân biệt được các dung dịch: KCl, KBr, KI, KF?
A. Quỳ tím
B. H2O
C. AgNO3
D. HCl
Đáp án: C
Giải thích:
Trích mẫu thử của mỗi dung dịch ra từng ống nghiệm có đánh số tương ứng.
Nhỏ dung dịch AgNO3 vào từng mẫu thử để phân biệt
+ Xuất hiện kết tủa trắng: KCl
KCl + AgNO3 → AgCl (↓ trắng) + KNO3
+ Xuất hiện kết tủa vàng nhạt: KBr
KBr + AgNO3 → AgBr (↓ vàng nhạt) + KNO3
+ Xuất hiện kết tủa vàng đậm: KI
KI + AgNO3 → AgI (↓ vàng đậm) + KNO3
+ Không có hiện tượng gì: KF
Câu 23: Thuốc thử nào sau đây có thể dùng để nhận biết các dung dịch Na2S, NaCl, NaBr?
A. HCl
B. Quỳ tím
C. H2O
D. AgNO3
Đáp án: D
Giải thích:
Trích mẫu thử của các dung dịch ra từng ống nghiệm có đánh số.
Ta nhỏ dung dịch AgNO3 vào từng mẫu thử
- Xuất hiện kết đen thì đó là Na2S
Na2S + AgNO3 → NaNO3 + AgS(↓ đen)
- Xuất hiện kết tủa trắng thì đó là NaCl
NaCl + AgNO3 → NaNO3 + AgCl (↓ trắng)
- Xuất hiện kết tủa vàng nhạt thì đó là NaBr
NaBr + AgNO3 → NaNO3 + AgBr(↓ vàng nhạt)
Câu 24: Phân biệt các dung dịch sau mất nhãn: NH4HCO3, (NH4)2CO3, NaHCO3, NH4NO3, Na2CO3, HCl, H2SO4. Có thể dùng thuốc thử nào sau đây?
A. Dung dịch Ba(OH)2
B. Dung dịch BaCl2
C. Quỳ tím
D. Cả dung dịch Ba(OH)2 và BaCl2
Đáp án: D
Giải thích:
- Trích mẫu thử của mỗi chất cho ra các ống nghiệm khác nhau và đánh số thứ tự tương ứng.
- Cho dung dịch Ba(OH)2 vào các dung dịch trên
+ Dung dịch xuất hiện kết tủa trắng và mùi khai là: NH4HCO3 và (NH4)2CO3 (nhóm I)
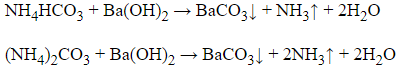
+ Dung dịch chỉ xuất hiện kết tủa trắng là: NaHCO3, Na2CO3 và H2SO4 (nhóm II)
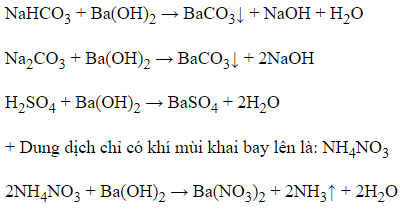
+ Dung dịch không có hiện tượng gì là HCl
2HCl + Ba(OH)2 → BaCl2 + 2H2O
- Lấy dung dịch HCl đã nhận biết được nhỏ lần lượt vào kết tủa vừa thu được ở nhóm II
+ Kết tủa tan là BaCO3 → dung dịch ban đầu là: NaHCO3 và Na2CO3 (nhóm III)
BaCO3 + 2HCl → BaCl2 + H2O + CO2
+ Kết tủa không tan là BaSO4 → dung dịch ban đầu là H2SO4
- Cho dd BaCl2 lần lượt vào các chất ở nhóm (I), nhóm (III)
+ Nhóm I: xuất hiện kết tủa trắng là (NH4)2CO3 còn lại không có hiện tượng gì là NH4HCO3
(NH4)2CO3 + BaCl2 → BaCO3↓ + NH4Cl
+ Nhóm II: xuất hiện kết tủa trắng là Na2CO3 còn lại không có hiện tượng gì là NaHCO3
Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl
Câu 25: Để phân biệt các dung dịch: CaCl2, HCl, Ca(OH)2 dùng dung dịch?
A. NaNO3.
B. NaOH.
C. NaHCO3.
D. NaCl.
Đáp án: C
Giải thích:
Cho NaHCO3 lần lượt vào các chất
Có khí thát ra là HCl, Có kết tủa xuất hiện là Ca(OH)2, còn lại không có hiện tượng gì là CaCl2
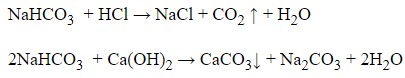
Câu 26: Cho các mẫu phân bón sau: KCl, Ca(H2PO4)2, NH4H2PO4 và NH4NO3. Dùng hóa chất nào sau đây có thể phân biệt được các mẫu phân bón trên?
A. dung dịch NaOH
B. dung dịch Ca(OH)2
C. dung dịch BaCl2
D. dung dịch AgNO3
Đáp án: B
Giải thích:
Cho dung dịch Ca(OH)2 dư vào các mẫu phân bón trên
- Nếu xuất hiện kết tủa trắng thì đó là Ca(H2PO4)2
Ca(H2PO4)2 + 2Ca(OH)2 → Ca3(PO4)2 (↓ trắng) + 4H2O
- Nếu vừa xuất hiện kết tủa trắng vừa có khí mùi khai thì đó là NH4H2PO4
2NH4H2PO4 + 3Ca(OH)2 → Ca3(PO4)2 (↓ trắng) + 2NH3↑ + 6H2O
- Nếu chỉ xuất hiện khí có mùi khai thì đó là NH4NO3
2NH4NO3 + Ca(OH)2 → Ca(NO3)2 + 2NH3↑ + 2H2O
- Không thấy hiện tượng gì là KCl.
Câu 27: Có thể phân biệt 3 dung dịch: KOH, HCl, H2SO4 (loãng) bằng một thuốc thử là
A. giấy quỳ tím.
B. Zn.
C. Al.
D. BaCO3.
Đáp án: D
Giải thích:
- Dùng quì tím: chỉ nhận biết được dung dịch KOH.
- Dùng Zn, Al: không nhận biết được.
- Dùng BaCO3:
+ Cho vào dung dịch KOH không có hiện tượng
+ Cho vào dung dịch HCl có khí bay lên
BaCO3 + 2HCl → BaCl2 + CO2↓ + H2O
+ Cho vào dung dịch H2SO4: có khí bay lên và kết tủa trắng
BaCO3 + H2SO4 → BaSO4↓ + CO2↑ + H2O
Câu 28: Để phân biệt các dung dịch riêng biệt: NH4Cl, MgCl2, AlCl3, NaNO3 có thể dùng dung dịch
A. HCl.
B. HNO3.
C. Na2SO4.
D. NaOH.
Đáp án: D
Giải thích:
Trích mẫu thử của 4 dung dịch ra 4 ống nghiệm có đánh số.
Nhỏ dung dịch NaOH lần lượt vào 4 mẫu thử.
- Mẫu thử xuất hiện khí có mùi khai → NH4Cl
NH4Cl + NaOH → NaCl + NH3↑ + H2O
- Xuất hiện kết tủa màu trắng, không tan trong NaOH dư → MgCl2
MgCl2 + NaOH → Mg(OH)2↓ + NaCl
- Xuất hiện kết tủa keo trắng, tan trong NaOH dư → AlCl3
AlCl3 + 3NaOH → Al(OH)3↓ + 3NaCl
Al(OH)3 + NaOH → NaAlO2 + 2H2O
- Không có hiện tượng gì → NaNO3
Câu 29: Có 5 dung dịch riêng rẽ, mỗi dung dịch chứa 1 cation: NH4+, Mg2+, Fe3+, Al3+, Na+, nồng độ khoảng 0,1M. Bằng cách dùng dung dịch NaOH cho lần lượt vào từng dung dịch, có thể nhận biết được tối đa:
A. Ba dung dịch chứa ion: NH4+, Fe3+, Al3+
B. Hai dung dịch chứa ion: NH4+, Al3+
C. Dung dịch chứa ion: NH4+
D. Năm dung dịch chứa ion: NH4+, Mg2+, Fe3+, Al3+, Na+
Đáp án: D
Giải thích:
Khi dùng NaOH:
+) NH4+ + OH- → NH3↑ + H2O (sủi bọt khí)
+) Mg2+ + 2OH- → Mg(OH)2 (kết tủa trắng)
+) Fe3+ + 3OH- → Fe(OH)3 (kết tủa vàng nâu)
+) Al3+ + 3OH- → Al(OH)3 (kết tủa keo trắng)
Al(OH)3 + OH- → AlO2- + 2H2O (kết tủa tan)
+) Na+: Không có hiện tượng.
Câu 30: Cho các ion Na+, K+, NH4+, Ba2+, Al3+, Ca2+. Số ion có thể nhận biết bằng thử màu ngọn lửa là
A. 2
B. 3
C. 4
D. 5
Đáp án: C
Giải thích:
Muối của K cháy với ngọn lửa màu tím
Muối của Na cháy với ngọn lửa màu vàng
Muối của Ba cháy với ngọn lửa màu vàng lục
Muối của Ca cháy với ngọn lửa màu vàng cam
Các câu hỏi Trắc nghiệm Hóa học lớp 12 có đáp án, chọn lọc khác:
Trắc nghiệm Nhận biết một số chất khí có đáp án
Trắc nghiệm Luyện tập: Nhận biết một số chất vô cơ có đáp án
Trắc nghiệm Hóa học và vấn đề phát triển kinh tế có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
