TOP 40 câu Trắc nghiệm Luyện tập tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng (có đáp án 2024) - Hóa học 12
Bộ 40 bài tập trắc nghiệm Hóa học lớp 12 Bài 28: Luyện tập tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 12
Trắc nghiệm Hóa học 12 Bài 28: Luyện tập tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng
Câu 1: Chất nào được dùng làm thuốc để giảm đau dạ dày do thừa axit:
A. CaCO3
B. Na2CO3
C. K2CO3
D. NaHCO3
Đáp án: B
Giải thích:
Natri hiđrocacbonat (thuốc muối) được dùng để giảm đau dạ dày do thừa axit
Natri hiđrocacbonat có khả năng trung hòa axit trong dạ dày
NaHCO3 + HCl → NaCl + H2O + CO2
Câu 2: Khi dẫn từ từ khí CO2 đến dư vào dung dịch Ca(OH)2 thấy có
A. bọt khí và kết tủa trắng.
B. bọt khí bay ra.
C. kết tủa trắng xuất hiện.
D. kết tủa trắng, sau đó kết tủa tan dần.
Đáp án: D
Giải thích:
+ Xuất hiện kết tủa trắng:
CO2 + Ca(OH)2 → CaCO3 trắng + H2O
+ CO2 dư kết tủa tan dần:
CO2 + CaCO3 + H2O → Ca(HCO3)2
Câu 3: Các tính chất vật lí (nhiệt độ sôi, nhiệt độ nóng chảy, khối lượng riêng) của các kim loại trong nhóm IA biến đổi có quy luật, trong đó các kim loại nhóm IIA biến đổi không theo quy luật. Để giải thích hiện tượng này có thể dựa vào
A. điện tích hạt nhân của các nguyên tử.
B. cấu trúc mạng tinh thể.
C. bán kính ion.
D. độ hoạt động hoá học.
Đáp án: B
Giải thích:
- Các tính chất vật lí (nhiệt độ sôi, nhiệt độ nóng chảy, khối lượng riêng) của các kim loại trong nhóm IA biến đổi có quy luật vì các kim loại đều có cấu tạo mạng tinh thể lập phương tâm khối.
- Kim loại kiềm thổ (kim loại nhóm IIA) không có cùng cấu tạo mạng tinh thể nên tính chất vật lí biến đổi không có tính quy luật.
+ Be, Mg: mạng tinh thể lục phương
+ Ca, Cr: mạng tinh thể lập phương tâm diện.
+ Ba: mạng tinh thể lập phương tâm khối
Câu 4: Cho 7,1 gam hỗn hợp gồm một kim loại kiềm X và một kim loại kiềm thổ Y tác dụng với lượng dư dung dịch HCl loãng thu được 5,6 lít khí. Hai kim loại X, Y có thể là
A. K và Ba
B. K và Ca.
C. Na và Mg.
D. Li và Be.
Đáp án: C
Giải thích:
Gọi nguyên tử khối trung bình của hai kim loại là A, tổng số mol là n, hoá trị trung bình là x (1 < x < 2).
Ta có: An = 7,1 (1)
Bảo toàn electron: nKL. Hóa trị = 2.
→ xn = 0,5 (2)
Từ (1) và (2) → = 14,2
Vì 1< x < 2
→ 14,2 < A < 28,4
Chỉ có cặp Na và Mg thoả mãn
Câu 5: Hòa tan 7,8 gam hỗn hợp gồm Al và Mg bằng dung dịch HCl dư. Sau phản ứng khối lượng dung dịch axit tăng thêm 7 gam. Khối lượng Al và Mg trong hỗn hợp ban đầu là:
A. 1,2 gam và 6,6 gam
B. 5,4 gam và 2,4 gam
C. 1,7 gam và 3,1 gam
D. 2,7 gam và 5,1 gam
Đáp án: B
Giải thích:
Phản ứng tạo khí H2. Khối lượng dung dịch tăng:
mdd tăng = mKL -
→ 7 = 7,8 - 2.
→ = 0,4 mol
Bảo toàn electron:
3.nAl + 2.nMg = 2.= 0,8 (1)
Lại có mAl + mMg = m hỗn hợp
→ 27.nAl + 24.nMg = 7,8 (2)
→ nAl = 0,2 mol; nMg = 0,1 mol
→ mAl = 0,2.27 = 5,4 gam;
mMg = 0,1.24 = 2,4 gam
Câu 6: Nước tự nhiên thường có lẫn lượng nhỏ các muối Ca(NO3)2, Mg(NO3)2, Ca(HCO3)2, Mg(HCO3)2. Có thể dùng một hóa chất nào sau đây để loại hết các cation trong mẫu nước trên?
A. NaOH.
B. K2SO4.
C. NaHCO3.
D. Na2CO3.
Đáp án: D
Giải thích:
Dùng anion để làm kết tủa hết cation Ca2+ và Mg2+ trong dung dịch
+ Ca2+ → CaCO3
+ Mg2+ → MgCO3
Câu 7: Nguyên tắc và phương pháp điều chế kim loại kiềm là:
A. khử ion kim loại kiềm bằng phương pháp điện phân
B. khử ion kim loại kiềm bằng phương pháp điện phân nóng chảy
C. khử ion kim loại kiềm bằng phương pháp điện phân dung dịch
D. B, C đều đúng
Đáp án: B
Giải thích:
Kim loại kiềm chỉ được điều chế bằng phương pháp điện phân nóng chảy muối halogenua hoặc hiđroxit của chúng.
Câu 8: Nhỏ vài giọt dung dịch natri cacbonat vào dung dịch nhôm clorua. Hiện tượng thu được là:
A. Xuất hiện kết tủa trắng.
B. Sủi bọt khí.
C. Không hiện tượng.
D. Xuất hiện kết tủa trắng và sủi bọt khí.
Đáp án: D
Giải thích:
Phương trình phản ứng
![]()
Câu 9: Hoà tan 46 gam một hỗn hợp Ba và hai kim loại kiềm A, B thuộc hai chu kì kế tiếp nhau vào nước thu được dung dịch C và 11,2 lít khí (đktc). Nếu thêm 0,18 mol Na2SO4 vào dung dịch C thì dung dịch sau phản ứng vẫn chưa kết tủa hết Ba. Nếu thêm 0,21 mol Na2SO4 vào dung dịch C thì dung dịch sau phản ứng còn dư Na2SO4. A và B là
A. Li và Na.
B. Na và K.
C. K và Rb.
D. Rb và Cs.
Đáp án: B
Giải thích:
Gọi nguyên tử khối trung bình của hai kim loại là X (g/mol), tổng số mol là a (mol).
Số mol của Ba là b (mol).
Ta có: Xa + 137b = 46
Khi tác dụng với nước thu được khí. Bảo toàn electron:
2.nBa + nX = 2.
→ 2b + a = 0,5.2 = 1
Vì 0,18 < b < 0,21
Vậy : 0,58 < a < 0,64 và 17,23 < Xa < 21,34
Suy ra 26,92 < X < 36,79
Vậy hai kim loại là Na và K
Câu 10: Ca(OH)2 là hoá chất
A. có thể loại độ cứng toàn phần của nước.
B. có thể loại độ cứng tạm thời của nước,
C. có thể loại độ cứng vĩnh cửu của nước.
D. không thể loại bỏ được bất kì loại nước cứng nào.
Đáp án: B
Giải thích:
Ca(OH)2 có khả năng làm mềm nước cứng tạm thời
Ca(OH)2 + Ca(HCO3)2 → 2CaCO3 + 2H2O
Câu 11: Chỉ dùng duy nhất một hóa chất nào dưới đây có thể phân biệt được 4 lọ mất nhãn chứa các dung dịch: AlCl3; ZnCl2; FeCl2 và NaCl.
A. Dung dịch NaOH
B. Dung dịch Na2CO3
C. Dung dịch AgNO3
D. Dung dịch amoniac
Đáp án: D
Giải thích:
Sử dụng dung dịch amoniac
+ Xuất hiện kết tủa trắng, không tan trong NH3 dư → AlCl3
AlCl3 + 3NH3 + 3H2O → Al(OH)3+ 3NH4Cl
+ Xuất hiện kết tủa trắng xanh, để trong không khí kết tủa chuyển dần sang nâu đỏ → FeCl2
FeCl2 + 2NH3 + 2H2O → Fe(OH)2 + 2NH4Cl
4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3
+ Xuất hiện kết tủa trắng, tan trong NH3 dư → ZnCl2.
ZnCl2 + 2NH3 + 2H2O → Zn(OH)2 + 2NH4Cl
Zn(OH)2 + 4NH3 → [Zn(NH3)4](OH)2
+ Không có hiện tượng gì → NaCl
Câu 12: Cho x mol hỗn hợp 2 kim loại kiềm thuộc 2 chu kì liên tiếp tác dụng vừa đủ với dung dịch HCl thì thu được a gam muối khan. Nếu cũng cho x mol hỗn hợp trên tác dụng vừa đủ với dung dịch H2SO4 thì thu được b gam muối khan. Giá trị của x là
A.
B.
C.
D.
Đáp án: B
Giải thích:
Gọi công thức chung của hai kim loại là R
nR = nRCl = x mol
→ (MR + 35,5)x = a (1)
→ (2MR + 96). = b (2)
Từ (1) và (2) → b – a = 12,5x
→ x =
Câu 13: Tính khử của các nguyên tử Na, K, Al, Mg được xếp theo thứ tự tăng dần là:
A. K, Na, Mg, Al
B. Al, Mg, Na, K
C. Mg, Al, Na, K
D. Al, Mg, K, Na
Đáp án: B
Giải thích:
Trong dãy hoạt động hóa học của kim loại, đi từ trái sang phải tính khử của kim loại giảm dần
K, Na, Ba, Ca, Mg, Al, Zn, Fe, Ni, Sn, Pb, H, Cu, Hg, Ag, Pt, Au.
→ Tính khử của kim loại: Al < Mg < Na < K
Câu 14: Hòa tan hoàn toàn 8,94 gam hỗn hợp gồm Na, K và Ba vào nước thu được dung dịch X và 2,688 lít khí H2 (đktc). Dung dịch Y gồm HCl và H2SO4 có tỉ lệ mol tương ứng là 4 : 1. Trung hòa dung dịch X bởi dung dịch Y, tổng khối lượng các muối được tạo ra là
A. 13,7
B. 12,78
C. 18,46
D. 14,62
Đáp án: C
Giải thích:
= 0,12 mol
= 0,24 mol
Gọi = x (mol)
→ nHCl = 4x (mol)
→ = 6x mol
→ 6x = 0,24
→ x = 0,04 mol
→ = 0,04 mol;
nHCl = 4.0,04 = 0,16 mol
→ m muối = m kim loại + m gốc axit
= 8,94 + 0,04.96 + 0,16.35,5
= 18,46 gam.
Câu 15: Các dung dịch nào sau đây đều có tác dụng với Al2O3?
A. Na2SO4, HNO3.
B. HNO3, KNO3.
C. HCl, NaOH.
D. NaCl, NaOH.
Đáp án: C
Giải thích:
A. Sai vì Na2SO4 không tác dụng với Al2O3
B. Sai vì KNO3 không tác dụng với Al2O3
C. Đúng, phương trình phản ứng:
6HNO3 + Al2O3 2Al(NO3)3 + 3H2O
6HCl + Al3O2 2AlCl3 + 3H2O
2NaOH + Al3O2 2NaAlO2 + H2O
D. Sai vì NaCl không tác dụng với Al2O3
Câu 16: Cho 10 ml dung dịch hỗn hợp HNO3 1M và H2SO4 0,5M. Thể tích dung dịch NaOH 1M cần để trung hòa dung dịch axit trên là
A. 0,02 lít.
B. 0,01 lít.
C. 0,05 lít.
D. 0,04 lít.
Đáp án: A
Giải thích:
= 0,01.1 + 2.0,01.0,5 = 0,02 mol
Phản ứng trung hòa luôn có:
= 0,02 mol
→ VNaOH = 0,02 lít
Câu 17: Hòa tan m (g) hỗn hợp X gồm Al và Na có tỉ lệ mol 1 : 2 vào nước dư thu được 4,48 (l) khí (đktc). Gíá trị của m là:
A. 7,3
B. 5,84
C. 6,15
D. 3,65
Đáp án: B
Giải thích:
Gọi số mol Al là x (mol)
→ nNa = 2x (mol)
Bảo toàn electron:
3.nAl + 1.nNa = 2.
→ 3x + 2x = 2.0,2
→ x = 0,08
→ m = 27.nAl + 23.nNa
= 27.0,08 + 23.2.0,08 = 5,84 gam
Câu 18: Cho 2,22 gam hỗn hợp kim loại gồm K, Na và Ba vào nước được 500 ml dung dịch X có pH = 13. Cô cạn dung dịch X được m gam chất rắn. Giá trị của m là:
A. 4,02
B. 3,42
C. 3,07
D. 3,05
Đáp án: C
Giải thích:
Ta có pH = 13
→ pOH = 14 – 13 =1
→ [OH-] = 0,1 M
→ = 0,1.0,5 = 0,05 mol
Áp dụng định luật bảo toàn khối lượng:
Ta có: m(bazơ) = m (kim loại) +
= 2,22 + 0,05 .17 = 3,07 g
Câu 19: Hòa tan hỗn hợp Na2CO3, KHCO3, Ba(HCO3)2 (trong đó số mol Na2CO3 và KHCO3 bằng nhau) vào nước lọc thu được dung dịch X và m gam kết tủa Y. Biết X tác dụng vừa đủ 0,16 mol NaOH hoặc 0,24 mol HCl thì hết khí bay ra. Giá trị của m là:
A. 7,88 g
B. 4,925 g
C. 1,97 g
D. 3,94g
Đáp án: A
Giải thích:
Gọi số mol Na2CO3 x mol , KHCO3 x mol , Ba(HCO3)2 y mol
Nhận thấy dung dịch X tác dụng vừa đủ với 0,16 mol NaOH :
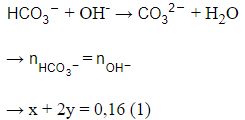
Nếu dung dịch X chỉ có thì lượng HCl cần dùng tối đa là 0,16 mol < 0,24 mol
= y mol
→ Trong dung dịch X còn chứa dư : (x - y) mol
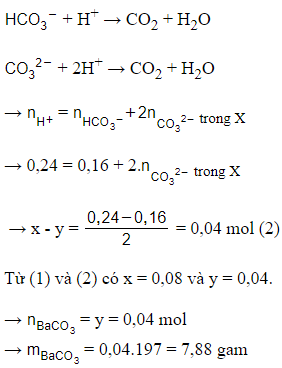
Câu 20: Hấp thụ hoàn toàn 1,568 lít CO2 (đktc) vào 500ml dung dịch NaOH 0,16M thu được dung dịch X. Thêm 250 ml dung dịch Y gồm BaCl2 0,16M và Ba(OH)2 a mol/l vào dung dịch X thu được 3,94 gam kết tủa và dung dịch Z. Tính a?
A. 0,02M
B. 0,04M
C. 0,03M
D. 0,015M
Đáp án: B
Giải thích:
= 0,07mol;
nNaOH = 0,08 mol
= 1,14
→ Cả hai chất tham gia phản ứng hết, sản phẩm tạo 2 muối.
= 0,08 – 0,07 = 0,01 mol
= 2.0,07 – 0,08 = 0,06 mol
Thêm dung dịch Y vào X:
+ OH- → + H2O (1)
Ba2+ + → BaCO3↓
= 0,02 mol < = 0,25.0,16 = 0,04 mol
→ = = 0,02 mol
phản ứng (1) = phản ứng (1) = 0,02 – 0,01 = 0,01 mol
→ = 0,005 mol
a = mol/l
Câu 21: Anion gốc axit nào sau đây có thể làm mềm ước cứng?
A. NO3-.
B. SO42-.
C. ClO4-.
D. PO43-.
Đáp án: D
Giải thích:
Anion PO43- có thể làm mềm mọi loại nước cứng.
3Ca2+ + 2PO43- Ca3(PO4)2↓
3Mg2+ + 2PO43- Mg3(PO4)2↓.
Câu 22: Cho các chất sau: Ca(OH)2, KOH, CaCO3, Ca(HCO3)2, KNO3, Mg(OH)2.
Số chất bị nhiệt phân có chất khí trong sản phẩm tạo thành là
A. 5.
B. 4.
C. 3.
D. 2.
Đáp án: C
Giải thích:
Có ba chất khi bị nhiệt phân sinh ra chất khí là: CaCO3; Ca(HCO3)2; KNO3.
CaCO3 CaO + CO2
Ca(HCO3)2 CaCO3 + CO2 + H2O
2KNO3 2KNO2 + O2
Câu 23: Để bảo quản các kim loại kiềm, có thể thực hiện cách nào sau đây?
A. Để trong lọ thủy tinh có không khí nhưng đậy nắp kín.
B. Ngâm trong ancol nguyên chất.
C. Để trong lọ thủy tinh có chất hút ẩm và đặt trong bóng tối.
D. Ngâm trong dầu hỏa.
Đáp án: D
Giải thích:
Kim loại kiềm được bảo quản bằng cách ngâm trong dầu hỏa.
Câu 24: Cho 40,5 gam kim loại R (có hóa trị không đổi) tác dụng với dung dịch axit clohiđric dư thì thu được 50,4 lít khí (đktc). Kim loại R là
A. Mg.
B. Al.
C. Zn.
D. Fe.
Đáp án: B
Giải thích:
2R + 2nHCl → 2RCln + nH2↑
Vậy R là nhôm (Al)
Câu 25: Hỗn hợp X gồm Na, Ba, Na2O và BaO. Hoà tan hoàn toàn 21,9 gam X vào nước thu được 1,12 lít khí H2 (đktc) và dung dịch Y chứa 20,52 gam Ba(OH)2. Cho Y tác dụng với 100 ml dung dịch Al2(SO4)3 0,5M thu được m gam kết tủa. Giá trị của m là:
A. 27,96.
B. 29,52.
C. 36,51.
D. 1,50.
Đáp án: B
Giải thích:
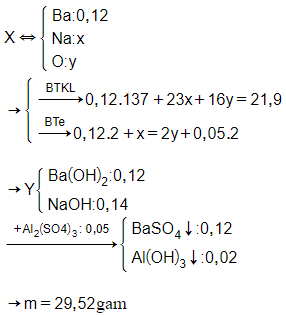
Câu 26: Nhận xét nào sau đây không đúng?
A. Các kim loại kiềm thổ có tính khử mạnh.
B. Tính khử của các kim loại kiềm thổ tăng dần từ Be đến Ba.
C. Tính khử của các kim loại kiềm thổ yếu hơn kim loại kiềm trong cùng chu kì.
D. Be, Mg, Ca, Sr, Ba đều phản ứng với nước ở nhiệt độ thường nên gọi là kim loại kiềm thổ.
Đáp án: D
Giải thích:
D. Sai. Các kim loại kiềm thổ đều phản ứng với ngước ở nhiệt độ thường trừ Be và Mg.
Câu 27: Mô tả ứng dụng của Mg nào dưới đây không đúng?
A. Dùng chế tạo hợp kim nhẹ cho công nghiệp sản xuất ôtô, máy bay.
B. Dùng chế tạo dây dẫn điện.
C. Dùng trong các quá trình tổng hợp hữu cơ.
D. Dùng để tạo chất chiếu sáng.
Đáp án: B
Giải thích:
Kim loại Mg được dùng để chế tạo những hợp kim có tính cứng, nhẹ, bền. Những hợp kim này được dùng để chế tạo máy bay, tên lửa, ôtô,..Kim loại Mg còn được dùng để tổng hợp nhiều chất hữu cơ. Một Mg trộn với chất oxi hóa dùng để chế tạo chất chiếu sáng ban đêm.
→ Đáp án B sai. Mg không dùng để chế tạo dây dẫn điện.
Câu 28: Dung dịch nào sau đây tác dụng với dung dịch Ba(HCO3)2, vừa thu được kết tủa, vừa có khí thoát ra?
A. NaOH.
B. HCl.
C. Ca(OH)2.
D. H2SO4.
Đáp án: D
Giải thích:
Ba(HCO3)2 + H2SO4 → BaSO4 + 2H2O + 2CO2
Câu 29: Cho dãy các chất: Ca(HCO3)2, NH4Cl, (NH4)2CO3, ZnSO4, Al(OH)3, Zn(OH)2. Số chất trong dãy có tính chất lưỡng tính là
A. 3.
B. 5.
C. 2.
D. 4.
Đáp án: D
Giải thích:
+) Ca(HCO3)2 là muối lưỡng tính ( là ion lưỡng tính)
+) NH4+ có tính axit, CO32- có tính bazơ → (NH4)2CO3 là muối lưỡng tính.
+) Al(OH)3, Zn(OH)2 là hiđroxit lưỡng tính.
+ NH4Cl và ZnSO4 là hai muối có môi trường axit
Câu 30: Hoà tan hoàn toàn 3,6 gam Mg bằng dung dịch chứa 0,42 mol HNO3 (vừa đủ). Sau phản ứng thu được dung dịch X và 0,56 lít hỗn hợp khí Y gồm N2O và N2 (đktc). Khối lượng muối trong X là:
A. 22,20 gam.
B. 25,16 gam.
C. 29,36 gam.
D. 25,00 gam.
Đáp án: D
Giải thích:
n hỗn hợp khí = 0,56 : 22,4 = 0,025 mol
nMg = 3,6 : 24 = 0,15 mol
→ = 0,15 mol
Bảo toàn nguyên tố N:
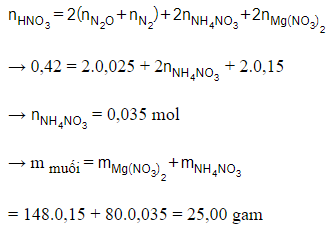
Các câu hỏi Trắc nghiệm Hóa học lớp 12 có đáp án, chọn lọc khác:
Trắc nghiệm Luyện tập tính chất của nhôm và hợp chất của nhôm có đáp án
Trắc nghiệm Hợp chất của sắt có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
