TOP 40 câu Trắc nghiệm Luyện tập điều chế kim loại và sự ăn mòn kim loại (có đáp án 2024) - Hóa học 12
Bộ 40 bài tập trắc nghiệm Hóa học lớp 12 Bài 23: Luyện tập điều chế kim loại và sự ăn mòn kim loại có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 12.
Trắc nghiệm Hóa học 12 Bài 23: Luyện tập điều chế kim loại và sự ăn mòn kim loại
Câu 1: Trong quá trình điện phân dung dịch KBr, phản ứng nào sau đây xảy ra ở cực dương (anot)?
A. Ion Br- bị oxi hóa
B. Ion Br- bị khử
C. Ion K+ bị oxi hóa
D. Ion K+ bị khử
Đáp án: A
Giải thích:
Ở cực âm (catot):
2H2O + 2e 2OH- + H2
Ở cực dương (anot):
2Br- Br2 + 2e
Câu 2: Một học sinh đã đưa ra các phương án điều chế kim loại Mg như sau:
(1) Kết tủa Mg(OH)2 từ dung dịch MgCl2, nhiệt phân lấy MgO rồi khử bằng H2 ở nhiệt độ cao để điều chế Mg.
(2) Dùng kim loại mạnh đẩy Mg ra khỏi dung dịch MgCl2.
(3) Điện phân dung dịch MgCl2 để thu được Mg.
(4) Cô cạn dung dịch MgCl2, điện phân nóng chảy để thu được Mg.
Trong các phương án trên có bao nhiêu phương án có thể áp dụng để điều chế Mg?
A. 1
B. 2
C. 3
D. 4
Đáp án: A
Giải thích:
Mg là kim loại hoạt động mạnh nên được điều chế bằng cách điện phân các hợp chất nóng chảy của kim loại.
→ Phương án (4) thỏa mãn.
Câu 3: Cho các hợp kim sau: Al–Zn (1); Fe–Zn (2); Zn–Cu (3); Mg–Zn (4). Khi tiếp xúc với dung dịch axit H2SO4 loãng thì các hợp kim mà trong đó Zn bị ăn mòn điện hóa là
A. 2, 3, 4.
B. 3, 4.
C. 1, 2, 3.
D. 2, 3.
Đáp án: D
Giải thích:
Zn bị ăn mòn điện hóa
→ Zn có tính khử mạnh hơn
→ 2 hợp kim Fe–Zn (2); Zn–Cu (3) thỏa mãn
Câu 4: Một mẩu kim loại Ag dạng bột có lẫn Fe, Cu. Để loại bỏ tạp chất mà không làm thay đổi khối lượng Ag ban đầu, có thể ngâm mẩu Ag trên vào lượng dư dung dịch nào sau đây?
A. HNO3
B. HC1
C. AgNO3
D. Fe(NO3)3
Đáp án: D
Giải thích:
Cho hỗn hợp kim loại phản ứng vơi Fe(NO3)3:
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
Cu + 2Fe(NO3)3 → 2Fe(NO3)2 + Cu(NO3)2
→ Loại bỏ được tạp chất mà không làm ảnh hưởng đến khối lượng Ag.
Câu 5: Để chống ăn mòn cho các chân cột thu lôi bằng thép chôn dưới đất, người ta dùng phương pháp bảo vệ điện hoá. Trong thực tế, có thể dùng kim loại nào sau đây làm điện cực bảo vệ ?
A. Na
B. Zn
C. Sn
D. Cu
Đáp án: B
Giải thích:
Dùng kim loại có tính khử mạnh hơn Fe để tạo thành một pin điện hóa. Khi đó kim loại này bị ăn mòn điện hóa, Fe được bảo vệ.
Dùng Zn làm điện cực bảo vệ. Na có tính khử quá mạnh nên không thể dùng làm điện cực bảo vệ.
Câu 6: Cho khí CO (dư) đi qua ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm
A. MgO, Fe, Cu
B. Mg, Fe, Cu
C. MgO, Fe3O4 Cu
D. Mg, FeO, Cu
Đáp án: A
Giải thích:
Cho CO dư qua hỗn hợp X thu được chất rắn Y gồm: Al2O3; MgO; Fe; Cu (vì CO chỉ khử được những oxit của kim loại đứng sau Al trong dãy hoạt động hóa học).
Cho Y vào NaOH dư, Al2O3 tan hết, phần không tan Z gồm: MgO; Fe; Cu.
Câu 7: Quấn một sợi dây kẽm quanh một thanh thép (là hợp kim của sắt và cacbon) và để ngoài không khí. Hiện tượng quan sát được là
A. sợi dây kẽm bị ăn mòn.
B. kim loại sắt trong thanh thép bị ăn mòn,
C. sợi dây kẽm và sắt trong thanh thép bị ăn mòn.
D. hiện tượng ăn mòn không xảy ra.
Đáp án: A
Giải thích:
Sợi dây kẽm tiếp xúc với thanh thép để ngoài không khí xảy ra hiện tượng ăn mòn điện hóa. Trong đó kim loại kẽm có tính khử mạnh hơn bị ăn mòn.
Câu 8: Để bảo vệ vỏ tàu biển người ta thường dùng phương pháp nào sau đây?
A. Dùng hợp kim chống gỉ.
B. Dùng chất chống ăn mòn.
C. Mạ 1 lớp kim loại bền lên vỏ tàu.
D. Gắn các lá Zn lên vỏ tàu.
Đáp án: D
Giải thích:
Phương pháp điện hóa: dùng kim loại mạnh hơn để bảo vệ kim loại yếu hơn.
Gắn các lá thép lên vỏ tàu vì Zn có tính khử mạnh hơn Fe (vỏ tàu) đóng vai trò là cực âm (kim loại bị ăn mòn thay sắt), nhưng tốc độ ăn mòn của kẽm tương đối nhỏ và giá thành không quá cao → vỏ tàu được bảo vệ trong thời gian dài.
Câu 9: Sơ đồ sau đây mô tả cách điều chế kim loại M :
![]()
Trong số các kim loại Mg, Al, Fe, Ni, Cu, Ag, có bao nhiêu kim loại có thể áp dụng sơ đồ điều chế trên ?
A. 6
B. 5
C. 4
D. 3
Đáp án: C
Giải thích:
Kim loại có tính khử trung bình, yếu (đứng sau Al trong dãy hoạt động hóa học) có thể điều chế bằng phương pháp điện phân dung dịch.
Các kim loại thỏa mãn gồm: Fe, Ni, Cu, Ag
Câu 10: Khi điện phân một dung dịch chứa Na2SO4, Al2(SO4)3 và H2SO4, quá trình đầu tiên xảy ra ở catot là:
A. 2H2O + 2e → H2 + 2OH-
B. Na+ + 1e → Na
C. Al3+ + 3e → Al
D. 2H+ + 2e → H2
Đáp án: D
Giải thích:
Na+ và Al3+ không bị khử, H+ bị khử
Quá trình đầu tiên xảy ra ở catot là khử H+
Câu 11: Phương pháp điều chế kim loại kiềm là:
A. khử oxit bằng khí CO.
B. điện phân nóng chảy muối halogen hoặc hiđroxit của chúng.
C. điện phân dung dịch muối halogen.
D. cho Al tác dụng với dung dịch muối.
Đáp án: B
Giải thích:
Kim loại kiềm được điều chế bằng cách điện phân nóng chảy muối halogen hoặc hiđroxit của chúng.
Câu 12: Khi điện phân một dung dịch muối, giá trị pH ở khu vực gần một điện cực tăng lên. Dung dịch muối đem điện phân có thể là dung dịch nào sau đây ?
A. CuSO4
B. AgNO3
C. KC1
D. K2SO4
Đáp án: C
Giải thích:
Giá trị pH tăng → sinh ra OH- → nước điện phân ở catot (-)
→ ion kim loại không bị khử
→ KCl thỏa mãn
Catot (-): 2H2O + 2e → H2 + 2OH-
Anot (+): 2Cl- → Cl2 + 2e
K2SO4 chỉ điện phân nước, giá trị pH không đổi.
Câu 13: Nhúng thanh Fe vào dung dịch CuSO4, sau một thời gian quan sát thấy:
A. thanh sắt có màu trắng hơi xám và dung dịch màu xanh nhạt.
B. thanh sắt có màu đỏ và dung dịch màu xanh nhạt dần.
C. thanh sắt có màu vàng và dung dịch có màu xanh nhạt.
D. thanh sắt có màu đỏ và dung dịch có màu xanh đậm.
Đáp án: B
Giải thích:
Fe + CuSO4 → FeSO4 + Cu
Thanh sắt có màu đỏ do kim loại Cu thoát ra bám vào. Dung dịch màu xanh lam của CuSO4 nhạt dần
Câu 14: Điện phân dung dịch CuSO4 trong thời gian 1930 giây, thu được 1,92 gam Cu ở catot (chưa thấy có khí thoát ra ở catot). Với hiệu suất quá trình điện phân là 80%, cường độ dòng điện chạy qua dung dịch điện phân là:
A. 3,75 ampe
B. 1,875 ampe
C. 3,0 ampe
D. 6,0 ampe
Đáp án: A
Giải thích:
mCu lý thuyết = 1,92 : 0,8 = 2,4 gam
Catot (-): Cu2+ → Cu + 2e
Theo định luật Faraday:
m =
→ 2,4 =
→ I = 3,75A
Câu 15: Điện phân nóng chảy 23,4g muối clorua của 1 kim loại kiềm R thu được 4,48 lít khí (đktc) ở anot. R là:
A. Li.
B. Na.
C. K.
D. Rb.
Đáp án: B
Giải thích:
Ta có = 4,48 : 22,4 = 0,2 mol
2RCl 2R + Cl2
= 0,4 mol
→ MRCl = 23,4 : 0,4 = 58,5 (g/mol)
→ MR = 58,5 – 35,5 = 23 (g/mol) (Na)
Câu 16: Có những vật bằng sắt được mạ bằng những kim loại khác nhau dưới đây. Nếu các vật này đều bị xây xát sâu đến lớp sắt, thì vật nào bị gỉ sắt chậm nhất?
A. Sắt tráng kẽm.
B. Sắt tráng thiếc
C. Sắt tráng niken.
D. Sắt tráng đồng.
Đáp án: A
Giải thích:
Sắt tráng thiếc; sắt tráng niken; sắt tráng đồng thì sắt bị ăn mòn trước còn sắt tráng kẽm thì kẽm bị ăn mòn trước
Câu 17: Điện phân 10 ml dung dịch AgNO3 0,4M (điện cực trơ) trong thời gian 10 phút 30 giây với cường độ dòng điện I = 2A, thu được m gam Ag. Giả sử hiệu suất phản ứng đạt 100%. Giá trị của m là
A. 2,16.
B. 1,544.
C. 0,432.
D. 1,41.
Đáp án: C
Giải thích:
= 0,004 <
mol
→ Ag+ điện phân hết, có cả nước bị điện phân.
→ mAg = 0,004.108 = 0,432g
Câu 18: Cho 2,24g bột sắt vào 200 ml dung dịch CuSO4 0,05M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và m gam chất rắn Y. Giá trị của m là
A. 3,84.
B. 2,32.
C. 1,68.
D. 0,64.
Đáp án: B
Giải thích:
nFe = 0,04 mol; = 0,01mol
Fe + Cu2+ Fe2+ + Cu
→ Fe dư. Cu2+ phản ứng hết
→ m = mCu + mFe dư
= 0,01.64 + (0,04 – 0,01).56 = 2,32 gam
Câu 19: Cho các phát biểu sau:
(1) Các oxit của kim loại kiềm phản ứng với CO tạo thành kim loại.
(2) Các kim loại Ag, Fe, Cu và Mg đều được điều chế được bằng phương pháp điện phân dung dịch.
(3) Các kim loại Mg, K và Fe đều khử được ion Ag+ trong dung dịch thành Ag.
(4) Cho Cu vào dung dịch FeCl3 dư, thu được dung dịch chứa 3 muối.
Số phát biểu đúng là
A. 4.
B. 1.
C. 3.
D. 2.
Đáp án: B
Giải thích:
(1) Sai. Oxit của kim loại kiềm không bị khử bởi CO.
(1) Sai. Mg không điều chế được bằng phương pháp điện phân dung dịch.
(3) Sai. K không khử được ion Ag+ trong dung dịch thành Ag.
(4) Đúng. Cu + 2FeCl3 → CuCl2 + 2FeCl2
3 muối thu được là CuCl2, FeCl2 và FeCl3 dư.
Câu 20: Thực hiện các thí nghiệm sau:
(a) Nhiệt phân AgNO3.
(b) Nung FeS2 trong không khí
(c) Cho Mg (dư) vào dung dịch Fe2(SO4)3.
(d) Nhiệt phân Mg(NO3)2.
(e) Cho Fe vào dung dịch CuSO4 (dư)
(g) Cho Zn vào dung dịch FeCl3 (dư)
(h) Nung Ag2S trong không khí.
(i) Cho Ba vào dung dịch CuCl2 (dư)
Số thí nghiệm thu được kim loại sau khi các phản ứng kết thúc là:
A. 4
B. 3
C. 5
D. 2
Đáp án: A
Giải thích:
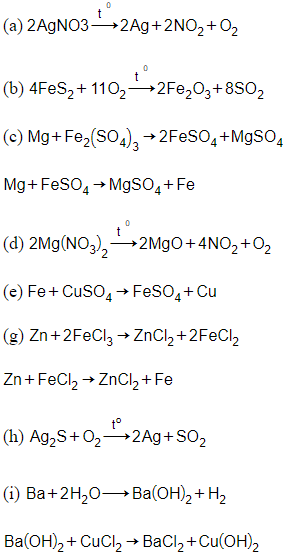
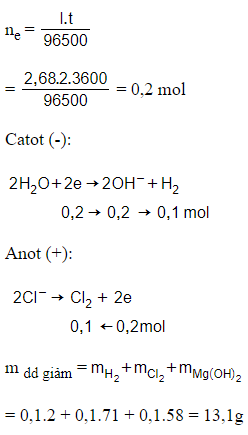
Câu 21: Điện phân một lượng dư dung dịch MgCl2 (điện cực trơ, có màng ngăn xốp bao điện cực) với cường độ dòng điện 2,68A trong 2 giờ. Sau khi dừng điện phân, khối lượng dung dịch giảm m gam, giả thiết nước không bay hơi, các chất tách ra đều khan. Giá trị của m là
A. 8,7.
B. 18,9.
C. 7,3.
D. 13,1.
Đáp án: D
Giải thích:
Câu 22: Điện phân dung dịch muối MCln với điện cực trơ. Khi ở catot thu được 16 gam kim loại M thì ở anot thu được 5,6 lít (đktc). Kim loại M là
A. Mg.
B. Cu.
C. Ca.
D. Zn.
Đáp án: B
Giải thích:
Anot (+):
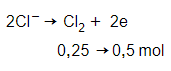
n e nhường = n e nhận = 0,5 mol
Catot (-):
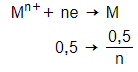
→ 16 = MM.
→ Chỉ có n = 2 và M = 64 phù hợp.
Vậy kim loại M là Cu
Câu 23: Điện phân 200 ml dung dịch CuSO4 0,5M và FeSO4 0,3M với điện cực trơ và dòng điện I = 5A. Sau 60 phút, khối lượng catot tăng lên là
A. 5,97 gam
B. 6,40 gam.
C. 3,36 gam.
D. 9,76 gam.
Đáp án: A
Giải thích:
= 0,2.0,5 = 0,1 mol
= 0,2.0,3 = 0,06 mol
ne =
= < 2.
Cu2+ chưa bị điện phân hết.
Phản ứng điện phân:
Cu2+ + 2e Cu
Lượng kim loại thoát ra ở catot là:
mCu =
= . = 5,97 gam
Câu 24: Hỗn hợp bột X gồm BaCO3, Fe(OH)2, Al(OH)3, CuO, MgCO3. Nung X trong không khí đến khối lượng không đổi được hỗn hợp rắn A1. Cho A1 vào nước dư khuấy đều được dung dịch B chứa 2 chất tan và phần không tan C1. Cho khí CO dư qua bình chứa C1 nung nóng được hỗn hợp rắn E (Cho các phản ứng xảy ra hoàn toàn). E chứa tối đa:
A. 1 đơn chất và 2 hợp chất.
B. 3 đơn chất.
C. 2 đơn chất và 2 hợp chất.
D. 2 đơn chất và 1 hợp chất.
Đáp án: D
Giải thích:
X A1: BaO; Fe2O3; Al2O3; CuO; MgO
A1 dd B: Ba(OH)2, Ba(AlO2)2; C1: Fe2O3; CuO; MgO
C1 E: Fe, Cu, MgO
Câu 25: Kết luận nào sau đây không đúng?
A. Các thiết bị máy móc bằng kim loại tiếp xúc với hơi nước ở nhiệt độ cao có khả năng bị ăn món hóa học
B. Để đồ vật bằng thép ra ngoài không khí ẩm thì đồ vật đó sẽ bị ăn mòn điện hóa
C. Nối thanh Zn với vỏ tàu thủy bằng thép thì vỏ tàu thủy sẽ được bảo vệ
D. Một miếng vỏ đồ hộp làm bằng sắt tây (sắt tráng thiếc) bị xây xát tận bên trong, để trong không khí ẩm thì Sn sẽ bị ăn mòn trước
Đáp án: D
Giải thích:
D. Sai vì trong sắt tây, Fe đóng vai trò là cực âm và bị ăn mòn trước.
Câu 26: Kim loại nào dưới đây có thể được điều chế bằng cách dùng CO khử oxit kim loại tương ứng ở nhiệt độ cao?
A. Al.
B. Mg.
C. Ca.
D. Fe.
Đáp án: D
Giải thích:
CO có thể khử được các kim loại hoạt động trung bình, yếu (kim loại đứng sau Al trong dãy hoạt động hóa học
→ Kim loại Fe có thể được điều chế bằng cách dùng CO khử oxit kim loại tương ứng.
Câu 27: Dẫn khí CO dư qua ống sứ đựng 7,2 gam bột FeO nung nóng thu được hỗn hợp khí X. Cho toàn bộ X vào nước vôi trong dư, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 5,0
B. 10,0
C. 7,2
D. 15,0
Đáp án: B
Giải thích:
no trong FeO = nFeO
= = 0,1 mol
Sục hỗn hợp khí X gồm CO2 và CO dư và nước vôi trong dư
→ = 0,1 mol
→
Câu 28: Nhóm các kim loại đều có thể được điểu chế bằng phương pháp thủy luyện là
A. Ba, Au.
B. Al, Cr.
C. Mg, Cu.
D. Cu, Ag.
Đáp án: D
Giải thích:
Nguyên tắc của phương pháp thủy luyện là dùng kim loại có tính khử mạnh hơn (không phản ứng với H2O) để khử ion kim loại trong dung dịch muối.
Phạm vi áp dụng: Điều chế kim loại có tính khử trung bình, yếu (kim loại đứng sau Al trong dãy hoạt động hóa học)
→ Nhóm các kim loại đều có thể điều chế bằng phương pháp thủy luyện là: Cu, Ag.
Câu 29: Khử hoàn toàn một lượng Fe3O4 bằng H2 dư, thu được chất rắn X và m gam H2O. Hòa tan hết X trong dung dịch HCl dư, thu được 1,008 lít khí H2 (đktc). Giá trị của m là
A. 0,72
B. 1,35
C. 0,81
D. 1,08
Đáp án: D
Giải thích:
Fe3O4 + 4H2 3Fe + 4H2O
Bảo toàn electron cho phản ứng hòa tan Fe vào HCl
2.nFe = 2.
→ nFe = 0,045 mol
Fe3O4 + 4H2 3Fe + 4H2O
= .nFe
= .0,045 = 0,06 mol
→ = 0,06.18 = 1,08 gam
Câu 30: Điện phân dung dịch CuSO4 với cường độ I = 10A trong thời gian t, ta thấy có 224 ml khí (đktc) thoát ra ở anot. Giả thiết rằng điện cực trơ và hiệu suất điện phân bằng 100%. Thời gian điện phân t là
A. 7 phút 20 giây.
B. 3 phút 13 giây.
C. 6 phút 26 giây.
D. 5 phút 12 giây.
Đáp án: C
Giải thích:
Ở anot xảy ra sự oxi hóa nước:
2H2O 4H+ + O2 + 4e
= 0,01 mol
→ ne = 0,04 mol
Mà ne =
→ 0,04 =
→ t = 386 giây = 6 phút 26 giây
Các câu hỏi Trắc nghiệm Hóa học lớp 12 có đáp án, chọn lọc khác:
Trắc nghiệm Kim loại kiềm và hợp chất của kim loại kiềm có đáp án
Trắc nghiệm Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ có đáp án
Trắc nghiệm Nhôm và hợp chất của nhôm có đáp án
Trắc nghiệm Luyện tập tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng có đáp án
Trắc nghiệm Luyện tập tính chất của nhôm và hợp chất của nhôm có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
