TOP 40 câu Trắc nghiệm Luyện tập: Tính chất của sắt và hợp chất của sắt (có đáp án 2024) - Hóa học 12
Bộ 40 bài tập trắc nghiệm Hóa học lớp 12 Bài 37: Luyện tập: Tính chất của sắt và hợp chất của sắt có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 12.
Trắc nghiệm Hóa học 12 Bài 37: Luyện tập: Tính chất của sắt và hợp chất của sắt
Câu 1: Cho Fe tác dụng với dung dịch AgNO3 dư, sau khi phản ứng xảy ra hoàn toàn thu được dung dịch X và kết tủa Y. Trong dung dịch X có chứa
A. Fe(NO3)2, AgNO3
B. Fe(NO3)3, AgNO3
C. Fe(NO3)3, AgNO3, Fe(NO3)2
D. Fe(NO3)2
Đáp án: B
Giải thích:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe(NO3)2 + AgNO3 dư → Fe(NO3)3 + Ag
→ Dung dịch X có chứa: Fe(NO3)3 và AgNO3 dư.
Câu 2: Thực hiện hai thí nghiệm sau với lá sắt.
Thí nghiệm (1): Cho lá thứ nhất tác dụng hết với khí clo.
Thí nghiệm (2): Cho lá thứ hai tác dụng hết với dung dịch HCl.
Phát biểu đúng là
A. Sau cả hai thí nghiệm đều thu được FeCl2.
B. Sau cả hai thí nghiệm đều thu được FeCl3.
C. Sau thí nghiệm (1) thu được FeCl3, sau thí nghiệm (2) thu được FeCl2.
D. Sau thí nghiệm (1) thu được FeCl2, sau thí nghiệm (2) thu được FeCl3.
Đáp án: C
Giải thích:
Phương trình phản ứng:
(1) 2Fe + 3Cl2 2FeCl3
(2) Fe + 2HCl → FeCl2 + H2
Câu 3: Có thể dùng một hóa chất để phân biệt Fe2O3 và Fe3O4. Hóa chất này là:
A. dung dịch NaOH đặc
B. dung dịch HCl đặc
C. dung dịch H2SO4
D. dung dịch HNO3 đặc
Đáp án: D
Giải thích:
Dùng dung dịch HNO3 đặc vì Fe2O3 chỉ xảy ra phản ứng trao đổi, nhưng Fe3O4 xảy ra phản ứng oxi hóa khử tạo ra khí không màu hóa nâu trong không khí.
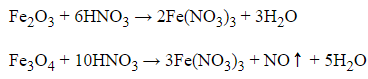
Câu 4: Khi cho sắt nóng đỏ vào hơi nước thì
A. sắt không tác dụng với nước vì sắt không tan trong nước.
B. tùy nhiệt độ, sắt tác dụng với hơi nước tạo H2 và FeO hoặc Fe3O4
C. sắt tác dụng với hơi nước tạo H2 và Fe2O3.
D. sắt xúc tác cho phản ứng phân hủy nước thành H2 và O2.
Đáp án: B
Giải thích:
Ở nhiệt độ thường, sắt không khử được nước, những ở nhiệt độ cao sắt khử hơi nước tạo ra H2 và FeO hoặc Fe3O4
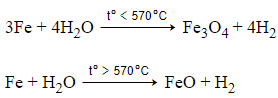
Câu 5: Cho a mol sắt tác dụng hết với a mol khí clo thu được chất rắn X. Cho X vào nước thu được dung dịch Y. Dung dịch Y không tác dụng với chất nào sau đây?
A. AgNO3
B. NaOH
C. Cu
D. khí Cl2
Đáp án: C
Giải thích:
Giả sử a = 1,5 mol
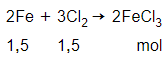
→ Sau phản ứng, Fe dư
Chất rắn X gồm: FeCl3: 1 mol; Fe dư: 0,5 mol
Cho X vào nước:
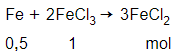
→ Dung dịch sau phản ứng chỉ có FeCl2, dung dịch này không tác dụng được với Cu.
Giải thích:
Giả sử a = 1,5 mol
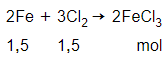
→ Sau phản ứng, Fe dư
Chất rắn X gồm: FeCl3: 1 mol; Fe dư: 0,5 mol
Cho X vào nước:
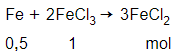
→ Dung dịch sau phản ứng chỉ có FeCl2, dung dịch này không tác dụng được với Cu.
Câu 6: Hòa tan hoàn toàn 1,84 gam hỗn hợp Fe và Mg trong lượng dư dung dịch HNO3, thu được 0,04 mol khí NO (sản phẩm khử duy nhất của ). Số mol Fe và Mg trong hỗn hợp lần lượt là:
A. 0,01 và 0,01
B. 0,03 và 0,03
C. 0,02 và 0,03
D. 0,03 và 0,02
Đáp án: C
Giải thích:
Gọi số mol của Fe và Mg lần lượt là x và y mol
Theo bài ra: mhh = 1,84 gam
→ 56x + 24y = 1,84 (1)
Bảo toàn electron có:
3.nFe + 2.nMg = 3.nNO
→ 3x + 2y = 0,12 (2)
Từ (1) và (2) có: x = 0,02 và y = 0,03 mol
Câu 7: Cho 2,52g một kim loại tác dụng hết với dung dịch H2SO4 loãng, thu được 6,84g muối sunfat. Kim loại đó là
A. Mg
B. Zn
C. Fe
D. Al
Đáp án: C
Giải thích:
Đặt kim loại cần tìm là M, hóa trị là n
2M + nH2SO4 → M2(SO4)n + nH2
Theo bài ra ta có:
m muối = mkim loại +
→ 6,84 = 2,52 +
→ = 4,32 gam
→ = 4,32 : 96 = 0,045 mol
→ = 0,045 mol.
Theo phương trình ta có:
nM =
= .0,045 = mol
MM = = 2,52 : = 28n
Với n = 1 → MM = 28 loại
n = 2 → MM = 56 (Fe) Thỏa mãn
n = 3 → MM = 84 loại.
Vậy kim loại cần tìm là Fe
Câu 8: Cho m gam bột sắt vào 200 ml dung dịch chứa AgNO3 1,0M và Cu(NO3)2 0,75M; Sau khi các phản ứng xảy ra hoàn toàn, thu được 2,5m gam kết tủa gồm hai kim loại. Giá trị của m là
A. 8,96.
B. 16,80.
C. 11,20.
D. 14,00.
Đáp án: C
Giải thích:
Cho bột Fe vào dung dịch chứa Ag+ và Cu2+, thu được kết tủa gồm 2 kim loại. Suy ra kết tủa gồm Ag, Cu, dung dịch có Fe2+, Cu2+ dư
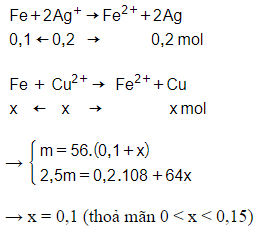
m = 11,2 gam
Câu 9: Cho vào ống nghiệm một ít mạt sắt và một ít dung dịch HNO3 loãng. Mô tả nào sau đây đúng?
A. Sắt tan, tạo dung dịch không màu, xuất hiện khí màu nâu đỏ.
B. Sắt tan, tạo dung dịch không màu, xuất hiện khí không màu hóa nâu đỏ trong không khí.
C. Sắt tan, tạo dung dịch màu vàng, xuất hiện khí màu nâu đỏ
D. Sắt tan, tạo dung dịch màu vàng, xuất hiện khí không màu hóa nâu đỏ trong không khí.
Đáp án: D
Giải thích:
Fe phản ứng với dung dịch HNO3 loãng tạo muối Fe3+ màu vàng, xuất hiện khí không màu hóa nâu ngoài không khí.
Phương trình phản ứng:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
2NO + O2 → 2NO2 (nâu đỏ)
Câu 10: Hòa tan hết 1,52 g hỗn hợp bột kim loại sắt và đồng trong dung dịch HNO3 loãng thu được 0,448 lít NO là sản phẩm khử duy nhất (đktc). Thành phần % khối lượng kim loại sắt và đồng trong hỗn hợp ban đầu lần lượt là
A. 63,2% và 36,8%.
B. 36,8% và 63,2%.
C. 50% và 50%.
D. 36,2% và 36,8%.
Đáp án: B
Giải thích:
56.nFe + 64.nCu = 1,52 (1)
Bảo toàn electron:
3.nFe + 2.nCu = 3.nNO
→ 3.nFe + 2.nCu
= 3.0,02 = 0,06 (2)
Từ (1) và (2) → nFe = 0,01 mol;
nCu = 0,015 mol
%mFe = = 36,8%
%mCu = 100 – 36,8 = 63,2%
Câu 11: Cho 20 gam bột Fe vào dung dịch HNO3, khuấy đến khi phản ứng xong thu được V lít khí NO (đktc) và còn 3,2 gam kim loại. Giá trị của V là:
A. 2,24
B. 4,48
C. 6,72
D. 5,6
Đáp án: B
Giải thích:
nFe phản ứng = 0,3 mol
Sau phản ứng vẫn còn kim loại dư nên dung dịch sau phản ứng chỉ chứa Fe(NO3)2
Bảo toàn electron có:
2.nFe pư = 3.nNO
→ nNO = 0,2 mol
→ VNO = 0,2.22,4 = 4,48 lít.
Câu 12: Cho 13,5 gam hỗn hợp các kim loại Al, Cr, Fe tác dụng với lượng dư dung dịch H2SO4 loãng nóng (trong điều kiện không có không khí), thu được dung dịch X là 7,84 lít khí H2 (ở đktc). Cô cạn dung dịch X (trong điều kiện không có không khí) được m gam muối khan. Vậy giá trị của m tương ứng là:
A. 42,6
B. 45,5
C. 48,8
D. 47,1
Đáp án: D
Giải thích:
Bảo toàn H có
naxit phản ứng = = 0,35 mol
Bảo toàn khối lượng có:
mKL + maxit phản ứng = mmuối + mkhí
→ m = 13,5 + 0,35.98 – 0,35.2
= 47,1 gam.
Câu 13: Cho một luồng khí CO đi qua ống sứ đựng m gam Fe2O3 nung nóng. Sau một tời gian thu được 10,44 gam chất rắn X gồm Fe, FeO, Fe2O3 và Fe3O4. Hoà tan hết X trong dung dịch HNO3 đặc, nóng thu được 4,368 lít NO2 (sản phẩm khử duy nhất, ở đktc). Giá trị của m là:
A. 12
B. 24
C. 10,8
D. 16
Đáp án: A
Giải thích:
Bảo toàn electron có:
2.nCO phản ứng =
→ nCO = 0,0975 mol =
Bảo toàn khối lượng có:
mCO phản ứng + m = mX +
→ m = 10,44 + 0,0975.44 – 0,0975.28
= 12 gam.
Câu 14: Cho 9,12 gam hỗn hợp gồm FeO, Fe2O3, Fe3O4 tác dụng với dung dịch HCl dư. Sau khi các phản ứng xảy ra hoàn toàn, được dung dịch Y; cô cạn Y thu được 7,62 gam FeCl2 và m gam FeCl3. Giá trị của m là:
A. 6,50
B. 9,75
C. 7,80
D. 8,75
Đáp án: B
Giải thích:
Quy đổi hỗn hợp ban đầu thành FeO (x mol) và Fe2O3 ( y mol)
→ 72x + 160y = 9,12 (1)
Cho hỗn hợp vào HCl
→ nFeO = x = = 0,06 mol
Thay vào (1) được y = 0,03 mol
→ = 2y = 0,06 mol
→ m = 0,06.162,5 = 9,75 gam.
Câu 15: Cho 4,48 lít khí CO (ở đktc) từ từ đi qua ống sứ nung nóng đựng 8 gam một oxit sắt đến khi phản ứng xảy ra hoàn toàn. Khí thu được sau phản ứng có tỉ khối so với H2 bằng 20. Công thức của oxit sắt và phần trăm thể tích khí CO2 trong hỗn hợp sau phản ứng là:
A. FeO, 75%
B. Fe2O3, 75%
C. Fe2O3, 65%
D. Fe3O4, 75%
Đáp án: B
Giải thích:
Khí sau phản ứng là COdư (x mol) và CO2 (y mol)
Bảo toàn C có:
x + y = nCO ban đầu = 0,2 mol
mkhí = 0,2.2.20 = 8 gam
→ 28x + 44y = 8
Giải hệ phương trình được x = 0,05 và y = 0,15
→ % =
Bảo toàn khối lượng có:
mCO phản ứng + moxit = + mFe
→ mFe= 8 + 0,15.28 – 0,15.44
= 5,6 gam
→ nFe = 0,1 mol
mO (oxit) = moxit – mFe
= 8 – 5,6 = 2,4 gam
→ nO(oxit) = 0,15 mol
Đặt oxit là FexOy có
x : y = nFe : nO= 0,1 : 0,15 = 2 : 3
→ Fe2O3.
Câu 16: Cho 26,8 gam hỗn hợp X gồm: Al và Fe2O3, tiến hành phản ứng nhiệt nhôm cho tới khi hoàn toàn (giả sử chỉ xảy ra phản ứng khử Fe2O3 thành Fe). Hỗn hợp sản phẩm sau phản ứng cho tác dụng với lượng dư dung dịch HCl được 11,2 lít H2 (đktc). Khối lượng của Al trong X là:
A. 5,4 gam
B. 7,02 gam
C. 9,72 gam
D. 10,8 gam
Đáp án: D
Giải thích:
PTHH của phản ứng nhiệt nhôm:
2Al + Fe2O3 Al2O3 + 2Fe
Trường hợp 1: Al hết
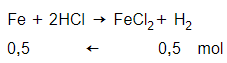
→ mFe = 0,5.56 = 28 (g) > 26,8 (g)
(Loại vì mâu thuẫn định luật bảo toàn khối lượng).
Trường hợp 2: Al dư
2Al + 6HCl → 2AlCl3 + 3H2
Fe + 2HCl → FeCl2 + H2
Gọi a, b lần lượt là số mol của Al và Fe2O3 ban đầu.
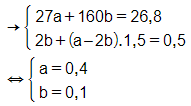
Vậy mAl = 27.0,4 = 10,8 (g).
Câu 17: Cho các cặp kim loại nguyên chất tác dụng trực tiếp với nhau: Fe và Al, Fe và Zn, Fe và Sn, Fe và Ni. khi nhúng các cặp kim loại trên vào dung dịch HCl, số cặp kim loại trong đó Fe bị phá huỷ trước là
A. 4
B. 1
C. 2
D. 3
Đáp án: C
Giải thích:
Hai kim loại tiếp xúc trực tiếp với nhau tạo thành hai điện cực, hai điện cực này cùng tiếp xúc với dung dịch chất điện li là dung dịch HCl → Xảy ra hiện tượng ăn mòn điện hóa.
Trong hai kim loại, kim loại nào có tính khử mạnh hơn sẽ bị ăn mòn trước.
Cặp kim loại trong đó Fe bị phá huỷ trước chính là cặp mà Fe có tính khử mạnh hơn: Fe và Sn; Fe và Ni.
Câu 18: Cho khí CO (dư) đi qua ống sứ nung nóng đựng hỗn hợp X gồm: Al2O3, MgO, Fe3O4, CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm:
A. MgO, Fe, Cu
B. Mg, Fe, Cu
C. MgO, Fe3O4, Cu
D. Mg, FeO, Cu
Đáp án: A
Giải thích:
CO chỉ khử được oxit của kim loại đứng sau Al trong dãy hoạt động hóa học
→ Chất rắn Y gồm: Al2O3; MgO; Fe; Cu.
Cho Y vào dung dịch NaOH (dư) chỉ có Al2O3 tan
→ Z gồm: MgO; Fe; Cu
Câu 19: Cho hỗn hợp Fe và Cu phản ứng với dung dịch HNO3 loãng. Sau khi phản ứng hoàn toàn, thu được dung dịch chỉ chứa 1 chất tan và kim loại dư. Chất tan đó là:
A. Fe(NO3)3
B. Fe(NO3)2
C. HNO3
D. Cu(NO3)2
Đáp án: B
Giải thích:
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Sau phản ứng Fe dư tiếp tục tác dụng hết với Cu(NO3)2, Fe(NO3)3
→ dung dịch chỉ chứa Fe(NO3)2, kim loại dư là Cu
Fe + Cu(NO3)2 → Fe(NO3)2 + Cu
Fe + 2Fe(NO3)3 →3Fe(NO3)2
Câu 20: Kim loại nào sau đây điều chế bằng phương pháp nhiệt luyện?
A. Ca
B. Ba
C. Na
D. Fe
Đáp án: D
Giải thích:
Các kim loại kiềm, kiềm thổ chỉ được điều chế bằng phương pháp điện phân nóng chảy muối clorua hoặc hiđroxit của chúng.
Fe có thể điều chế được bằng phương pháp thủy luyện, nhiệt luyện hoặc điện phân dung dịch muối.
Câu 21: Cho dung dịch FeCl3 tác dụng với dung dịch NaOH tạo thành kết tủa có màu
A. nâu đỏ.
B. trắng.
C. xanh thẫm.
D. trắng xanh.
Đáp án: A
Giải thích:
Fe(OH)3 kết tủa nâu đỏ.
Fe(OH)2 kết tủa trắng xanh
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Câu 22: Để thu được Al2O3 từ hỗn hợp Al2O3 và Fe2O3, người ta lần lượt dùng:
A. H2 ở nhiệt độ cao, dung dịch NaOH dư
B. Khí CO ở nhiệt độ cao, dung dịch HCl dư
C. Dung dịch NaOH dư, dung dịch HCl dư, nung nóng
D. Dung dịch NaOH dư, CO2 dư, nung nóng
Đáp án: D
Giải thích:
Sau khi cho hỗn hợp tác dụng với NaOH dư thì:
2NaOH + Al2O3 → 2NaAlO2 + H2O
→ Tách được Fe2O3.
Sục tiếp CO2 và dung dịch thu được:
CO2 + NaAlO2 + 2H2O → Al(OH)3 + NaHCO3.
Sau đó đun nóng:
2Al(OH)3 Al2O3 + 3H2O
Câu 23: Cho một mẫu quặng sắt (sau khi đã loại bỏ các tạp chất không chứa sắt) vào dung dịch HNO3 đặc nóng, thấy thoát ra khí NO2 (duy nhất). Cho dung dịch BaCl2 vào dung dịch sau phản ứng không thấy có kết tủa. Quặng đã đem hòa tan thuộc loại:
A. Pirit
B. Xiđerit
C. Hematit
D. Manhetit
Đáp án: D
Giải thích:
A. Sai. Quặng pirit FeS2 tác dụng với HNO3 thu được dung dịch X chứa . Khi thêm BaCl2 vào dung dịch X thấy kết tủa BaSO4
B. Sai. Quặng xiđerit FeCO3 tác dụng với dung dịch HNO3 sinh ra khí NO2 và CO2.
C. Sai. Quặng hematit Fe2O3 tác dụng với HNO3 chỉ xảy ra phản ứng trao đổi, không sinh ra khí
D. Đúng. Quặng đã đem hòa tan là manhetit.
Câu 24: Khi thêm dung dịch Na2CO3 vào dung dịch FeCl3 sẽ có hiện tượng gì xảy ra?
A. Xuất hiện kết tủa màu nâu đỏ vì xảy ra hiện tượng thủy phân
B. Dung dịch vẫn có màu nâu đỏ vì chúng không phản ứng với nhau
C. Xuất hiện kết tủa màu nâu đỏ đồng thời có hiện tượng sủi bọt khí
D. Có kết tủa nâu đỏ tạo thành sau đó lại tan do tạo khí CO2
Đáp án: C
Giải thích:
Phương trình phản ứng:
2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓(đỏ nâu) + 3CO2↑ + 6NaCl
Câu 25: Khối lượng tinh thể FeSO4.7H2O cần thêm vào 198,4 gam dung dịch FeSO4 5% để thu được dung dịch FeSO4 15% là
A. 65,4 gam
B. 30,6 gam
C. 50,0 gam
D. Tất cả đều sai
Đáp án: C
Giải thích:
Trong 198,4 gam FeSO4 5% có:
= = 9,92 gam
Gọi số mol tinh thể cần thêm vào là x (mol)
→ Khối lượng chất tan FeSO4 sau khi thêm bằng 9,92 + 152x (gam)
Khối lượng dung dịch sau khi thêm bằng 198,4 + 278x (gam)
→ = 15%
→ x = 0,18 mol
→ Khối lượng tinh thể FeSO4.7H2O cần thêm vào bằng
278.x = 278.0,18 = 50,0 gam
Câu 26: Gang và thép là hợp kim của sắt, tìm phát biểu đúng?
A. Gang là hợp kim Fe – C (5 đến 10%).
B. Nguyên tắc sản xuất gang là khử Fe trong oxit bằng CO, H2 hay Al ở nhiệt độ cao.
C. Nguyên tắc sản xuất thép là oxi hóa các tạp chất trong gang (C, Si, Mn, S, P) thành oxit nhằm giảm hàm lượng của chúng.
D. Thép là hợp kim Fe – C (2 đến 5%).
Đáp án: C
Giải thích:
A. Sai. Gang là hợp kim của sắt với cacbon, trong đó hàm lượng cacbon chiếm từ 2-5%
B. Sai. Nguyên tắc sản xuất gang: dùng CO khử oxit sắt ở nhiệt độ cao trong lò luyện kim.
C. Đúng.
D. Sai. Thép là hợp kim của sắt với cacbon và một số nguyên tố khác (C, Mn, S, Si,…), trong đó hàm lượng cacbon chiếm dưới 2%.
Câu 27: Trong các tính chất vật lí của sắt thì tính chất nào là đặc biệt?
A. Có nhiệt độ nóng chảy và nhiệt độ sôi cao.
B. Dẫn điện và dẫn nhiệt tốt.
C. Khối lượng riêng rất lớn.
D. Có khả năng nhiễm từ.
Đáp án: D
Giải thích:
Khác với các kim loại khác, chỉ sắt có khả năng nhiễm từ.
Câu 28: Nhỏ từ từ đến dư dung dịch FeSO4 đã được axit hóa bằng H2SO4 vào dung dịch KMnO4. Mô tả hiện tượng quan sát được
A. Dung dịch màu tím hồng bị nhạt dần rồi chuyển sang màu vàng.
B. Dung dịch màu tím hồng bị nhạt dần đến không màu.
C. Dung dịch màu tím hồng bị chuyển dần sang màu đỏ.
D. Dung dịch màu tím bị mất ngay, sau đó dần dần xuất hiện trở lại thành dung dịch có màu hồng.
Đáp án: A
Giải thích:
Dung dịch KMnO4 ban đầu có màu tím hồng, sau phản ứng thu được dung dịch muối Fe2(SO4)3 màu vàng.
Phương trình phản ứng:
10FeSO4 + 8H2SO4 + 2KMnO4 → 5Fe2(SO4)3 + 2MnSO4 + 8H2O + K2SO4
Câu 29: Hòa tan hoàn toàn m gam Fe bằng dung dịch HCl dư, thu được 2,24 lít khí H2 (đktc). Giá trị của m là
A. 11,2
B. 5,6
C. 2,8
D. 8,4
Đáp án: B
Giải thích:
Bảo toàn số mol electron:
2.nFe = 2.
→ nFe = = 0,1 mol
→ m = 0,1.56 = 5,6 gam
Câu 30: Dẫn khí CO dư qua ống sứ đựng 7,2 gam bột FeO nung nóng, thu được hỗn hợp khí X. Cho toàn bộ X vào nước vôi trong dư, thu được m gam kết tủa. Biết các phản ứng xảy ra hoàn toàn. Giá trị của m là
A. 5,0
B. 10,0
C. 7,2
D. 15,0
Đáp án: B
Giải thích:
nFeO = 7,2 : 72 = 0,1 mol
nO (trong oxit) = nCO phản ứng
= = 0,1 mol
Hỗn hợp khí X gồm CO2 và CO dư. Sục X vào nước vôi trong dư chỉ có CO2 phản ứng
→ = 0,1.100 = 10 gam
Các câu hỏi Trắc nghiệm Hóa học lớp 12 có đáp án, chọn lọc khác:
Trắc nghiệm Luyện tập: Tính chất hóa học của crom, đồng và hợp chất của chúng có đáp án
Trắc nghiệm Nhận biết một số ion trong dung dịch có đáp án
Trắc nghiệm Nhận biết một số chất khí có đáp án
Trắc nghiệm Luyện tập: Nhận biết một số chất vô cơ có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
