TOP 40 câu Trắc nghiệm Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ (có đáp án 2024) - Hóa học 12
Bộ 40 bài tập trắc nghiệm Hóa học lớp 12 Bài 26: Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 12.
Trắc nghiệm Hóa học 12 Bài 26: Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ
Câu 1: Hợp chất nào của canxi được dùng để đúc tượng, bó bột khi gãy xương?
A. Đá vôi (CaCO3).
B. Thạch cao nung (CaSO4.H2O).
C. Thạch cao khan (CaSO4).
D. Thạch cao sống (CaSO4.2H2O).
Đáp án: B
Giải thích:
Thạch cao nung (CaSO4.H2O) có khả năng kết dính tốt nên trong y học dùng để bó bột; trong xây dựng dùng để sản xuất xi măng chịu nước; đúc tượng, đúc các mẫu chi tiết tinh vi dùng trang trí nội thất; làm phấn viết.
Câu 2: Nước cứng không gây tác hại nào sau đây?
A. Làm giảm khả năng tẩy rửa của xà phòng, làm cho quần áo mau mục nát.
B. Làm tắc các đường ống nước nóng.
C. Gây ngộ độc khi uống.
D. Làm giảm mùi vị của thực phẩm khi nấu.
Đáp án: C
Giải thích:
Tác hại của nước cứng:
- Đun tốn nhiệt, gây nổ nồi hơi.
- Tốn xà phòng, gây hư hại quần áo
- Giảm lưu lượng của đường ống dẫn nước.
- Giảm mùi vị của đồ ăn thức uống.
Nước cứng không gây ngộ độc khi uống.
Câu 3: Phát biểu nào sau đây đúng?
A. Trong các nhóm IIA chỉ có Be không phản ứng với H2O ở nhiệt độ thường.
B. Có thể dùng cát để dập tắt đám cháy Mg.
C. Ca có thể đẩy Fe ra khỏi dung dịch muối
D. Trong số các kim loại kiềm thổ bền, chỉ có kim loại bari có cấu trúc mạng tinh thể lập phương tâm khối.
Đáp án: D
Giải thích:
A. Sai vì Trong nhóm IIA có Be và Mg không phản ứng với H2O ở nhiệt độ thường.
B. Sai vì cát (SiO2) có thể phản ứng với Mg ở nhiệt độ cao, do vậy dùng cát dập tắt sẽ làm đám cháy to hơn.
2Mg + SiO2 Si + 2MgO
C. Ca không thể đẩy Fe ra khỏi dung dịch muối vì Ca phản ứng với nước trong dung dịch.
Ca + 2H2O → Ca(OH)2 + H2
D. Đúng
Câu 4: Phản ứng sản xuất vôi: CaCO3 (r) → CaO (r) + CO2 (k); ∆H > 0.
Biện pháp kĩ thuật tác động vào quá trình sản xuất vôi để tăng hiệu suất phản ứng là
A. giảm nhiệt độ.
B. tăng nhiệt độ và giảm áp suất khí CO2.
C. tăng áp suất.
D. giảm nhiệt độ và tăng áp suất khí CO2.
Đáp án: B
Giải thích:
Để làm câu hỏi này chú ý đến nguyên lí chuyển dịch cân bằng Lơ Sa-tơ-li-ê (Một phản ứng đang ở trạng thái cân bằng khi thay đổi các yếu tố nồng độ, nhiệt độ, áp suất, nhiệt độ thì cân bằng chuyển dịch theo hướng làm giảm tác động của các yếu tố đó)
Chiều thuận (∆H > 0): phản ứng thu nhiệt → tăng nhiệt độ cân bằng chuyển dịch theo chiều thuận
Giảm áp suất khí CO2 → Cân bằng chuyển dịch theo hướng tăng áp suất của hệ tức theo chiều thuận
Câu 5: Cho các phát biểu sau:
Trong nhóm IIA của bảng tuần hoàn, đi từ Be đến Ba,
(1) bán kính nguyên tử tăng dần
(2) tính kim loại tăng dần.
(3) nhiệt độ nóng chảy giảm dần.
(4) nhiệt độ sôi giảm dần.
(5) khối lượng riêng thay đổi không theo quy luật
Trong các phát biểu trên, số phát biểu đúng là
A. 2
B. 3
C. 4
D. 5
Đáp án: B
Giải thích:
Trong nhóm IIA của bảng tuần hoàn, đi từ trên xuống dưới theo chiều tăng điện tích hạt nhân bán kính nguyên tử tăng dần, tính kim loại của các nguyên tố mạnh dần đồng thời tính phi kim yếu dần.
Kim loại kiềm thổ không có cùng cấu tạo mạng tinh thể nên tính chất vật lí (nhiệt độ nóng chảy, nhiệt độ sôi, khối lượng riêng,...) biến đổi không có quy luật.
→ Các phát biểu đúng là (1), (2), (5)
Câu 6: Trước khi thi đấu các môn thể thao, các vận động viên thường xoa một ít chất X dưới dạng bột mịn màu trắng làm tăng ma sát và hút ẩm. X là
A. MgCO3.
B. CaOCl2.
C. CaO.
D. Tinh bột.
Đáp án: A
Giải thích:
Chất X là MgCO3 có tên gọi là magie cacbonat.
MgCO3 là chất bột rắn, màu trắng, mịn, nhẹ có tác dụng hút ẩm rất tốt. Khi thi đấu, bàn tay của các vận động viên thường có nhiều mồ hôi, sẽ làm giảm độ ma sát khiến các vận động viên không thể nắm chắc các dụng cụ thi đấu. Điều này không chỉ ảnh hưởng xấu đến thành tích mà còn gây nguy hểm. MgCO3 có tác dụng thấm hút mồ hôi, đồng thời tăng cường độ ma sát giữa bàn tay các các dụng cụ thi đấu. Giúp các vận động viên thi đấu tốt hơn.
Câu 7: Cho các chất sau đây: HCl, NaCl, Ca(OH)2, Na2CO3. NaHCO3. Số chất có thể làm mềm nước cứng tạm thời là
A. 5.
B. 3.
C. 2.
D. 1
Đáp án: C
Giải thích:
Nước cứng tạm thời là nước cứng có chứa ion Ca2+, Mg2+,
Ca(OH)2 và Na2CO3 có khả năng làm mềm nước cứng tạm thời
Câu 8: Hỗn hợp X chứa Na2O, NH4Cl, NaHCO3 và BaCl2 với số mol các chất bằng nhau. Cho hỗn hợp X vào nước dư và đun nóng. Các chất tan trong dung dịch thu được là
A. NaCl, NaOH, BaCl2.
B. NaCl, NaOH.
C. NaCl, NaHCO3, NH4Cl, BaCl2.
D. NaCl.
Đáp án: D
Giải thích:
Phản ứng xảy ra khi hỗn hợp tác dụng với nước:
Na2O + H2O → 2NaOH
Các phản ứng xảy ra tiếp theo:
NH4Cl + NaOH → NH3↑ + H2O + NaCl
NaHCO3+ NaOH → Na2CO3 + H2O
Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl
Vậy sau phản ứng dung dịch còn lại NaCl
Câu 9: Cho 0,448 lít CO2 hấp thụ hết vào 100 ml dung dịch chứa hỗn hợp NaOH 0,06M và Ba(OH)2 0,12M thu được m gam kết tủa. Giá trị m là
A. 1,182.
B. 3,940.
C. 2,364.
D. 1,970
Đáp án: D
Giải thích:
= 0,02 mol;
nOH- = 0,03 mol;
= 0,012 mol
Ta có: T =
Vậy dung dịch sau phản ứng chứa (x mol) và (y mol)
Bảo toàn C có:
x + y = = 0,02 (1)
Bảo toàn số mol điện tích âm có:
2x + y = nOH- = 0,03 (2)
Từ (1) và (2) có x = y = 0,01 (mol)
Lại có:
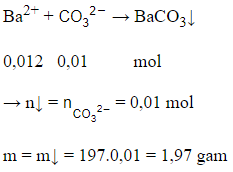
Câu 10: Chất X tác dụng với dung dịch HCl. Khi chất X tác dụng với dung dịch Ca(OH)2 sinh ra kết tủa. Chất X là
A. AlCl3
B. CaCO3
C. BaCl2
D. Ca(HCO3)2
Đáp án: D
Giải thích:
Ca(HCO3)2 là chất lưỡng tính:
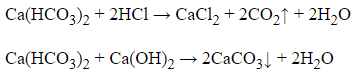
Vậy chất X là Ca(HCO3)2.
Câu 11: Không gặp kim loại kiềm và kim loại kiềm thổ ở dạng tự do trong tự nhiên vì
A. đây là những kim loại hoạt động hóa học rất mạnh.
B. thành phần của chúng trong tự nhiên rất nhỏ.
C. đây là những kim loại điều chế được bằng phương pháp điện phân.
D. đây là những kim loại nhẹ.
Đáp án: A
Giải thích:
Do là những kim loại hoạt động hóa học rất mạnh nên kim loại kiềm và kim loại kiềm thổ tồn tại ở dạng hợp chất trong tự nhiên.
Câu 12: Từ hai muối X và Y thực hiện các phản ứng sau:
X → X1 + CO2
X1 + H2O → X2
X2 + Y → X + Y1 + H2O
X2 + 2Y → X + Y2 + H2O
Hai muối X, Y tương ứng là
A. CaCO3, NaHSO4.
B. BaCO3, Na2CO3.
C. CaCO3, NaHCO3.
D. MgCO3, NaHCO3.
Đáp án: C
Giải thích:
Nhận thấy đáp án X đều là hợp chất muối cacbonat MCO3, X1 là MO.
X2 + H2O → X2.
Do đó X2 là M(OH)2 (loại D vì MgO không tan trong nước)
Để X2 + Y → X + Y2 + H2O và X2 + 2Y
→ X + Y2 + H2O thì chỉ có 1 trường hợp thỏa mãn là:
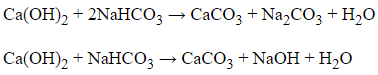
Câu 13: Hỗn hợp X gồm 2 kim loại A và B thuộc phân nhóm chính nhóm II, ở 2 chu kỳ liên tiếp. Cho 1,76 gam X tan hoàn toàn trong dung dịch HCl dư thu được 1,344 lít khí H2 (đktc). Cô cạn dung dịch sau phản ứng, khối lượng muối khan thu được là
A. 6,02 gam
B. 3,98 gam
C. 5,68 gam
D. 6,58 gam
Đáp án: A
Giải thích:
Nhận thấy đáp án X đều là hợp chất muối cacbonat MCO3, X1 là MO.
X2 + H2O → X2.
Do đó X2 là M(OH)2 (loại D vì MgO không tan trong nước)
Để X2 + Y → X + Y2 + H2O và X2 + 2Y
→ X + Y2 + H2O thì chỉ có 1 trường hợp thỏa mãn là:
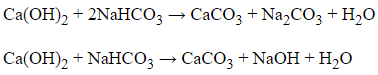
Câu 14: Một hỗn hợp A nặng 7,2 gam gồm 2 muối cacbonat của 2 kim loại kiềm thổ. Hoà tan hết A bằng H2SO4 loãng thu được khí B, cho B hấp thụ hết vào 450 ml dung dịch Ba(OH)2 0,2M được 15,76 gam kết tủa. Nếu thêm nước vôi trong vào dung dịch sau phản ứng lại thấy có kết tủa xuất hiện. Kim loại chắc chắn có mặt trong hỗn hợp A là
A. Be.
B. Mg.
C. Ca.
D. Sr.
Đáp án: A
Giải thích:
Đặt công thức chung 2 muối cacbonat là MCO3
Phản ứng:
MCO3 + H2SO4 → MSO4 + H2O + CO2
CO2 phản ứng với dung dịch Ba(OH)2
= 0,08 mol; = 0,09 mol
Dung dịch sau phản ứng có phản ứng kết tủa với nước vôi trong → trong dung dịch có muối axit
CO2 + Ba(OH)2 BaCO3 + H2O
2CO2 + Ba(OH)2 Ba(HCO3)2
Bảo toàn nguyên tố Ba:
→ = 0,09 – 0,08 = 0,01 mol
Bảo toàn nguyên tố C trong hai muối
→ = 0,08 + 2.0,01 = 0,1 mol
→ = = 0,1 mol
→ MM = 12 (g/mol)
→ Kim loại chắc chắn có mặt trong hỗn hợp có M < 12 là Be (MBe = 9 (g/mol))
Câu 15: Cho 2,4 gam Mg vào dung dịch HCl dư đến khi các phản ứng xảy ra hoàn toàn, thu được V lít H2 (ở đktc). Giá trị của V là
A. 2,24 lít.
B. 6,72 lít.
C. 3,36 lít.
D. 4,48 lít.
Đáp án: A
Giải thích:
Bảo toàn electron:
2 = 2nMg
→ = nMg = 0,1 mol
V = 2,24 lít
Câu 16: Cho 3,36 lít CO2 ở đktc vào 200 ml dung dịch hỗn hợp NaOH 1M và Ba(OH)2 0,5M. Khối lượng kết tủa thu được sau phản ứng là:
A. 9,85 gam
B. 19,7 gam
C. 14,775 gam
D. 1,97 gam
Đáp án: B
Giải thích:
= = 0,15 (mol),
= 0,4 (mol)
→ = 2,67
→ OH- dư, sản phẩm thu được là muối trung hòa
= 0,2.0,5 = 0,1 mol
→
Câu 17: Cho 0,88 gam hỗn hợp gồm một kim loại kiềm thổ và oxit của nó tác dụng với dung dịch HCl dư thu được 2,85 gam muối khan. Kim loại kiềm thổ là
A. Ca.
B. Mg.
C. Ba.
D. Sr.
Đáp án: B
Giải thích:
Đặt công thức chung của kim loại và oxit là MOx (0 < x < 1) với số mol là a
Sơ đồ phản ứng:
MOx MCl2 + H2O + H2
mhh = a(M + 16x) = 0,88 (1)
và mmuối = a(M + 71) = 2,85 (2)
Chia từng vế của (1) cho (2) ta được:
=
→ 1,97M = 62,48 – 45,6x
Vì 0 < x < 1 nên 8,7 < M < 31,7
Vậy M là Be hoặc Mg
Dựa trên 4 đáp án đề bài cho → chọn B.
Câu 18: Nung nóng một hỗn hợp gồm CaCO3 và MgO tới khối lượng không đổi , thì số gam chất rắn còn lại chỉ bằng 2/3 số gam hỗn hợp trước khi nung. Vậy trong hỗn hợp ban đầu thì CaCO3 chiếm phần trăm theo khối lượng là:
A. 75,76%
B. 24,24%
C. 66,67%
D. 33,33%
Đáp án: A
Giải thích:
CaCO3 CaO + CO2↑
Giả sử số mol CaCO3 trong hỗn hợp đầu là 1 mol
→ = = 1 mol
→ mtrước – msau =
= mtrước – 2/3mtrước
→ mtrước = 3.
= 3.1.44 = 132g
→ % =
= 75,76%
Câu 19: Trong công nghiệp, Mg được điều chế bằng cách nào dưới đây?
A. Điện phân nóng chảy MgCl2.
B. Điện phân dung dịch MgSO4.
C. Cho kim loại K vào dung dịch Mg(NO3)2.
D. Cho kim loại Fe vào dung dịch MgCl2.
Đáp án: A
Giải thích:
Kim loại kiềm thổ chỉ được điều chế bằng phương pháp điện phân nóng chảy muối halogenua
MgCl2 Mg + Cl2
Câu 20: Cho lần lượt các kim loại. Be; Na, K, Ba, Ca, Fe, Ag vào nước. Số phản ứng xảy ra ở điều kiện thường là
A. 3.
B. 5.
C. 2.
D. 4.
Đáp án: D
Giải thích:
Chỉ có kim loại kiềm và kiềm thổ (trừ Be và Mg) phản ứng với H2O ở điều kiện thường.
→ Các kim loại đề bài có Na, K, Ba và Ca thỏa mãn
→ Có 4 kim loại thỏa mãn
Câu 21: Dung dịch X chứa hỗn hợp NaOH a mol/l và Ba(OH)2 b mol/l. Để trung hoà 50 ml dung dịch X cần 100 ml dung dịch HCl 0,1M. Mặt khác, sục 179,2 ml CO2 (đktc) vào 50 ml dung dịch X thu được 0,2955 gam kết tủa. Giá trị của a là
A. 0,17.
B. 0,14.
C. 0,185.
D. 0,04.
Đáp án: B
Giải thích:
Gọi số mol NaOH và Ba(OH)2 trong 50 ml dung dịch X lần lượt là x và y (mol)
= x + 2y (mol);
= y (mol)
Phản ứng trung hoà:
=
→ x + 2y = 0,1.0,1 = 0,01 mol
Phản ứng với CO2:
= 8.10-3 mol
= 1,25
→ Hai chất tham gia phản ứng hết, phản ứng tạo 2 muối
= 0,01 – 8.10-3 = 2.10-3 mol
= 0,2955 : 197
= 1,5.10-3 mol >
→ Toàn bộ Ba2+ đã đi vào kết tủa
=
= 1,5.10-3 mol
→ b = = 0,03 (mol/l)
nNaOH = - 2
= 0,01 - 2.1,5.10-3 = 7.10-3 mol
→ a = = 0,14 (mol/l)
Câu 22: Dung dịch A chứa a mol Na+, b mol , c mol CO32-, d mol . Khi cho 100 ml dung dịch Ba(OH)2 nồng độ f vào dung dịch trên thì lượng kết tủa thu được là lớn nhất. Biểu thức tính f theo a và b là:
A. f =
B. f =
C. f =
D. f =
Đáp án: A
Giải thích:
Khi kết tủa lớn nhất: toàn bộ ion HCO3-, CO32-, SO42- đã chuyển hoá và đi vào kết tủa
Dung dịch còn lại NaOH
→ = a + b
→ 2.0,1.f = a + b
→
Câu 23: Khi cho dung dịch Ca(OH)2 vào dung dịch Ca(HCO3)2 thấy có
A. bọt khí và kết tủa trắng.
B. bọt khí bay ra.
C. kết tủa trắng xuất hiện.
D. kết tủa trắng sau đó kết tủa tan dần.
Đáp án: C
Giải thích:
Phương trình phản ứng
Ca(OH)2 + Ca(HCO3)2 → 2CaCO3 + 2H2O
Câu 24: Cấu hình electron lớp ngoài cùng của nguyên tử kim loại kiềm thổ là
A. ns2np2
B. ns2np1
C. ns1
D. ns2
Đáp án: D
Giải thích:
Kim loại kiềm thổ thuộc nhó IIA của bảng tuần hoàn nguyên tố hóa học.
Nguyên tử các nguyên tố nhóm IIA đều có 2 electron lớp ngoài cùng và có cấu hình electron chung là ns2 (n là số lớp electron)
Câu 25: Thành phần chính của đá vôi canxi cacbonat là
A. CaSO3
B. CaCl2
C. CaCO3
D. Ca(HCO3)2.
Đáp án: C
Giải thích:
Thành phần chính của đá vôi là CaCO3 có tên gọi là canxi cacbonat. CaCO3 là chất rắn ở điều kiện thường, không tan trong nước, có màu trắng
Câu 26: Để loại bỏ lớp cặn trong ấm đun nước lâu ngày, người ta có thể dùng dung dịch nào sau đây?
A. Giấm ăn
B. Nước vôi
C. Muối ăn
D. Cồn 70˚
Đáp án: A
Giải thích:
Lớp cặn trong cặn ấm đun nước thường là CaCO3 (có thể do nước sử dụng là nước cứng tạm thời, toàn phần,...). Dùng giấm ăn (có chứa axit yếu là axit axetic CH3COOH) để hòa tan cặn
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 + H2O
Câu 27: Trong một cốc có a mol Ca2+, b mol Mg2+, c mol Cl-, d mol HCO3-. Biểu thức liên hệ giữa a,b,c,d là:
A. a + b = c + d
B. 2a + 2b = c + d
C. 3a + 3b = c + d
D. 2a + b = c + d
Đáp án: B
Giải thích:
Áp dụng định luật bảo toàn điện tích
→
→ 2a + 2b = c + d
Câu 28: Hỗn hợp X gồm Ba và Al. Cho m gam X vào nước dư, thu được 1 mol khí. Mặt khác, cho 3m gam X tác dụng hết với dung dịch Ba(OH)2 dư, thu được 3,9 mol khí. Giá trị của m là:
A. 43,7
B. 47,75
C. 53,15
D. 103,6
Đáp án: C
Giải thích:
3m gam X tác dụng hết với dung dịch Ba(OH)2 dư, thu được 3,9 mol khí
→ m gam X tác dụng hết với dung dịch Ba(OH)2 dư, thu được 1,3 lít khí
Gọi x = nBa
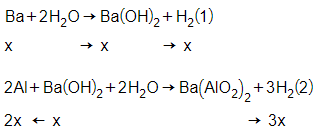
Do tác dụng với nước chỉ thu được 1 mol H2 mà tác dụng với dung dịch Ba(OH)2 dư lại tạo ra 1,3 mol H2 nên sau khi cho hỗn hợp X tác dụng với H2O thì Al vẫn còn dư tạo ra thêm 0,3 mol H2
Theo phương trình (1) và (2) ta có:
= x + 3x = 1
→ x = 0,25
→ m = mBa + mAl pư + mAl còn dư
= 137.x + 27.2x + 27.0,2 = 53,15g
Câu 29: Hòa tan hỗn hợp Na, Ba vào nước dư thu được 800 ml dung dịch A và 0,896 lít H2 (đktc). Giá trị pH của dung dịch A bằng:
A. 10.
B. 11.
C. 12.
D. 13.
Đáp án: D
Giải thích:
= 0,04 mol
Gọi R là kí hiệu chung của Na và Ba, hóa trị của chúng là x.
2R + 2xH2O 2R(OH)x + xH2↑
= 2 = 0,08 mol
→ pOH = –lg[OH-]
= –lg(0,08/0,8) = 1
→ pH = 13
Câu 30: Sự tạo thạch nhũ trong các hang động đá vôi là quá trình hóa học diễn ra trong hang động hàng triệu năm. Phản ứng hóa học diễn tả quá trình đó là:
A. MgCO3 + CO2 + H2O → Mg(HCO3)2.
B. Ca(HCO3) → CaCO3 + CO2 + H2O.
C. CaCO3 + CO2 + H2O → Ca(HCO3)2.
D. CaO + CO2 → CaCO3.
Đáp án: B
Giải thích:
Phản ứng Ca(HCO3)2 → CaCO3 + CO2 + H2O giải thích sự tạo thành thạch nhũ trong các hang động đá vôi, cặn trong ấm đun nước,..
Phản ứng CaCO3 + CO2 + H2O → Ca(HCO3)2 giải thích sự xâm thực đá vôi của nước mưa.
Các câu hỏi Trắc nghiệm Hóa học lớp 12 có đáp án, chọn lọc khác:
Trắc nghiệm Nhôm và hợp chất của nhôm có đáp án
Trắc nghiệm Luyện tập tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng có đáp án
Trắc nghiệm Luyện tập tính chất của nhôm và hợp chất của nhôm có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
