TOP 40 câu Trắc nghiệm Hợp chất của sắt (có đáp án 2024) - Hóa học 12
Bộ 40 bài tập trắc nghiệm Hóa học lớp 12 Bài 32: Hợp chất của sắt có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 12.
Trắc nghiệm Hóa học 12 Bài 32: Hợp chất của sắt
Câu 1: Kim loại nào sau đây không tan trong dung dịch FeCl3?
A. Fe
B. Mg
C. Ni
D. Ag
Đáp án: D
Giải thích:
Cặp oxi hóa - khử Fe3+/Fe2+ đứng trước cặp oxi hóa - khử Ag+/Ag trong dãy điện hóa.
→ Theo quy tắc α thì Ag không tác dụng với dung dịch FeCl3
Câu 2: Chất nào sau đây khi phản ứng với dung dịch HNO3 đặc nóng sẽ không sinh ra khí?
A. FeO
B. Fe3O4
C. Fe2O3
D. Fe(OH)2
Đáp án: C
Giải thích:
+ Dung dịch HNO3 (đặc, nóng, dư) là một chất oxi hóa mạnh, khi tác dụng với các hợp chất sắt ở mức oxi hóa trung bình như +2 hoặc +8/3 thì sắt trong các oxit đó sẽ bị oxi hóa lên mức cao nhất là +3, đồng thời nitơ trong axit nitric sẽ bị khử về mức +4 tạo thành NO2.
+ Khi các hợp chất của sắt ở mức oxi hóa +3 tác dụng với axit nitric (đặc, nóng) thì chỉ đơn thuần là phản ứng trao đổi, không phải phản ứng oxi hóa khử nên không tạo chất khí.
Fe2O3 + 6HNO3 → 2Fe(NO3)3 + 3H2O
Câu 3: Cho dung dịch FeCl3 vào dung dịch chất X, thu được kết tủa Fe(OH)3. Chất X là
A. H2S.
B. AgNO3.
C. NaOH.
D. NaCl.
Đáp án: C
Giải thích
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Câu 4: Hòa tan một lượng FexOy bằng H2SO4 loãng dư được dung dịch X. Biết X vừa có khả năng làm mất màu dung dịch thuốc tím, vừa có khả năng hòa tan được bột Cu. Oxit sắt đó là:
A. FeO
B. Fe2O3
C. Fe3O4
D. A hoặc B
Đáp án: C
Giải thích:
Dung dịch X vừa làm mất màu dung dịch thuốc tím, vừa có khả năng hòa tan được bột Cu
→ Trong dung dịch X có Fe2+ và Fe3+.
→ Oxit sắt là Fe3O4.
Phương trình phản ứng:
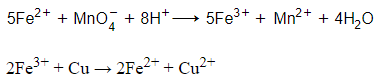
Câu 5: Hòa tan hoàn toàn 2,8 gam hỗn hợp FeO, Fe2O3 và Fe3O4 cần vừa đủ V ml dung dịch HCl 1M, thu được dung dịch X. Cho từ từ dung dịch NaOH dư vào dung dịch X thu được kết tủa Y. Nung Y trong không khí đến khối lượng không đổi thu được 3 gam chất rắn. Tính V?
A. 87,5 ml
B. 125 ml
C. 62,5 ml
D. 175 ml
Đáp án: A
Giải thích:
FeO, Fe2O3, Fe3O4 FeCl2, FeCl3 Fe2O3
= 3 : 160 = 0,01875 gam
Coi hỗn hợp ban đầu gồm Fe, O.
nFe = 2 = 2.0,01875
= 0,0375 mol
→ nO =
= 0,04375 mol
Bảo toàn nguyên tố O
→ = nO = 0,04375 mol
Bảo toàn nguyên tố H:
nHCl = 2 = 2.0,04375
= 0,0875 mol
→ V = 87,5 ml.
Câu 6: Cho hỗn hợp gồm 2,8g Fe và 3,2g Cu vào dung dịch HNO3 thu được dung dịch A, V lít khí NO2 ở đktc (sản phẩm khử duy nhất) và còn dư 1,6g kim loại. Biết các phản ứng xảy ra hoàn toàn. Khối lượng muối thu được khi cô cạn dung dịch A và giá trị của V là:
A. 10,6g và 2,24 lít
B. 14,58g và 3,36 lít
C. 16.80g và 4,48 lít
D. 13,7g và 3,36 lít
Đáp án: D
Giải thích:
Dư 1,6g kim loại
→ mCu dư = 1,6g;
dung dịch A gồm: Fe(NO3)2; Cu(NO3)2
→ nCu phản ứng = 3,2 – 1,6 = 1,6 gam
→ = nCu phản ứng = 0,025 mol
→ = 0,025.188 = 4,7 gam
= 0,05 mol
→ = 0,05.180 = 9 gam
→ m muối = 4,7 + 9 = 13,7 gam
Bảo toàn electron
→ = 2nFe + 2nCu phản ứng
= 2. 0,05 + 2. 0,025 = 0,15 mol
→
Câu 7: Dung dịch A gồm 0,4 mol HCl và 0,05 mol Cu(NO3)2. Cho m gam bột Fe vào dung dịch, khuấy đều cho đến khi phản ứng kết thúc thu được chất rắn X gồm hai kim loại có khối lượng 0,8m gam. Giả sử sản phẩm khử HNO3 duy nhất chỉ có NO. Giá trị của m bằng:
A. 20 gam
B. 30 gam
C. 40 gam
D. 60 gam
Đáp án: C
Giải thích:
Sau phản ứng thu được hỗn hợp gồm 2 kim loại Fe, Cu → H+ và NO3-, Cu2+ hết.
Dung dịch chỉ chứa FeCl2: 0,2 mol (bảo toàn Cl- = 0,4 mol), Cu: 0,05 mol
→ m Fe pư = 0,2 .56 = 11,2 gam
→ 0,8m gam kim loại gồm:
mFe dư = m - 11,2 gam và
mCu = 0,05.64 = 3,2 gam
→ 0,8m = 3,2 + m - 0,2.56
→ m = 40 gam.
Câu 8: Để khử hoàn toàn 17,6 gam hỗn hợp gồm Fe, FeO, Fe2O3, Fe3O4 cần dùng vừa đủ 2,24 lít H2 (đo ở đktc). Khối lượng Fe thu được là
A. 15 gam.
B. 17 gam.
C. 16 gam.
D. 18 gam.
Đáp án: C
Giải thích:
= nO trong oxit
= 2,24 : 22,4 = 0,1 mol
mFe = m hỗn hợp - mO
→ mFe = 17,6 – 0,1.16
→ mFe = 16 gam
Câu 9: Cách nào sau đây có thể dùng để điều chế FeO?
A Dùng CO khử Fe2O3 ở 500°C.
B Nhiệt phân Fe(OH)2 trong không khí.
C. Nhiệt phân Fe(NO3)2
D. Đốt cháy FeS trong oxi.
Đáp án: A
Giải thích:
Khử Fe2O3 bằng CO trong lò cao ở nhiệt độ khoảng 500 - 600oC thu được FeO là sản phẩm chính.
3Fe2O3 + CO 2Fe3O4 + CO2
Fe3O4 + CO 3FeO + CO2
Câu 10: Dung dịch loãng chứa hỗn hợp 0,01 mol Fe(NO3)3 và 0,15 mol HCl có khả năng hòa tan tối đa lượng Fe là:
A. 0,28 gam
B. 1,68 gam
C. 4,20 gam
D. 3,64 gam
Đáp án: D
Giải thích:
Lượng sắt phản ứng là tối đa nên sau phản ứng chỉ thu được muối sắt (II)
hết, phản ứng tính theo
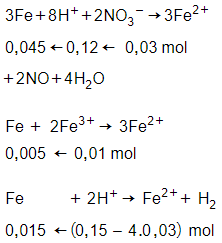
nFe = 0,045 + 0,005 + 0,015
= 0,065 mol
→ mFe = 0,065.56 = 3,64 gam.
Câu 11: Có thể điều chế Fe(OH)3 bằng cách:
A. Cho Fe2O3 tác dụng với H2O
B. Cho Fe2O3 tác dụng với NaOH vừa đủ
C. Cho muối sắt(III) tác dụng axit mạnh
D. Cho muối sắt(III) tác dụng dung dịch NaOH dư
Đáp án: D
Giải thích:
Có thể điều chế Fe(OH)3 bằng cách Cho muối sắt(III) tác dụng dung dịch NaOH dư
FeCl3 + 3NaOH dư → Fe(OH)3 + 3NaCl
Câu 12: Oxit nào sau đây bị oxi hóa khi phản ứng với dung dịch HNO3 loãng?
A. MgO.
B. FeO.
C. Fe2O3.
D. Al2O3.
Đáp án: B
Giải thích:
Trong các oxit MgO, Fe2O3, Al2O3 các kim loại đều có số oxi hóa cao nhất nên không bị oxi hóa khi phản ứng với dung dịch HNO3 loãng
Fe trong FeO có số oxi hóa +2 chưa phải là mức oxi hóa cao nhất nên bị oxi hóa bởi dung dịch HNO3 loãng lên mức oxi hóa +3
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
Câu 13: Để khử ion Fe3+ trong dung dịch thành ion Fe2+ có thể dùng một lượng dư
A. kim loại Mg.
B. kim loại Cu.
C. kim loại Ba.
D. kim loại Ag.
Đáp án: B
Giải thích:
A. Không dùng Mg vì dư Mg sẽ thu được kim loại sắt
Mg + 2Fe3+ → Mg2+ + 2Fe2+
Mg + Fe2+ → Mg2+ + Fe
B. Dùng lượng dư Cu
Cu + 2Fe3+ → Cu2+ + 2Fe2+
C. Không dùng Ba vì Ba phản ứng với nước trong dung dịch tạo hiđroxit kết tủa với Fe3+
Ba + 2H2O → Ba(OH)2 + H2
3OH- + Fe3+ → Fe(OH)3
D. Ag không khử được Fe3+
Câu 14: Hòa tan hết 4 gam hỗn hợp A gồm Fe và 1 oxit sắt trong dung dịch axit HCl (dư) thu được dung dịch X. Sục khí Cl2 cho đến dư vào X thu được dung dịch Y chứa 9,75 gam muối tan. Nếu cho 4 gam A tác dụng với dung dịch HNO3 loãng dư thì thu được V lít NO (sản phẩm khử duy nhất, đktc). Tính V?
A. 0,896
B. 0,726
C. 0,747
D. 1,120
Đáp án: C
Giải thích:
= 9,75 : 162,5 = 0,06 mol
Quy đổi hỗn hợp A về (Fe và O)
nFe = = 0,06 mol
→ nO = = 0,04 mol
Nếu cho A tác dụng với dung dịch HNO3. Bảo toàn electron ta có:
3nFe = 3nNO + 2nO
→ 3.0,06 = 3.nNO + 2.0,04
→ nNO = 0,033 → VNO = 0,747 lít
Câu 15: Hòa tan hết m gam Fe bằng 400 ml dung dịch HNO3 1M. Sau khi phản ứng xảy ra hoàn toàn, thu được dung dịch chứa 26,44 gam chất tan và khí NO (sản phẩm khử duy nhất). Giá trị của m là:
A. 7,84
B. 6,12
C. 5,60
D. 12,24
Đáp án: A
Giải thích:
= 0,4 mol
→ = 0,4.63 = 25,2 gam
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O (1)
Phản ứng (1) xảy ra, khối lượng chất tan giảm đi, mà theo đề bài, khối lượng chất tan là 26,44 gam > 25,2 gam nên xảy ra phản ứng hoà tan Fe dư
2Fe3+ + Fe → 3Fe2+ (2)
→ Phản ứng (1) xảy ra hoàn toàn,
nFe(1) =
= = 0,1 mol
→ mFe(1) = 5,6 gam
+ = 26,44
→ = 26,44 – 0,1.242 = 2,24 gam
→ mFe = 5,6 + 2,24 = 7,84 gam
Câu 16: Sắt tác dụng với H2O ở nhiệt độ nhỏ hơn 570 °C thì tạo ra H2 và sản phẩm rắn là
A. FeO.
B. Fe3O4.
C. Fe2O3.
D. Fe(OH)2.
Đáp án: B
Giải thích:
Phương trình phản ứng
3Fe + 4H2O Fe3O4 + 4H2
Câu 17: Hoà tan hoàn toàn một lượng hỗn hợp X gồm Fe3O4 và FeS2 trong 63 gam dung dịch HNO3 nồng độ a (%), thu được 1,568 lít NO2 (đktc) duy nhất và dung dịch Y. Dung dịch Y tác dụng vừa đủ với 200 ml dung dịch NaOH 2M, lọc kết tủa đem nung đến khối lượng không đổi, thu được 9,76 gam chất rắn. Giá trị của a là
A. 47,2
B. 46,2
C. 46,6
D. 44,2
Đáp án: B
Giải thích:
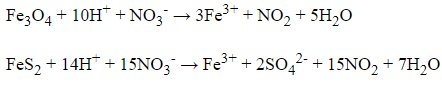
Đặt số mol Fe3O4 và số mol FeS2 lần lượt là a và b mol
→ a + 15b = = 0,07 mol (1)
= 0,061 mol
→ 3a + b = 0,061.2 = 0,122 mol (2)
Từ (1) và (2) có:
a = 0,04 và b = 0,002 mol
(Y) = nNaOH – 3.
= 0,4 – 3.0,122 = 0,034 mol
= 10a + 14b + (Y)
= 10.0,04 + 14.0,002 + 0,034
= 0,462 mol
→ = a =
Câu 18: Cho sơ đồ phản ứng sau: Fe → muối X1 → muối X2 → muối X3 → Fe
X1, X2, X3 là các muối của sắt (II)
Theo thứ tự X1, X2, X3 lần lượt là:
A. FeCO3, Fe(NO3)2, FeSO4
B. FeS, Fe(NO3)2, FeSO4
C. Fe(NO3)2, FeCO3, FeSO4
D. FeCl2, FeSO4, FeS
Đáp án: C
Giải thích:
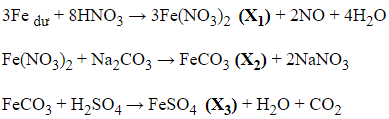
Câu 19: Có thể dùng một hóa chất để phân biệt Fe2O3 và Fe3O4. Hóa chất này là:
A. dung dịch NaOH đặc
B. dung dịch HCl đặc
C. dung dịch H2SO4
D. dung dịch HNO3 đặc
Đáp án: D
Giải thích:
Dùng dung dịch HNO3 đặc vì Fe2O3 chỉ xảy ra phản ứng trao đổi, nhưng Fe3O4 xảy ra phản ứng oxi hóa khử tạo ra khí không màu hóa nâu trong không khí.
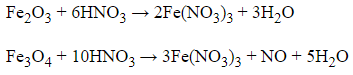
Câu 20: Hòa tan hoàn toàn hỗn hợp FeS và FeCO3 bằng một lượng dung dịch H2SO4 đặc nóng thu được hỗn hợp gồm hai khí X, Y. Công thức hóa học của X, Y lần lượt là:
A. H2S và SO2
B. H2S và CO2
C. SO2 và CO
D. SO2 và CO2
Đáp án: D
Giải thích:
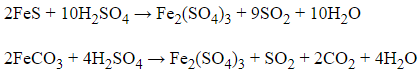
→ Hỗn hợp A gồm SO2 và CO2
Câu 21: Oxit nào sau đây tác dụng với dung dịch HCl dư tạo ra hai muối
A. FeO
B. Fe2O3
C. Fe3O4
D. CuO
Đáp án: C
Giải thích:
Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Câu 22: Cho 3,6 gam FeO phản ứng vừa đủ với dung dịch chứa a mol HCl. Giá trị của a là
A. 1,00.
B. 0,50.
C. 0,75.
D. 1,25.
Đáp án: A
Giải thích:
nFeO = 3,6 : 72
= 0,05 mol = nO
Bảo toàn nguyên tố:
nH = 2 = 2nO
= 2.0,05 = 0,1mol
nHCl = nH = 0,1 mol
Câu 23: Hỗn hợp X gồm Fe và FeS. Cho m gam X tác dụng hết với dung dịch HCl dư, thu được V lít khí (đktc). Mặt khác, m gam X tác dụng hết với dung dịch HNO3 dư, thu được dung dịch Y chỉ chứa một muối nitrat duy nhất và 2V lít hỗn hợp khí (đktc) gồm NO và SO2. Phần trăm khối lượng của Fe trong X là:
A. 45,9%
B. 54,1%
C. 43,9%
D. 52,1%
Đáp án: A
Giải thích:
Giả sử hỗn hợp có x mol Fe và 1 mol FeS
Phản ứng với HCl khí tạo thành là H2 (x mol) và H2S (1 mol)
→ V = (x + 1).22,4 (lít) (1)
Phản ứng với HNO3
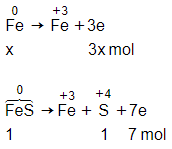
→ Sản phẩm khử có 1 mol SO2 và mol NO
→ 2V = (1 + ).22,4 lít (2)
Từ (1) và (2) có
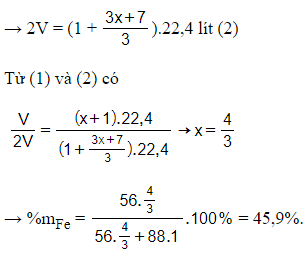
Câu 24: Trộn 10,8g bột Al với 34,8g bột Fe3O4 rồi tiến hành phản ứng nhiệt nhôm trong điều kiện không có không khí. Hoà tan hoàn toàn hỗn hợp rắn sau phản ứng bằng dung dịch H2SO4 loãng (dư) thu được 10,752 lít khí H2 (đktc). Hiệu suất của phản ứng nhiệt nhôm là
A. 80%
B. 90%
C. 70%
D. 60%
Đáp án: A
Giải thích:
nAl = 0,4 mol; = 0,15 mol
Giả sử H = x
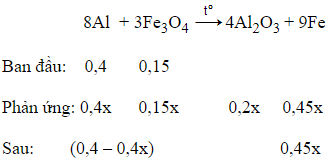
Bảo toàn electron:
3.nAl + 2.nFe = 2.
→ 1,5(0,4 – 0,4x) + 0,45x = 0,48
→ x = 0,8
→ H% = 80%
Câu 25: Nhiệt phân Fe(OH)2 trong không khí đến khối lượng không đổi, thu được chất rắn là
A. Fe(OH)3.
B. Fe3O4.
C. Fe2O3.
D. FeO.
Đáp án: C
Giải thích:
4Fe(OH)2 + O2 2Fe2O3 + 4H2O
Câu 26: Cho 5,8 gam FeCO3 tác dụng với dung dịch HNO3 vừa đủ, thu được dung dịch X và hỗn hợp khí gồm CO2, NO. Cho dung dịch HCl dư vào dung dịch X được dung dịch Y, dung dịch Y hòa tan tối đa m gam Cu, sinh ra sản phẩm khử NO duy nhất. Giá trị của m là
A. 9,6
B. 11,2
C. 14,4
D. 16
Đáp án: D
Giải thích:
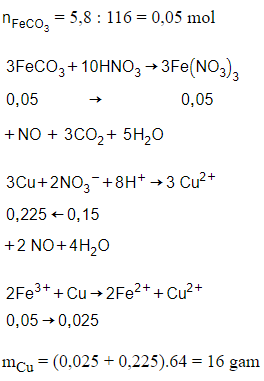
Câu 27: Hòa tan hoàn toàn x mol CuFeS2 bằng dung dịch HNO3 đặc, nóng (dư) sinh ra y mol NO2 (sảm phẩm khử duy nhất). Liên hệ đúng giữa x và y là:
A. y = 17x
B. x = 15y
C. x = 17y
D. y = 15x
Đáp án: A
Giải thích:
x mol CuFeS2 + HNO3 đặc, nóng
→ y mol NO2
Ta có các quá trình nhường, nhận electron:
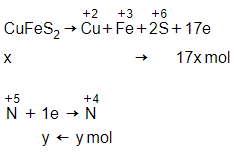
Bảo toàn electron ta có: 17x = y
Câu 28: Cho sơ đồ phản ứng:
![]()
Hai chất x, y lần lượt là
A. AgNO3, Cl2
B. FeCl3, Cl2
C. HCl, FeCl3
D. Cl2, FeCl3
Đáp án: B
Giải thích:
Phương trình phản ứng
Fe + 2FeCl3 (x) → 3FeCl2
2Fe + 3Cl2 (y) → 2FeCl3
Câu 29: Hòa tan hoàn toàn 2,16 gam FeO trong lượng dư dung dịch HNO3 loãng thu được V lít (đktc) khí NO là sản phẩm khử duy nhất. Tính V?
A. 0,224 lít.
B. 0,336 lít.
C. 0,448 lít.
D. 2,240 lít.
Đáp án: A
Giải thích:
nFeO = 2,16 : 72 = 0,03 mol
Phương trình phản ứng:
![]()
Bảo toàn electron:
nFeO = 3.nNO
→ 0,03 = 3.nNO
→ nNO = 0,01 mol
→ VNO = 0,01.22,4 = 0,224 lít
Câu 30: Khử hoàn toàn 16 gam bột oxit sắt bằng CO ở nhiệt độ cao. Sau phản ứng khối lượng khí tăng thêm 4,8 gam. Công thức của oxit sắt là công thức nào sau đây?
A. FeO
B. FeO2
C. Fe2O3
D. Fe3O4
Đáp án: C
Giải thích:
Phản ứng của oxit + CO thực chất là:
CO + [O]trong chất rắn → CO2
Khối lượng khí tăng chính là khối lượng chất rắn giảm
→ mchất rắn giảm = mO phản ứng = 4,8g
→ nO = 4,8 : 16 = 0,3 mol
→ mFe = mOxit – mO
= 16 – 4,8 = 11,2
→ nFe = 11,2 : 56 = 0,2 mol
→ nFe : nO = 0,2 : 0,3 = 2 : 3
→ Oxit là Fe2O3
Các câu hỏi Trắc nghiệm Hóa học lớp 12 có đáp án, chọn lọc khác:
Trắc nghiệm Hợp kim của sắt có đáp án
Trắc nghiệm Crom và hợp chất của crom có đáp án
Trắc nghiệm Đồng và hợp chất của đồng có đáp án
Trắc nghiệm Sơ lược về niken, kẽm, chì, thiếc có đáp án
Trắc nghiệm Luyện tập: Tính chất của sắt và hợp chất của sắt có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
