TOP 40 câu Trắc nghiệm Luyện tập tính chất của nhôm và hợp chất của nhôm (có đáp án 2024) - Hóa học 12
Bộ 40 bài tập trắc nghiệm Hóa học lớp 12 Bài 29: Luyện tập tính chất của nhôm và hợp chất của nhôm có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 12.
Trắc nghiệm Hóa học 12 Bài 29: Luyện tập tính chất của nhôm và hợp chất của nhôm
Câu 1: Trong công nghiệp, Al được điều chế bằng cách nào dưới đây?
A. Dùng Mg đẩy Al khỏi dung dịch AlCl3.
B. Điện phân nóng chảy AlCl3.
C. Điện phân dung dịch AlCl3.
D. Điện phân nóng chảy Al2O3.
Đáp án: D
Giải thích:
Phương pháp duy nhất điều chế Al là điện phân nhóng chảy oxit nhôm, trong hỗn hợp có criolit nóng chảy ở 90oC với điện cực là C than chì
Câu 2: Phản ứng giữa cặp chất nào sau đây gọi là phản ứng nhiệt nhôm?
A. Al2O3 và NaOH
B. Al2O3 và HCl
C. Al và Fe2O3
D. Al và HCl
Đáp án: C
Giải thích:
Phản ứng nhiệt nhôm là phản ứng Al khử oxit kim loại (kim loại đứng sau Al trong dãy hoạt động hóa học) thành kim loại
2Al + Fe2O3 Al2O3 + 2Fe
Câu 3: Chất nào dưới đây không tác dụng với dung dịch AlCl3?
A. AgNO3
B. Ag
C. NaOH
D. dung dịch NH3
Đáp án: B
Giải thích:
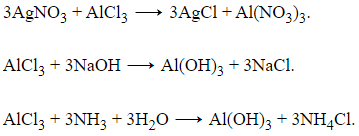
Câu 4: Cho 2 phương trình phản ứng sau:
(1) 2Al + 6HCl → 2AlCl3 + 3H2
(2) 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
Trong các kết luận sau, kết luận nào không đúng?
A. Nhôm khử được ion H+ của axit trong dung dịch axit.
B. Nhôm phản ứng được với dung dịch kiềm.
C. Nhôm phản ứng với cả dung dịch axit và dung dịch kiềm nên nhôm là chất lưỡng tính.
D. Nhôm là kim loại có tính khử mạnh. Trong cả 2 phản ứng này, Al đều bị oxi hóa thành ion dương.
Đáp án: C
Giải thích:
Nhôm không phải là chất lưỡng tính, nó tác dụng được với dung dịch kiềm là do tác dụng với nước tạo Al(OH)3 tan trong dung dịch kiềm.
Câu 5: Cho các dung dịch AlCl3, NaAlO2, FeCl3 và các chất khí: NH3, CO2, HCl. Khi cho các dung dịch và các chất khí phản ứng với nhau từng đôi một thì số trường hợp xảy ra phản ứng là
A. 2.
B. 3.
C. 4.
D. 6.
Đáp án: C
Giải thích:
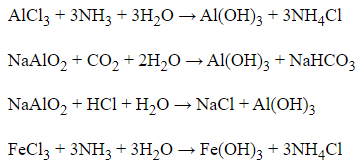
Câu 6: Một dung dịch chứa a mol NaAlO2 tác dụng với dung dịch chứa b mol HCl. Điều kiện để sau phản ứng thu được lượng kết tủa lớn nhất là
A. a = b.
B. 0 < b < a.
C. b > a.
D. a = 2b.
Đáp án: A
Giải thích:
Để thu được lượng kết tủa lớn nhất thì HCl phản ứng vừa đủ với NaAlO2, không còn dư để hòa tan kết tủa.
Phương trình phản ứng:
NaAlO2 + HCl + H2O → NaCl + Al(OH)3
→ a = b
Câu 7: Tại sao phèn chua có tác dụng làm trong nước?
A. Phèn chua phản ứng với các chất bẩn thành các chất tan trong nước.
B. Phèn chua chứa các ion K+, Al3+, SO42- có thể hấp phụ các chất lơ lửng trong nước.
C. Khi hòa tan trong nước, phèn chua thủy phân ra ion H+, ion này hấp phụ rất tốt các chất lơ lửng trong nước.
D. Khi hòa tan trong nước, phèn chua thủy phân ra Al(OH)3. Al(OH)3 với bề mặt phát triển, hấp phụ các chất lơ lửng trong nước, kéo chúng cùng lắng xuống dưới.
Đáp án: D
Giải thích:
Khi cho phèn chua vào nước sẽ phân li ra ion Al3+. Chính ion Al3+ này bị thủy phân theo phương trình:
Al3+ + 3H2O → Al(OH)3↓ + 3H+
Kết quả tạo ra Al(OH)3 là chất kết tủa dạng keo nên khi khuấy phèn chua vào nước, nó kết dính các hạt đất nhỏ lơ lửng trong nước đục thành hạt đất to hơn, nặng và chìm xuống làm trong nước.
Câu 8: Cho 2 dung dịch A và B. Dung dịch A chứa Al2(SO4)3, dung dịch B chứa KOH. Cho 150 ml hoặc 600 ml dung dịch B vào 200 ml dung dịch A. Sau phản ứng hoàn toàn, lọc lấy kết tủa, nung đến khối lượng không đổi thu được 0,204 gam chất rắn. Nồng độ mol của dung dịch A là
A. 0,0325.
B. 0,0650.
C. 0,0130.
D. 0,0800.
Đáp án: A
Giải thích:
Gọi nồng độ mol của Al2(SO4)3 và KOH lần lượt là a và b (mol/l)
Trường hợp 1: 150 ml dung dịch B vào 200 ml dung dịch A, KOH hết, Al2(SO4)3 dư
→ 0,15b = 6.
→ b = 0,08M
Trường hợp 2: 600ml dung dịch B vào 200 ml dung dịch A, Al2(SO4)3 phản ứng hết tạo kết tủa, kết tủa này tan một phần trong KOH dư
→ 0,6.0,08 = 4.2.0,2a – 2.
→ a = 0,0325M
Câu 9: Hoà tan 7,584 gam một muối kép của nhôm sunfat có dạng phèn nhôm hoặc phèn chua vào nước ấm được dung dịch A. Đổ từ từ 300 ml dung dịch NaOH 0,18M vào dung dịch trên thì thấy có 0,78 gam kết tủa và không có khí thoát ra. Kim loại hoá trị I trong muối trên là
A. Li.
B. Na.
C. K.
D. Rb.
Đáp án: C
Giải thích:
Công thức của phèn chua hoặc phèn nhôm có dạng: M2SO4.Al2(SO4)3.24H2O
= 0,3.0,18 = 0,054 mol
= 0,78 : 78 = 0,01 mol
Vì > 3., nên đã có phản ứng hòa tan 1 phần kết tủa
Đặt số mol Al3+ trong phèn là x mol
Phương trình phản ứng:
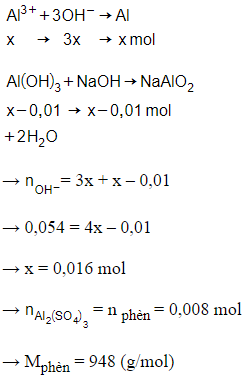
Suy ra M là Kali
Câu 10: Khi nói về quá trình điều chế Al trong công nghiệp, mệnh đề nào dưới đây là không đúng?
A. Trong quặng boxit, ngoài Al2O3 còn có tạp chất là SiO2 và Fe2O3.
B. Cả 2 điện cực của thùng điện phân Al2O3 đều làm bằng than chì.
C. Trong quá trình điện phân, cực âm sẽ bị mòn dần và được hạ thấp dần xuống.
D. Sử dụng khoáng chất criolit sẽ giúp tiết kiệm năng lượng cho quá trình sản xuất.
Đáp án: C
Giải thích:
Trong quá trình điện phân, cực dương sẽ bị mòn dần và được hạ thấp dần xuống.
Câu 11: Phân biệt ba hỗn hợp chất rắn là X (Fe, Al), Y(Al, Al2O3), Z(Fe, Al2O3) có thể chỉ dùng một hoá chất duy nhất là
A. Dung dịch HNO3 đặc nguội.
B. Dung dịch NaOH.
C. Dung dịch HCl.
D. Dung dịch FeCl3.
Đáp án: B
Giải thích:
Ta dùng NaOH để phân biệt ba hỗn hợp chất rắn
- Hỗn hợp có 1 phẩn chất tan ra và có hiện tượng sủi bọt khí → X (Fe, Al)
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
- Hỗn hợp tan hết và có hiện tượng sủi bọt khí → Y (Al, Al2O3)
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Al2O3 + 2NaOH → 2NaAlO2 + H2O
- Hỗn hợp có một phần tan, không có sủi bọt khí → Z (Fe, Al2O3)
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Câu 12: Loại đá quặng nào sau đây không phải là hợp chất của nhôm?
A. Đá rubi.
B. Đá saphia.
C. Quặng boxit.
D. Quặng đôlômit.
Đáp án: D
Giải thích:
Rubi; saphia và boxit đều chứa Al2O3; còn đôlômit có thành phần chính là CaCO3.MgCO3.
Câu 13: Cho m gam một khối Al hình cầu có bán kính R vào 1,05 lít dung dịch H2SO4 0,1M. Biết rằng sau phản ứng hoàn toàn ta được một quả cầu có bán kính R/2. Giá trị của m là:
A. 2,16.
B. 3,78.
C. 1,08.
D. 3,24.
Đáp án: A
Giải thích:
Vhc = πR3 → bán kính giảm 2 lần thì thể tích giảm 8 lần → lượng Al đã phản ứng bằng lượng Al ban đầu.
Câu 14: Cho 1,62 gam nhôm vào một dung dịch HNO3. Sau khi phản ứng hoàn toàn thấy khối lượng dung dịch tăng lên 1,62 gam. Cô cạn dung dịch này thu được m gam muối khan. Giá trị của m là
A. 12,78.
B. 14,58.
C. 25,58.
D. 17,58.
Đáp án: B
Giải thích:
Thêm 1,62 gam nhôm vào dung dịch HNO3 thấy khối lượng dung dịch tăng 1,62 gam
→ phản ứng tạo muối NH4NO3
Các muối trong dung dịch gồm Al(NO3)3 và NH4NO3 (0,0225 mol)
Bảo toàn electron:
3.nAl = 8.
→ 3.0,06 = 8.
→ = 0,225 mol =
→ m =
= 213.0,06 + 80.0,0225 = 14,58 gam
Câu 15: Nung hỗn hợp bột gồm Al và Fe2O3 trong bình kín một thời gian thu được hỗn hợp X gồm Fe, FeO, Fe2O3, Fe3O4 và Al. Hòa tan hết X trong bằng dung dịch HNO3 dư thu được 1,344 lít (đktc) khí NO (là sản phẩm khử duy nhất). Khối lượng của Al trong hỗn hợp đầu là:
A. 0,54 gam
B. 0,27 gam
C. 1,62 gam
D. 0,81 gam
Đáp án: C
Giải thích:
Sơ đồ phản ứng
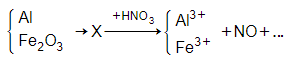
→ Chỉ có Al thay đổi số oxi hóa trong quá trình. Bảo toàn electron ta có:
ne nhường = ne nhận
→ 3nAl = 3nNO
→ nAl = nNO = 0,06 mol
→ mAl = 1,62g
Câu 16: Cho sơ đồ phản ứng sau:
Al → X → Al2O3 → Y → Z → Al(OH)3
X, Y, Z lần lượt có thể là
A. Al(NO3)3, NaAlO2, AlCl3
B. Al(NO3)3, Al(OH)3, AlCl3
C. AlCl3, Al2(SO4)3, NaAlO2
D. AlCl3, NaAlO2, Al2(SO4)3
Đáp án: A
Giải thích:
Phương trình phản ứng xảy ra lần lượt như sau: (mỗi mũi tên ứng với một phương trình)
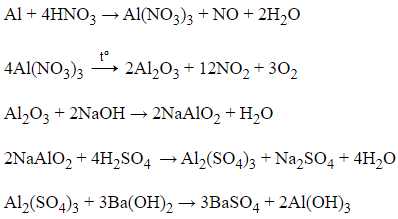
Câu 17: Khi cho từ từ dung dịch HCl đến dư vào dung dịch Na[Al(OH)4] thì hiện tượng xảy ra là:
A. ban đầu xuất hiện kết tủa keo trắng, sau một thời gian kết tủa tan dần.
B. ban đầu không có hiện tượng gì, sau một thời gian xuất hiện kết tủa keo trắng.
C. xuất hiện kết tủa keo trắng.
D. không có hiện tượng gì xảy ra.
Đáp án: A
Giải thích:
Khi cho dung dịch HCl đến dư vào dung dịch Na[Al(OH)4] ta có các phương trình:
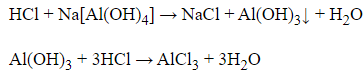
→ Hiện tượng xảy ra là ban đầu xuất hiện kết tủa keo trắng, sau một thời gian kết tủa tan dần
Câu 18: Dùng m gam Al để khử hết 1,6 gam Fe2O3 (phản ứng nhiệt nhôm). Cho sản phẩm sau phản ứng hoàn toàn tác dụng với lượng dư dung dịch NaOH thu được 0,672 lít khí (đktc). Giá trị của m là
A. 0,540.
B. 1,755.
C. 1,080.
D. 0,810.
Đáp án: C
Giải thích:
Cho sản phẩm sau phản ứng hoàn toàn tác dụng với dung dịch NaOH dư thu được khí H2
→ Al còn dư sau phản ứng nhiệt nhôm
→ Tính toán theo số mol Fe2O3
Phương trình hóa học:
Ta có:
→ nAl ban đầu = nAl phản ứng + nAl dư
= 0,02 + 0,02 = 0,04 mol
→ m = 0,04.27 = 1,08 gam
Câu 19: Những vật dụng bằng nhôm không bị gỉ khi để lâu trong không khí vì bề mặt của những vật dụng này có một lớp màng. Lớp màng này là?
A. Al2O3 rất mỏng, bền và mịn, không cho nước và khí thấm qua.
B. Al(OH)3 không tan trong nước đã ngăn cản không cho Al tiếp xúc với nước và không khí.
C. Hỗn hợp Al2O3 và Al(OH)3 đều không tan trong nước đã bảo vệ nhôm.
D. Nhôm tinh thể đã bị thụ động hóa bởi nước và không khí.
Đáp án: A
Giải thích:
Những vật làm bằng nhôm có một lớp oxit Al2O3 rất mỏng, bền và mịn, ngăn không cho nước và khí thấm qua, còn màng Al(OH)3 xuất hiện khi Al tác dụng với nước ngăn cản nhôm tiếp xúc với nước
Câu 20: Nhiệt phân 20 gam Al(NO3)3 một thời gian thu được 11,9 gam chất rắn Y. Hiệu suất quá trình nhiệt phân là
A. 46,75%.
B. 37,5%.
C. 62,50%.
D. 53,25%.
Đáp án: D
Giải thích:
Ta có:
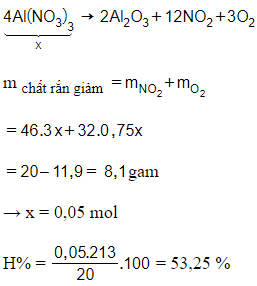
Câu 21: Thành phần hóa học chính của quặng boxit là
A. Na3AlF6
B. Al2O3.2H2O
C. FeS2
D. CuSO4.5H2O
Đáp án: A
Giải thích:
Quặng boxit: Al2O3.2H2O
Câu 22: Cho 2,7 gam Al phản ứng hoàn toàn với dung dịch HCl dư , thu được V lít H2 (đktc) . Giá trị của V là
A. 4,48 lít
B. 2,24 lít
C. 3,36 lít
D. 6,72 lít
Đáp án: C
Giải thích:
nAl = = 0,1 mol
Bảo toàn electron: 3.nAl = 2.
→ 3.0,1 = 2.
→ = 0,15 mol
→ = 0,15.22,4 = 3,36 lít
Câu 23: Để thu được Al2O3 từ hỗn hợp Al2O3 và Fe2O3 người ta lần lượt:
A. Dùng khí H2 ở nhiệt độ cao, dung dịch NaOH dư
B. Dùng khí CO ở nhiệt độ cao, dung dịch HCl dư
C. Dùng dung dịch NaOH dư, dung dịch HCl dư, rồi nung nóng.
D. Dùng dung dịch NaOH dư, khí CO2, rồi nung nóng.
Đáp án: D
Giải thích:
- Cho hỗn hợp qua dung dịch NaOH dư, Al2O3 tan hết trong dung dịch, Fe2O3 không tan
Al2O3 + 2NaOH → 2NaAlO2 + H2O
- Dẫn khí CO2 qua dung dịch vừa thu được
NaAlO2 + CO2 + 2H2O → Al(OH)3 + NaHCO3
- Nung nóng Al(OH)3
2Al(OH)3 Al2O3 + 3H2O
→ thu được Al2O3
Câu 24: Hòa tan hết 2,7 gam Al trong dung dịch HNO3 loãng thu được sản phẩm khử duy nhất là bao nhiêu lít NO (đktc)?
A. 2,24 lít
B. 3,36 lít
C. 4,48 lít
D. 5,6 lít
Đáp án: A
Giải thích:
nAl = = 0,1 mol
Bảo toàn electron: 3.nAl = 3.nNO
→ 3.0,1 = 3. nNO
→ nNO = 0,1 mol
→ = 0,1.22,4 = 2,24 lít
Câu 25: Kim loại Al không tan được trong dung dịch nào sau đây?
A. NaOH
B. BaCl2
C. HCl
D. Ba(OH)2
Đáp án: B
Giải thích:
Al có thể tác dụng được với dung dịch axit và dung dịch bazơ
Al không phản ứng được với dung dịch BaCl2
Câu 26: Trộn bột kim loại X với bột sắt oxit (gọi là hỗn hợp tecmit) để thực hiện phản ứng nhiệt nhôm dùng để hàn đường ray tàu hỏa. Kim loại X là
A. Fe
B. Cu
C. Ag
D. Al
Đáp án: D
Giải thích:
2Al + Fe2O3 Al2O3 + 2Fe
→ Kim loại X là nhôm (Al)
Câu 27: Hợp chất nào của nhôm tác dụng với dung dịch NaOH (theo tỉ lệ mol 1 : 1) cho sản phẩm NaAlO2
A. Al2(SO4)3
B. AlCl3
C. Al(NO3)3
D. Al(OH)3
Đáp án: D
Giải thích:
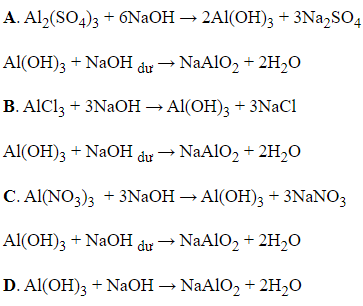
→ Al(OH)3 phản ứng với NaOH theo tỉ lệ mol 1 : 1 cho sản phẩm NaAlO2
Câu 28: Cho các phát biểu sau:
(a) Nước cứng là nước có nhiều ion Ca2+ và Ba2+.
(b) Cho dung dịch HCl vào dung dịch K2CrO4 thì dung dịch chuyển từ màu da cam sang màu vàng.
(c) Hỗn hợp tecmit dùng hàn đường ray xe lửa là hỗn hợp gồm Al và Fe2O3.
(d) Al(OH)3, Cr(OH)2, Zn(OH)2 đều là hiđroxit lưỡng tính.
(e) Mg được dùng làm chất trao đổi nhiệt trong các lò phản ứng hạt nhân.
Số phát biểu đúng là:
A. 3
B. 2
C. 1
D. 4
Đáp án: C
Giải thích:
Chỉ có một phát biểu đúng là c.
(a) Nước cứng là nước chứa nhiều ion Ca2+; Mg2+.
(b) Cho dung dịch HCl vào dung dịch K2CrO4 thì dung dịch chuyển từ màu vàng sang màu da cam.
HCl + 2K2CrO4 (dung dịch màu vàng) → H2O + K2Cr2O7 (dung dịch màu da cam) + 2KCl
(d) Cr(OH)2 không có tính lưỡng tính.
(e) Các kim loại kali và natri dùng làm chất trao đổi nhiệt trong một vài lò phản ứng hạt nhân
Câu 29: Cho m gam hỗn hợp gồm Al, Mg, Cu tan hoàn toàn trong dung dịch HNO3. Sau phản ứng thu được (m + 6,2 gam) muối khan (gồm 3 muối). Nung muối này tới khối lượng không đổi (Biết các phản ứng xảy ra hoàn toàn). Khối lượng chất rắn thu được là
A. (m + 1,6) gam
B. (m + 3,2) gam
C. (m) gam
D. (m + 0,8) gam
Đáp án: D
Giải thích:
= = 0,1 mol
Nhiệt phân muối thu được oxit kim loại, NO2, O2
Trong đó:
= 0,1 mol
→ = 0,025 mol
mrắn = m muối -
= m + 6,2 – 46.0,1 – 32.0,025
= m + 0,8
Câu 30: Đốt nóng một hỗn hợp gồm Al và 16 gam Fe2O3 (trong điều kiện không có không khí) đến khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp rắn X. Cho X tác dụng vừa đủ với V ml dung dịch NaOH 1M sinh ra 3,36 lít H2 (ở đktc). Giá trị của V là:
A. 150.
B. 100.
C. 200.
D. 300.
Đáp án: D
Giải thích:
X phản ứng với NaOH sinh ra H2; phản ứng xảy ra hoàn toàn nên Al dư.
Bảo toàn nguyên tố O:
= 0,1 mol
Bảo toàn electron: 3.nAl dư = 2
→ 3.nAl dư = 2.0,15
→ nAl dư = 0,1 mol
Bảo toàn nguyên tố Al và Na
→ + nAl dư
→ nNaOH = 2.0,1 + 0,1 = 0,3 mol
→ VNaOH = 0,3 lít = 300 ml
Các câu hỏi Trắc nghiệm Hóa học lớp 12 có đáp án, chọn lọc khác:
Trắc nghiệm Hợp chất của sắt có đáp án
Trắc nghiệm Hợp kim của sắt có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
