TOP 40 câu Trắc nghiệm Nhôm và hợp chất của nhôm (có đáp án 2024) - Hóa học 12
Bộ 40 bài tập trắc nghiệm Hóa học lớp 12 Bài 27: Nhôm và hợp chất của nhôm có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 12.
Trắc nghiệm Hóa học 12 Bài 27: Nhôm và hợp chất của nhôm
Câu 1: Số electron lớp ngoài cùng của nguyên tử Al là
A. 4.
B. 3.
C. 1.
D. 2.
Đáp án: B
Giải thích:
Cấu hình electron của nguyên tử nguyên tố Al (Z = 13): 1s22s22p63s23p1
Câu 2: Phèn chua được dùng trong ngành công nghiệp thuộc da, công nghiệp giấy, chất cầm màu trong ngành nhuộm vải, chất làm trong nước. Công thức hoá học của phèn chua là
A. Li2SO4.Al2(SO4)3.24H2O.
B. K2SO4. Al2(SO4)3.24H2O.
C. (NH4)2SO4. Al2(SO4)3.24H2O.
D. Na2SO4. Al2(SO4)3.24H2O.
Đáp án: B
Giải thích:
Phèn chua có công thức hóa học là K2SO4.Al2(SO4)3.24H2O hoặc KAl(SO4)2.12H2O
Câu 3: Hòa tan hoàn toàn m gam Al bằng dung dịch NaOH dư thu được 5,6 lít H2 (đktc). Giá trị của m là
A. 2,7
B. 4,5
C. 5,4
D. 6,75
Đáp án: B
Giải thích:
= 0,25 mol
Áp dụng định luật bảo toàn electron:
3.nAl = 2.
→ mAl = .27 = 4,5 gam
Câu 4: Hòa tan hết m gam bột Al trong dung dịch HCl thu được 2,24 lít H2 (đktc). Nếu hòa tan 2m gam bột Al trong dung dịch Ba(OH)2 được V lít H2 (đktc). Giá trị của V là
A, 1,12
B. 2,24
C. 3,36
D. 4,48
Đáp án: D
Giải thích:
Đặt số mol Al trong m gam Al bằng x (mol)
Bảo toàn electron cho phản ứng của Al với HCl
3.nAl = 2.
→ 3x = 2.
Bảo toàn electron cho phản ứng của Al với Ba(OH)2
→ 3.2x = 2.
→ = 2.
→ = 2.0,1 = 0,2 mol
→ V = 0,2.22,4 = 4,48 lít
Câu 5: Cho các quặng sau: pirit, thạch cao, mica, apatit, criolit, boxit, đolomit. Số quặng chứa nhôm là
A. 2.
B. 3.
C. 4.
D. 5.
Đáp án: B
Giải thích:
Pirit: FeS2
Thạch cao: CaSO4.nH2O
Mica: K2O.Al2O3.6SiO2.2H2O
Apatit: Ca5F(PO4)3 hay 3Ca3(PO4)2.CaF2
Criolit: Na3AlF6 hay AlF3.3NaF
Boxit: Al2O3.nH2O
Đolomit: CaCO3.MgCO3 (đá bạch vân)
→ Quặng mica, criolit, boxit chứa nhôm
Câu 6: Trong các cặp chất sau đây, cặp chất nào có thể cùng tồn tại trong một dung dịch?
A. AlCl3 và Na2CO3
B. HNO3 và NaHCO3
C. NaAlO2 và KOH
D. NaCl và AgNO3
Đáp án: C
Giải thích:
Cặp chất nào không phản ứng với nhau có thể cùng tồn tại trong một dung dịch
A. 3Na2CO3 + 2AlCl3 + H2O → 2Al(OH)3 + 6NaCl + 3CO2
B. HNO3 + NaHCO3 → NaNO3 + H2O + CO2
C. Cùng tồn tại
D. NaCl + AgNO3 → NaNO3 + AgCl
Câu 7: Dùng hóa chất nào sau đây để phân biệt Zn(NO3)2 và Al(NO3)3?
A. Dung dịch NaOH
B. Dung dịch Ba(OH)2
C. Dung dịch NH3
D. Dung dịch nước vôi trong
Đáp án: C
Giải thích:
Khi cho NH3 vào 2 dung dịch cả 2 dung dịch đều xuất hiện kết tủa hiđroxit, nhưng Zn(OH)2 tạo thành có khả năng tạo phức với NH3 nên kết tủa lại tan, còn với Al(OH)3 không tan trong NH3
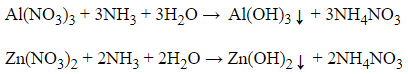
Dung dịch amoniac có khả năng hòa tan hiđroxit hay muối ít tan của một số kim loại (Ag, Cu, Zn), tạo thành các dung dịch phức chất.
Câu 8: Hòa tan hoàn toàn m gam Al vào dung dịch HNO3 loãng, thu được hỗn hợp gồm 0,12 mol khí NO2 và 0,08 mol khí NO (phản ứng không tạo NH4NO3). Giá trị của m là
A. 3,24.
B. 8,1.
C. 6,48.
D. 10,8.
Đáp án: A
Giải thích:
Bảo toàn số mol electron:
→ 3nAl = + 3nNO
→ 3.nAl = 0,12 + 3.0,08
→ nAl = 0,12 mol
→ mAl = 0,12.27 = 3,24g
Câu 9: Cho một lá nhôm vào ống nghiệm chứa dung dịch Hg(NO3)2, thấy có một lớp thủy ngân bám trên bề mặt nhôm. Hiện tượng tiếp theo quan sát được là
A. khí hiđro thoát ra mạnh.
B. khí hiđro thoát ra sau đó dừng lại ngay.
C. lá nhôm bốc cháy.
D. lá nhôm tan ngay trong thủy ngân và không có phản ứng.
Đáp án: A
Giải thích:
2Al + 3Hg(NO3)2 → 2Al(NO3)3 + 3Hg
Al sẽ tạo với Hg hỗn hống. Hỗn hống Al tác dụng với nước tạo ra khí H2
2Al + 6H2O → 2Al(OH)3 + 3H2
Câu 10: Hiện tượng nào xảy ra khi cho từ từ đến dư dung dịch NaOH vào dung dịch AlCl3?
A. Ban đầu không thấy hiện tượng, sau đó kết tủa xuất hiện
B. Xuất hiện kết tủa keo trắng ngay lập tức, sau đó kết tủa tan dần
C. Ban đầu không thấy hiện tượng, sau đó kết tủa xuất hiện, rồi tan dần
D. Xuất hiện kết tủa keo trắng ngay lập tức và không tan
Đáp án: B
Giải thích:
Ban đầu có kết tủa keo trắng ngay lập tức
3NaOH + AlCl3 → Al(OH)3 + 3NaCl
Khi NaOH dư, kết tủa tan dần
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Câu 11: Cho 3,82 gam hợp kim Ba, Al vào nước dư chỉ thu được dung dịch chứa duy nhất một muối. Khối lượng Ba là
A. 3,425 gam.
B. 1,644 gam.
C. 1,370 gam.
D. 2,740 gam.
Đáp án: D
Giải thích:
Công thức muối Ba(AlO2)2
nAl = 2nBa (1)
Lại có: mAl + mBa = 3,82
→ 27.nAl + 137.nBa = 3,82 (2)
nAl = 0,04 mol; nBa = 0,02 mol
→ mBa = 0,02.137 = 2,740 gam
Câu 12: Kim loại Al không phản ứng với dung dịch
A. HNO3 đặc, nguội.
B. Cu(NO3)2.
C. HCl.
D. KOH.
Đáp án: A
Giải thích:
Al không phản ứng với HNO3 đặc, nguội, H2SO4 đặc nguội
Câu 13: Phản ứng hóa học xảy ra trong trường hợp nào dưới đây không thuộc loại phản ứng nhiệt nhôm?
A. Al tác dụng với Fe2O3 nung nóng.
B. Al tác dụng với CuO nung nóng.
C. Al tác dụng với Fe3O4 nung nóng.
D. Al tác dụng với axit H2SO4 đặc nóng.
Đáp án: D
Giải thích:
Phản ứng nhiệt nhôm là phản ứng cho nhôm tác dụng với oxit kim loại ở nhiệt độ cao.
Câu 14: Lấy hỗn hợp gồm Al, Al2O3 và Fe2O3 ngâm trong dung dịch NaOH dư. Phản ứng xong, chất bị hoà tan là:
A. Al, Al2O3.
B. Fe2O3, Fe.
C. Al, Fe2O3.
D. Al, Al2O3, Fe2O3.
Đáp án: A
Giải thích:
2Al + 2NaOH + 2H2O 2NaAlO2 + 3H2
Al2O3 + 2NaOH 2NaAlO2 + H2O.
Câu 15: Cho phương trình phản ứng:
aAl + bHNO3 → cAl(NO3)3 + dNO + eH2O.
Tỉ lệ a : b là
A. 1 : 3.
B. 2 : 3.
C. 2 : 5.
D. 1 : 4.
Đáp án: D
Giải thích:
Al + 4HNO3 Al(NO3)3 + NO + 2H2O
→ a : b = 1 : 4
Câu 16: Cho 3,24 gam Al tác dụng hoàn toàn với dung dịch NaOH dư. Sau khi phản ứng kết thúc, thể tích khí H2 (ở đktc) thoát ra là:
A. 2,688 lít.
B. 4,032 lít.
C. 8,736 lít.
D. 1,792 lít.
Đáp án: B
Giải thích:
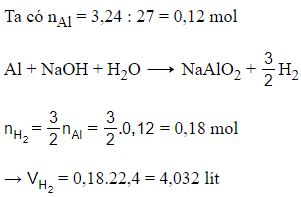
Câu 17: Nhôm hiđroxit thu được từ cách làm nào sau đây?
A. Cho dư dung dịch HCl vào dung dịch natri aluminat.
B. Thổi dư CO2 vào dung dịch natri aluminat.
C. Cho dư dung dịch NaOH vào dung dịch AlCl3.
D. Cho Al2O3 tác dụng với nướC.
Đáp án: B
Giải thích:
Nhôm hiđroxit thu được khi thổi dư CO2 vào dung dịch natri aluminat
Phương trình phản ứng:
![]()
Câu 18: Nhôm bền trong môi trường nước và không khí là do
A. nhôm là kim loại kém hoạt động.
B. có màng oxit Al2O3 bền vững bảo vệ.
C. có màng hiđroxit Al(OH)3 bền vững bảo vệ.
D. nhôm có tính thụ động với không khí và nước.
Đáp án: B
Giải thích:
Nhôm là kim loại hoạt động mạnh. Ở điều kiện thường, nhôm phản ứng với oxi tạo thành lớp Al2O3 mỏng bền vững. Lớp oxit này bảo vệ đồ vật bằng nhôm, không cho nhôm tác dụng với oxi trong không khí và nước, kể cả khi đun nóng.
Câu 19: Phát biểu nào sau đây đúng khi nói về nhôm oxit?
A. Al2O3 được sinh ra khi nhiệt phân muối Al(NO3)3.
B. Al2O3 bị khử bởi CO ở nhiệt độ cao.
C. Al2O3 tan được trong dung dịch NH3.
D. Al2O3 là oxit không tạo muối.
Đáp án: A
Giải thích:
A. Đúng, Al2O3 được sinh ra khi nhiệt phân muối Al(NO3)3
4Al(NO3)3 2Al2O3 + 12NO2 + 3O2.
B. Sai, CO chỉ khử được oxit của kim loại đứng sau nhôm trong dãy hoạt động hóa học.
C. Sai, Al2O3 không tan được trong dung dịch NH3
D. Sai, Al2O3 phản ứng với axit tạo muối.
VD: Al2O3 + 6HCl → 2AlCl3 + 3H2O
Câu 20: Phát biểu nào dưới đây là đúng?
A. Nhôm là một kim loại lưỡng tính.
B. Al(OH)3 là một bazơ lưỡng tính.
C. Al2O3 là oxit trung tính.
D. Al(OH)3 là một hiđroxit lưỡng tính.
Đáp án: D
Giải thích:
Trong hóa vô cơ, hợp chất lưỡng tính có thể là oxit, hiđroxit, muối.
A. Sai, không có khái niệm kim loại lưỡng tính.
B. Sai, Al(OH)3 là một hiđroxit lưỡng tính
C. Sai, Al2O3 là oxit lưỡng tính.
D. Đúng
Câu 21: Trong công nghiệp, Al được sản xuất từ quặng boxit
A. bằng phương pháp điện phân nóng chảy.
B. bằng phương pháp nhiệt luyện .
C. bằng phương pháp thủy luyện.
D. Trong lò cao.
Đáp án: A
Giải thích:
Trong công nghiệp, Al được sản xuất từ quặng boxit bằng phương pháp điện phân nóng chảy.
2Al2O3 4Al + 3O2
Câu 22: Cho hỗn hợp X gồm Al và Al2O3 có tỉ lệ khối lượng tương ứng là 0,18 : 1,02. Cho X tan trong dung dịch NaOH vừa đủ thu được dung dịch Y và 0,672 lít khí H2 (đktc). Cho Y tác dụng với 200 ml dung dịch HCl được kết tủa Z. Nung Z ở nhiệt độ cao đến khối lượng không đổi được 3,57g chất rắn. Nồng độ mol của dung dịch HCl là
A. 0,35M hoặc 0,45M.
B. 0,07M hoặc 0,11M.
C. 0,07M hoặc 0,09M.
D. 0,35M hoặc 0,55M.
Đáp án: D
Giải thích:
= 0,03
Bảo toàn electron: 3.nAl = 2.
→ nAl = 0,02
→ mAl = 0,54g
Al và Al2O3 có tỉ lệ khối lượng tương ứng là 0,18 : 1,02
→
→ bđ = 0,03 mol
Bảo toàn nguyên tố Al
→ = nAl + 2. bđ
= 0,08 mol
thu được = 3,57 : 102 = 0,035 mol
= 0,07 mol
Trường hợp 1:
NaAlO2 + HCl + H2O Al(OH)3 + NaCl
nHCl = = 0,07 mol
→ CM HCl = = 0,35M
Trường hợp 2:
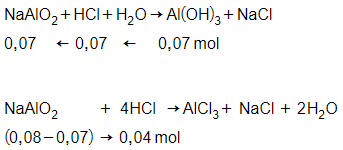
→ nHCl = 0,11 mol
→ CM HCl = = 0,55M
Câu 23: Sục khí CO2 đến dư vào dung dịch NaAlO2. Hiện tượng xảy ra là
A. có kết tủa nâu đỏ.
B. có kết tủa keo trắng, sau đó kết tủa lại tan.
C. có kết tủa keo trắng không tan.
D. dung dịch vẫn trong suốt.
Đáp án: C
Giải thích:
Sục khí CO2 đến dư vào dung dịch NaAlO2 xuất hiện kết tủa keo trắng không tan.
Phương trình phản ứng
NaAlO2 + CO2 + 2H2O Al(OH)3↓ + NaHCO3.
Câu 24: Để phân biệt dung dịch AlCl3 và dung dịch KCl ta dùng dung dịch
A. NaOH.
B. HCl.
C. NaNO3
D. H2SO4.
Đáp án: A
Giải thích:
Trích mẫu thử của hai dung dịch ra hai ống nghiệm có đánh số.
Nhỏ NaOH dư vào từng ống nghiệm
- Xuất hiện kết tủa trắng sau đó kết tủa tan: AlCl3
AlCl3 + 3NaOH Al(OH)3 + 3NaCl
Al(OH)3 + NaOH NaAlO2 + 2H2O
- Không có hiện tượng gì: KCl
Câu 25: Cho 3,24 gam Al2(SO4)3 phản ứng với 25 ml dung dịch NaOH thu được 0,78 gam kết tủa trắng. Nồng độ mol của dung dịch NaOH đã dùng là
A. 1,2M và 2,4M.
B. 1,2M.
C. 2,8M.
D. 1,2M và 2,8M.
Đáp án: D
Giải thích:
= 0,01 mol
→ = 2. = 0,02 mol
mà = = 0,01 mol < 0,02 nên có 2 trường hợp
Trường hợp 1:
= 3. = 0,03 mol
→ CM NaOH = = 1,2M.
Trường hợp 2:
= 4. –
= 4.0,02 – 0,01 = 0,07 mol
→ CM NaOH = = 2,8M
Câu 26: Oxi hóa hoàn toàn 8,1 gam nhôm cần vừa đủ V lít khí clo (đktc). Giá trị của V là
A. 7,84.
B. 10,08.
C. 6,72.
D. 11,2.
Đáp án: B
Giải thích:
2Al + 3Cl2 2AlCl3
Câu 27: Để khử hoàn toàn m gam hỗn hợp CuO và PbO cần 8,1g kim loại nhôm, sau phản ứng thu được 50,2g hỗn hợp 2 kim loại. Giá trị của m là
A. 53,4g
B. 57,4g
C. 54,4g
D. 56,4g
Đáp án: B
Giải thích:
nAl = 8,1 : 27 = 0,3 mol
Áp dụng định luật bảo toàn khối lượng:
→ m + 8,1 = 0,15.102 + 50,2
→ m = 57,4 gam
Câu 28: Kim loại nhẹ, màu trắng bạc, được ứng dụng rộng rãi trong đời sống là
A. Fe.
B. Ag.
C. Cu.
D. Al.
Đáp án: D
Giải thích:
+ Nhôm (Al) là kim loại màu trắng bạc, mềm, dẻo, nhẹ, dẫn điện dẫn nhiệt tốt.
+ Al được ứng dụng rộng rãi trong đời sống: sản xuất hợp kim siêu nhẹ làm máy bay, tên lửa; trang trí; chế tạo dây dẫn điện; hàn đường ray.
Câu 29: Cho các phát biểu sau đây:
(1) Theo chiều tăng dần của điện tích hạt nhân, khối lượng riêng của các kim loại kiềm giảm dần.
(2) Hợp kim Na-Al siêu nhẹ, dùng trong kĩ thuật chân không.
(3) Trong quá trình điện phân Al2O3 nóng chảy, cực dương được bố trí là một tấm than chì nguyên chất được bố trí ở đáy thùng.
(4) Dựa vào thành phần hóa học và tính chất cơ học, người ta chia thép thành 2 loại là thép mềm và thép cứng. Thép mềm là thép có chứa không quá 1% C.
(5) Trong quả gấc có chứa nhiều vitamin A.
Số phát biểu sai là:
A. 2.
B. 3.
C. 4.
D. 5.
Đáp án: D
Giải thích:
(1) Sai. Theo chiều tăng dần của điện tích hạt nhân, khối lượng riêng của các kim loại kiềm tăng dần.
(2) Sai. Hợp kim Al-Li là hợp kim của nhôm với Li. Li là một kim loại nguyên tố có tỷ trọng rất thấp, thì nếu bổ sung vào nhôm sẽ cho hợp kim có tỷ trọng thấp hơn nhôm nguyên tố. Nếu bổ sung vào hợp kim một lượng 1% Li thì sẽ làm cho hợp kim Al-Li nhẹ đi 3% và tăng độ cứng lên 5%. Hợp kim Al-Li rất quan trọng và được sử dụng rộng rãi trong công nghiệp vũ trụ, do lợi thế vế trọng lượng riêng. Hiện tại hợp kim này đang được sử dụng cho ngành hàng không và các dự án máy bay lên thẳng.
(3) Sai. Trong quá trinh điện phân Al2O3 nóng chảy, cực dương được bố trí là nhiều tấm than chì có thể chuyển động theo phương thẳng đứng.
(4) Sai. Thép mềm là thép có chứa không quá 0,1% C.
(5) Sai. Trong quả gấc có chứa nhiều tiến tố của vitamin A.
→ Cả 5 phát biểu đều sai
Câu 30: Vai trò nào sau đây không phải của criolit (Na3AlF6) trong sản xuất nhôm?
A. Làm giảm nhiệt độ nóng chảy của Al2O3 (tiết kiệm năng lượng).
B. Có khối lượng riêng nhỏ hơn Al, nổi lên trên, ngăn cách để bảo vệ nhôm nóng chảy không bị oxi hóa trong không khí.
C. Tăng hàm lượng nhôm trong nguyên liệu.
D. Tạo được chất lỏng có tính dẫn điện tốt hơn Al2O3.
Đáp án: C
Giải thích:
Vai trò của criolit (3 vai trò)
+ Tạo hỗn hợp điện phân có tỉ khối nhẹ hơn Al.
+ Làm cho nhiệt độ nóng chảy của Al2O3 giảm, tiết kiệm điện năng.
+ Tạo cho hỗn hợp điện phân dẫn điện tốt hơn.
Các câu hỏi Trắc nghiệm Hóa học lớp 12 có đáp án, chọn lọc khác:
Trắc nghiệm Luyện tập tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng có đáp án
Trắc nghiệm Luyện tập tính chất của nhôm và hợp chất của nhôm có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
