TOP 40 câu Trắc nghiệm Kim loại kiềm và hợp chất của kim loại kiềm (có đáp án 2024) - Hóa học 12
Bộ 40 bài tập trắc nghiệm Hóa học lớp 12 Bài 25: Kim loại kiềm và hợp chất của kim loại kiềm có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 12.
Trắc nghiệm Hóa học 12 Bài 25: Kim loại kiềm và hợp chất của kim loại kiềm
Câu 1: Kim loại nào sau đây là kim loại kiềm?
A. Al
B. Na
C. Ca
D. Fe
Đáp án: B
Giải thích:
Kim loại kiềm là các kim loại thuộc nhóm IA trong bảng tuần hoàn nguyên tố hóa học
Gồm: Li, Na, K, Rb, Cs, Fr
Câu 2: Khi cho kim loại Na vào dung dịch CuSO4 thì sẽ xảy ra hiện tượng nào sau đây?
A. Ban đầu có xuất hiện kết tủa xanh, sau đó kết tủa tan ra, dung dịch trong suốt.
B. Ban đầu có sủi bọt khí, sau đó xuất hiện kết tủa xanh.
C. Ban đầu có sủi bọt khí, sau đó có tạo kết tủa xanh, rồi kết tủa tan ra, dung dịch trong suốt.
D. Chỉ có sủi bọt khí.
Đáp án: B
Giải thích:
Ban đầu xuất hiện bọt khí do Na phản ứng với nước
2Na + 2H2O → 2NaOH + H2
Sau đó xuất hiện kết tủa xanh Cu(OH)2
2NaOH + CuSO4 → Cu(OH)2 + Na2SO4
Câu 3: Trong bảng tuần hoàn các nguyên tố hóa học, kim loại kiềm thuộc nhóm nào?
A. IA
B. IIIA
C. IVA
D. IIA
Đáp án: A
Giải thích:
Kim loại kiềm là các kim loại thuộc nhóm IA trong bảng tuần hoàn nguyên tố hóa học
Gồm: Li, Na, K, Rb, Cs, Fr
Câu 4: Dãy các chất đều tác dụng được với dung dịch Ba(HCO3)2 là:
A. HNO3, NaCl, và Na2SO4
B. HNO3, Ca(OH)2 và KNO3.
C. NaCl, Na2SO4 và Ca(OH)2
D. HNO3, Ca(OH)2 và Na2SO4
Đáp án: D
Giải thích:
Phương trình phản ứng:
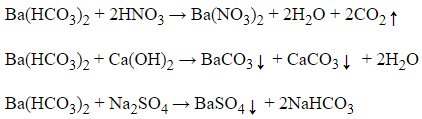
Câu 5: Phương pháp điều chế kim loại kiềm là:
A. Khử oxit kim loại kiềm bằng chất khử CO.
B. Điện phân nóng chảy muối halogenua hoặc hiđroxit của chúng.
C. Điện phân dung dịch muối halogenua.
D. Cho Al tác dụng với dung dịch muối của kim loại kiềm.
Đáp án: B
Giải thích:
Kim loại kiềm được điều chế bằng cách điện phân nóng chảy muối halogenua hoặc hiđroxit của chúng.
2RX 2R + X2
Trong đó X là nguyên tử halogen
4ROH 4R + O2 + 2H2O
Câu 6: Phát biểu nào sau đây là đúng?
A. Trong hợp chất, tất cả các kim loại kiềm đều có số oxi hóa +1.
B. Tất cả các kim loại nhóm IIA đều có mạng tinh thể lập phương tâm khối.
C. Tất cả các hiđroxit của kim loại nhóm IIA đều dễ tan trong nước.
D. Trong nhóm IA, tính khử của các kim loại giảm dần từ Li dến Cs.
Đáp án: A
Giải thích:
A. Đúng.
B. Sai. Trong nhóm IIA: Be và Mg có mạng tinh thể lục phương; Ca và Sr có mạng tinh thể lập phương tâm diện; Ba có mạng lập phương tâm khối.
C. Sai. Be(OH)2, Mg(OH)2 kết tủa.
D. Sai. Trong nhóm IA, tính khử tăng dần từ Li đến Cs
Câu 7: Cho các phát biểu sau về ứng dụng của kim loại kiềm:
(1) Kim loại kiềm dùng để chế tạo hợp kim có nhiệt độ nóng chảy thấp,
(2) Kim loại kiềm dùng để điều chế một số kim loại hiếm bằng phương pháp nhiệt kim loại.
(3) Kim loại kiềm dùng đề làm xúc tác trong nhiều phản ứng hữu cơ.
(4) Kim loai kiềm dùng để làm điện cực trong pin điện hóa
(5) Kim loại kiềm dùng để gia công các chi tiết chịu mài mòn trong máy bay, tên lửa, ô tô
Trong các phát biểu trên, số phát biếu đúng là
A. 1.
B. 2.
C. 3.
D. 4
Đáp án: C
Giải thích:
Phát biểu (1), (2), (3) đúng.
Câu 8: Đặt một mẩu nhỏ natri lên một tờ giấy thấm gấp thành dạng thuyền. Đặt chiếc thuyền giấy này lên một chậu nước có nhỏ sẵn vài giọt phenolphtalein.
Dự đoán hiện tượng có thể quan sát được ở thí nghiệm như sau:
(a) Chiếc thuyền chạy vòng quanh chậu nước.
(b) Thuyền bốc cháy.
(c) Nước chuyển màu hồng.
(d) Mẩu natri nóng chảy.
Trong các dự đoán trên, số dự đoán đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án: D
Giải thích:
Cả 4 dự đoán đều đúng.
- Chiếc thuyền làm bằng giấy thấm nước làm cho mẩu Na phản ứng với nước.
Phương trình phản ứng:
2Na + 2H2O → 2NaOH + H2
- Khí H2 sinh ra đẩy mẩu Na cũng như đẩy chiếc thuyền chạy vòng quanh chậu nước.
- Phản ứng trên tỏa nhiều nhiệt khiến cho chiếc thuyền bốc cháy, mẩu Na nóng chảy và vo tròn lại (do sức căng bề mặt).
- Vì NaOH là dung dịch bazơ → Nhỏ phenolphtalein làm dung dịch chuyển màu hồng.
Câu 9: Có thể dùng NaOH (ở thể rắn) để làm khô các chất khí nào?
A. NH3, SO2, CO, Cl2
B. N2, NO2, CO2, CH4, H2
C. NH3, O2, N2, CH4, H2
D. N2, Cl2, O2, CO2, H2
Đáp án: C
Giải thích:
NaOH rắn là chất hút nước. NaOH có thể làm khô các khí không có phản ứng với nó ở điều kiện thường.
Câu 10: Cho 3,36 gam hỗn hợp gồm K và một kim loại kiềm A vào nước thấy thoát ra 1,792 lít H2. Thành phần phần trăm về khối lượng của A là
A. 18,75 %.
B. 10,09%.
C. 13,13%.
D. 55,33%.
Đáp án: A
Giải thích:
= 0,08 mol
Gọi công thức chung của hai kim loại kiềm là M
2M + 2H2O → 2MOH + H2
nM = 2. = 2.0,08 = 0,16 mol
→ MM = = 21
→ Li (MLi = 7) < 21 < K (MK = 39)
→ Kim loại A là Li
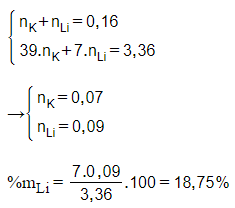
Câu 11: Thực hiện các thí nghiệm sau:
(I) Cho dung dịch NaCl vào dung dịch KOH.
(II) Cho dung dịch Na2CO3 vào dung dịch Ca(OH)2.
(III) Điện phân dung dịch NaCl với điện cực trơ có màng ngăn.
(IV) Cho Cu(OH)2 vào dung dịch NaNO3.
(V) Sục khí NH3 vào dung dịch Na2CO3.
(VI) Cho dung dịch Na2SO4 vào dung dịch Ba(OH)2.
Các thí nghiệm điều chế được NaOH là:
A. II, III và VI
B. I, II và III
C. I, IV và V
D. II, V và VI
Đáp án: A
Giải thích:
Thí nghiệm (II), (III), (VI) điều chế được NaOH
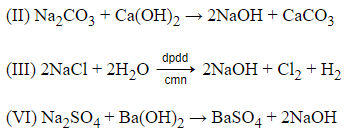
Câu 12: Nhỏ từ từ từng giọt đến hết 30 ml dung dịch HCl 1M vào 100 ml dung dịch chứa Na2CO3 0,2M và NaHCO3 0,2M, sau phản ứng thu được số mol CO2 là
A. 0,020.
B. 0,030.
C. 0,015.
D. 0,010.
Đáp án: D
Giải thích:
Phản ứng xảy ra theo thứ tự sau
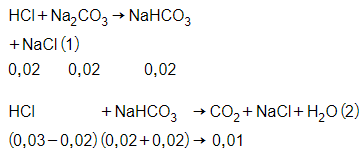
Phản ứng (2) NaHCO3 dư nên số mol CO2 được tính theo HCl
→ = 0,010 mol
Câu 13: Natri hiđroxit (còn gọi là xút ăn da) có công thức hóa học là
A. Na2SO4.
B. NaOH.
C. NaHCO3.
D. Na2CO3.
Đáp án: B
Giải thích:
Natri hiđroxit (còn gọi là xút ăn da) có công thức hóa học là NaOH.
Câu 14: Kim loại nào sau đây được dùng chế tạo tế bào quang điện?
A. Na.
B. Cs.
C. Li.
D. K.
Đáp án: B
Giải thích:
Cs được dùng để chế tạo tế bào quang điện
Câu 15: Cho 24,4 g hỗn hợp Na2CO3, K2CO3 tác dụng vừa đủ với dung dịch BaCl2. Sau phản ứng thu được 39,4 g kết tủa. Lọc tách kết tủa, cô cạn dung dịch thu được m (g) muối clorua. Vậy m có giá trị là
A. 63,8 g.
B. 22,6 g.
C. 26,6g.
D. 15,0 g.
Đáp án: C
Giải thích:
Đặt hai muối Na2CO3 và K2CO3 tương ứng với một muối là R2CO3 (MNa < MR < MK)
R2CO3 + BaCl2 → BaCO3↓ + 2RCl
→
= 0,2 mol
Áp dụng định luật bảo toàn khối lượng có:
→ mRCl = 24,4 + 0,2.208 – 39,4
= 26,6 gam.
Câu 16: Cho từ từ dung dịch chứa a mol HCl vào dung dịch X chứa b mol Na2CO3 đồng thời khuấy đều, thu dược V lít khí (đktc) và dung dịch Y. Khi cho dư nước vôi trong vào dung dịch Y thấy xuất hiện kết tủa. Biểu thức liên hệ giữa V với a và b là?
A. V = 22,4(a – b)
B. V = 11,2(a – b)
C. V = 11,2(a + b)
D. V = 22,4( a + b)
Đáp án: A
Giải thích:
Phản ứng xảy ra theo thứ tự sau
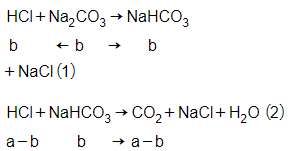
Dung dịch Y phản ứng với nước vôi trong dư tạo kết tủa nên NaHCO3 dư ở phản ứng (2), HCl phản ứng hết.
![]()
→ = nHCl (2)
→ = a – b
→ V = 22,4(a – b)
Câu 17: Để bảo quản kim loại kiềm người ta làm bằng cách nào?
A. Để trong lọ kín
B. Ngâm trong dầu hỏa
C. Ngâm trong nước
D. Để trong lọ thủy tinh
Đáp án: B
Giải thích:
Kim loại kiềm được bảo quản bằng cách ngâm trong dầu hỏa
Câu 18: Cho hỗn hợp các kim loại kiềm Na, K hòa tan hết vào nước được dung dịch A và 0,672 lít khí H2 (đktc). Thể tích dung dịch HCl 0,1M cần để trung hòa hết một phần ba dung dịch A là
A. 100 ml.
B. 200 ml.
C. 300 ml.
D. 600 ml.
Đáp án: A
Giải thích:
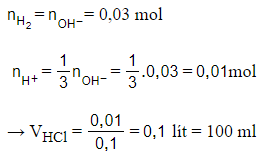
Câu 19: Điện phân muối clorua kim loại kiềm nóng chảy thu được 1,792 lít khí đktc ở anot và 6,24 gam kim loại ở catot. Công thức hoá học của muối đem điện phân là
A. RbCl.
B. NaCl.
C. KCl.
D. LiCl.
Đáp án: C
Giải thích:
2RCl 2R (0,16) + Cl2 (0,08 mol)
MR = 6,24 : 0,16 = 39.
Vậy R là K, muối là KCl.
Câu 20: Cấu hình electron của nguyên tử Na (Z =11) là
A. 1s22s2 2p6 3s2.
B. 1s22s2 2p6.
C. 1s22s2 2p6 3s1.
D. 1s22s2 2p6 3s23p1.
Đáp án: C
Giải thích:
Cấu hình electron của nguyên tử Na (Z =11) là: 1s22s2 2p6 3s1
Câu 21: Muối được dùng để chế thuốc chữa đau dạ dày do thừa axit trong dạ dày là
A. Na2CO3.
B. NaHCO3.
C. NH4HCO3.
D. NaF.
Đáp án: B
Giải thích:
Muối NaHCO3 có khả năng trung hòa axit trong dạ dày
NaHCO3 + HCl → NaCl + H2O + CO2
Câu 22: Phát biểu nào sau đây là sai khi nói về 2 muối NaHCO3 và Na2CO3?
A. Cả 2 muối đều dễ bị nhiệt phân.
B. Cả 2 muối đều tác dụng với axit mạnh giải phóng khí CO2.
C. Cả 2 muối đều bị thủy phân tạo mỗi trường kiềm yếu.
D. Cả 2 muối đểu có thể tác dụng với dung dịch Ca(OH)2 tạo kết tủa.
Đáp án: A
Giải thích:
Muối Na2CO3 không bị nhiệt phân
Câu 23: Cho các phát biểu sau:
(1) Có thể tìm được kim loại kiềm ở dạng nguyên chất ở những mỏ nằm sâu trong lòng đất.
(2) Trong cùng một chu kì của bảng tuần hoàn, kim loại kiềm có tính khử mạnh nhất.
(3) Trong bảng tuần hoàn, đi từ trên xuống dưới trong một nhóm, nhiệt độ nóng chảy của các kim loại tăng dần.
(4) Trong bảng tuần hoàn, đi từ trên xuống dưới trong một nhóm, nhiệt độ sôi của các kim loại nhìn chung giảm dần.
(5) Kim loại kiềm đều là những kim loại nhẹ hơn nước.
Trong các phát biểu trên, số phát biểu đúng là
A. 2
B. 3
C. 4
D. 5
Đáp án: A
Giải thích:
Phát biểu (2) và (4) đúng
Câu 24: Cấu hình electron lớp ngoài cũng của nguyên tử kim loại kiềm là
A. ns2
B. ns2np1
C. ns1
D. ns2np2
Đáp án: C
Giải thích:
Kim loại kiềm thuộc nhóm IA.
Các kim loại kiềm đề có 1 electron lớp ngoài cùng và có cấu hình electron chung lớp ngoài cùng là ns1 (n là số thứ tự chu kì)
Câu 25: Trung hoà V ml dung dịch NaOH 1M bằng 100 ml dung dịch HCl 1M. Giá trị của V là
A. 400.
B. 200.
C. 100.
D. 300.
Đáp án: C
Giải thích:
NaOH + HCl → NaCl + H2O
nNaOH = nHCl = 0,1 mol
→ VNaOH = 100 ml
Câu 26: Nung nóng 100 gam hỗn hợp gồm Na2CO3 và NaHCO3 cho đến khối lượng không thay đổi còn lại 69 gam chất rắn. Thành phần % khối lượng mỗi chất trong hỗn hợp đầu là
A. 63% và 37%.
B. 16% và 84%.
C. 42% và 58%.
D. 21% và 79%.
Đáp án: B
Giải thích:
Đặt số mol Na2CO3, NaHCO3 lần lượt là x, y mol
→ 106x + 84y = 100 gam (1)
2NaHCO3 → Na2CO3 + CO2 + H2O
y mol mol
→ = (x + ).106
= 69 gam (2)
Giải hệ (1) và (2) ta có
x = mol; y = 1mol
→ % = 16%;
% = 84%
Câu 27: Trong các cặp chất sau đây, cặp chất nào cùng tồn tại trong dung dịch?
A. KNO3 và BaCl2.
B. NaHCO3 và KOH.
C. Na2CO3 và NaHSO4.
D. Na2CO3 và CaCl2.
Đáp án: A
Giải thích:
Cặp chất có các ion không phản ứng với nhau sẽ cùng tồn tại trong dung dịch
B. + OH- → CO2 + H2O
C. + 2H+ → CO2 + H2O
D. + Ca2+ → CaCO3
Câu 28: Nhiệt phân hoàn toàn NaNO3 thì chất rắn thu được là
A. NaNO2.
B. NaOH.
C. Na2O.
D. Na.
Đáp án: A
Giải thích:
2NaNO3 2NaNO2 + O2
Câu 29: Để tác dụng hết với dung dịch chứa 0,01 mol KCl và 0,02 mol NaCl thì thể tích dung dịch AgNO3 1M cần dùng là
A. 40 ml.
B. 20 ml.
C. 10 ml.
D. 30 ml.
Đáp án: D
Giải thích:
Phương trình ion thu gọn của phản ứng
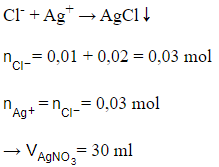
Câu 30: Để thu được dung dịch NaOH 16% thì cần thêm bao nhiêu gam H2O vào 200 gam dung dịch NaOH 20%?
A. 50 gam.
B. 100 gam.
C. 200 gam.
D. 250 gam.
Đáp án: A
Giải thích:
Gọi khối lượng nước thêm vào a gam.
Khối lượng NaOH trong 200 gam dung dịch là:
200.20% = 40 gam.
Nồng độ NaOH sau khi thêm nước:
→ a = 50 gam.
Các câu hỏi Trắc nghiệm Hóa học lớp 12 có đáp án, chọn lọc khác:
Trắc nghiệm Kim loại kiềm thổ và hợp chất quan trọng của kim loại kiềm thổ có đáp án
Trắc nghiệm Nhôm và hợp chất của nhôm có đáp án
Trắc nghiệm Luyện tập tính chất của kim loại kiềm, kiềm thổ và hợp chất của chúng có đáp án
Trắc nghiệm Luyện tập tính chất của nhôm và hợp chất của nhôm có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
