TOP 40 câu Trắc nghiệm Luyện tập: Tính chất hóa học của crom, đồng và hợp chất của chúng (có đáp án 2024) - Hóa học 12
Bộ 40 bài tập trắc nghiệm Hóa học lớp 12 Bài 38: Luyện tập: Tính chất hóa học của crom, đồng và hợp chất của chúng có đáp án đầy đủ các mức độ giúp các em ôn trắc nghiệm Hóa học 12.
Trắc nghiệm Hóa học 12 Bài 38: Luyện tập: Tính chất hóa học của crom, đồng và hợp chất của chúng
Câu 1: Nhúng một bản đồng mỏng vào cốc đựng dung dịch H2SO4 loãng, ta không thấy có hiện tượng gì xảy ra. Để cốc này ngoài không khí một thời gian, dung dịch trong cốc dần dần chuyển sang màu xanh. Có thể giải thích hiện tượng này như thế nào?
A. Xảy ra hiện tượng ăn mòn hóa học
B. Xảy ra hiện tượng ăn mòn điện hóa
C. Đồng tác dụng với H2SO4 loãng rất chậm, do đó phải sau một khoảng thời gian dài, ta mới quan sát thấy hiện tượng.
D. Đồng tác dụng với H2SO4 loãng khi có mặt oxi không khí.
Đáp án: D
Giải thích:
Đồng không tác dụng với dung dịch HCl, H2SO4 loãng. Tuy vậy, với sự có mặt của oxi trong không khí, Cu bị oxi hóa thành muối Cu(II).
2Cu + 2H2SO4 + O2 → 2CuSO4 + 2H2O.
Câu 2: Phát biểu nào sau đây sai?
A. Dung dịch K2Cr2O7 có màu da cam.
B. CrO3 là oxit axit
C. Trong hợp chất, crom có số oxi hóa đặc trưng là +2, +3, +6.
D. Cr2O3 tan được trong dung dịch NaOH loãng
Đáp án: D
Giải thích:
Cr2O3 là oxit lưỡng tính nhưng tan trong axit và kiềm đặc, không tan trong NaOH loãng.
Câu 3: Hợp kim Cu-Ni (25% Ni) được gọi là
A. đồng thau.
B. đồng thanh.
C. đồng bạch.
D. đuy ra.
Đáp án: C
Giải thích:
Đồng bạch là hợp kim Cu-Ni (25% Ni).
Câu 4: Ở nhiệt độ thường, crom tác dụng với phi kim nào sau đây?
A. F2.
B. S.
C. Cl2.
D. O2.
Đáp án: A
Giải thích:
Vì F2 có tính oxi hóa rất mạnh nên nó phản ứng với crom ngay ở nhiệt độ thường.
Các phi kim khác phản ứng với crom khi đun nóng.
Câu 5: Cho Cu (Z = 29), số electron lớp ngoài cùng của nguyên tử nguyên tố đồng là
A. 1.
B. 2.
C. 8.
D. 10.
Đáp án: A
Giải thích:
Cấu hình electron của Cu là
1s22s22p63s23p63d104s1
→ Số electron lớp ngoài cùng của đồng là 1.
Câu 6: Nhận xét nào sau đây sai?
A. Cr2O3 là chất rắn màu lục thẫm
B. Cr(OH)3 là hiđroxit lưỡng tính.
C. Cr2O3 tan trong dung dịch kiềm loãng.
D. Ion Cr3+ vừa có tính oxi hoá, vừa có tính khử.
Đáp án: C
Giải thích:
C sai vì Cr2O3 chỉ tan trong dung dịch kiềm đặc.
Câu 7: Thành phần chính của quặng cancopirit (pirit đồng) là
A. CuS.
B. CuS2.
C. Cu2S.
D. CuFeS2.
Đáp án: D
Giải thích:
Cancopirit: CuFeS2.
Bài 8: Cho các mệnh đề sau
(1) Cu2O vừa có tính oxi hoá vừa có tính khử.
(2) CuO vừa có tính oxi hóa vừa có tính khử.
(3) Cu(OH)2 tan dễ dàng trong dung dịch NH3.
(4) CuSO4 khan có thể dùng để phát hiện nước lẫn trong dầu hoả hoặc xăng.
(5) CuSO4 có thể dùng làm khô khí NH3.
Số mô tả sai là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án: B
Giải thích:
(1) Đúng, do trong Cu2O thì Cu có số oxi hóa +1 trung gian giữa 0 và +2
(2) Sai, CuO chỉ có tính oxi hóa.
(3) Đúng
(4) Đúng,
(5) Sai, CuSO4 cho vào khí NH3 ẩm sẽ có phản ứng xảy ra.
![]()
Câu 9: Hãy cho biết hợp chất nào sau đây có thể điều chế trực tiếp từ crom?
A. CrCl3
B. K2Cr2O7
C. CrO3
D. KCrO2
Đáp án: A
Giải thích:
Từ kim loại crom có thể điều chế trực tiếp CrCl3 bằng một phản ứng:
2Cr + 3Cl2 2CrCl3
Câu 10: Giữa các ion và ion có sự chuyển hoá cho nhau theo cân bằng hoá học sau:
![]()
Nếu thêm dung dịch H2SO4 vào dung dịch K2CrO4 thì sẽ có hiện tượng
A. từ màu vàng chuyển màu da cam.
B. từ màu da cam chuyển màu vàng.
C. từ màu da cam chuyền thành không màu.
D. từ màu vàng chuyến thành không màu.
Đáp án: A
Giải thích:
Nếu thêm dung dịch H2SO4 vào cân bằng sẽ chuyển dịch theo chiều nghịch. Dung dịch sẽ chuyển từ màu vàng của ion sang màu da cam của ion .
Câu 11: Cho 15 gam hỗn hợp bột kim loại Zn và Cu vào dung dịch HCl (dư). Sau khi phản ứng xảy ra hoàn toàn, thu được 4,48 lít khí H2 (đktc) và m gam kim loại không tan. Giá trị của m là
A. 2,2
B. 8,5
C. 2,0
D. 6,4
Đáp án: C
Giải thích:
Zn phản ứng với HCl tạo H2, kim loại không tan là Cu.
= 0,2 mol
Bảo toàn electron: 2.nZn = 2.
→ nZn = 0,2 mol
Nên mZn = 13g
Suy ra mCu = 15 - 13= 2 gam
Câu 12: Hiện tượng nào dưới đây đã được mô tả không đúng?
A. Thổi khí NH3 qua CrO3 đun nóng thấy chất rắn chuyển từ màu đỏ thẫm sang màu lục thẫm.
B. Đun nóng S với K2Cr2O7 thấy chất rắn chuyển từ màu da cam sang màu lục thẫm.
C. Nung Cr(OH)2 trong không khí thấy chất rắn chuyển từ màu lục sáng sang màu lục thẫm.
D. Đốt CrO trong không khí thấy chất rắn chuyển từ màu đen sang màu lục thẫm.
Đáp án: C
Giải thích:
Màu sắc của các hợp chất crom:
CrO: đen
Cr2O3: lục thẫm
CrO3: đỏ thẫm
Cr(OH)2: vàng
A. Đúng.
2NH3 + 2CrO3 (đỏ thẫm) → Cr2O3 (lục thẫm) + N2 + 3H2O
B. Đúng
K2Cr2O7 (da cam) + S → Cr2O3 (lục thẫm) + K2SO4
C. Sai.
4Cr(OH)2 (vàng) + O2 → 2Cr2O3 (lục thẫm) + 4H2O
D. Đúng
2CrO (đen) + O2 → Cr2O3 (lục thẫm)
Câu 13: Muối amoni đicromat bị nhiệt phân theo phương trình:
(NH4)2Cr2O7 → Cr2O3 + N2 + 4H2O.
Khi phân hủy 48 gam muối này thấy còn 30 gam gồm chất rắn và tạp chất không bị biến đổi. Phần trăm tạp chất trong muối là
A. 8,5%.
B. 6,5%.
C. 7,5%.
D. 5,5%
Đáp án: D
Giải thích:
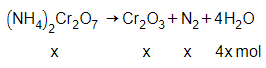
Bảo toàn khối lượng có:
48 = 30 + 28x + 18.4x
→ x = 0,18 mol
![]()
Câu 14: Cho 15,2 gam hỗn hợp X gồm Fe và Cu vào dung dịch HNO3 loãng dư. Sau khi phản ứng xảy ra hoàn toàn, thu được 4,48 lít khí NO (đktc). Phần trăm khối lượng của Cu trong X là
A. 63,16%
B. 42,11%
C. 36,84%
D. 26,32%
Đáp án: A
Giải thích:
Gọi nFe = a và nCu = b
→ 56x + 64y = 15,2
Bảo toàn electron:
3x + 2y = 3nNO = 0,6
→ x = 0,1 và y = 0,15
→ mCu = 9,6 gam
→ %mCu = 63,16%
Câu 15: Đốt cháy hoàn toàn bột crom trong oxi (dư) thu được 4,56 gam một oxit (duy nhất). Khối lượng crom bị đốt cháy là
A. 0,78 gam.
B. 3,12 gam.
C. 1,74 gam.
D. 1,19 gam.
Đáp án: B
Giải thích:
Oxit là Cr2O3: 0,03 mol
Bảo toàn Cr có
nCr = 2.0,03 = 0,06 mol
→ mCr = 0,06.52 = 3,12 gam.
Câu 16: Đem nung 13,0 gam Cr trong khí O2 thì thu được 15,0 gam chất rắn X. Hoà tan hoàn toàn X trong dung dịch H2SO4 đặc, nóng dư. Thể tích khí SO2 (đktc) thu được là
A. 4,48 lít.
B. 6,72 lít.
C. 8,40 lít.
D. 5,60 lít.
Đáp án: D
Giải thích:
Bảo toàn khối lượng
→ = moxit - mCr
= 15 – 13 = 2g
→ = 0,0625 mol
Bảo toàn electron có:
3.nCr = 4. + 2
→ = 0,25 mol
→ = 0,25.22,4 = 5,6 lít.
Câu 17: Phát biểu nào dưới đây không đúng?
A. Crom là nguyên tố thuộc ô thứ 24, chu kì IV, nhóm VIB, có cấu hình electron 1s22s22p63s23p63d54s1
B. Nguyên tử khối crom là 51,996; cấu trúc tinh thể lập phương tâm diện.
C. Khác với kim loại phân nhóm chính, crom có thể tham gia liên kết bằng electron của cả phân lớp 4s và 3d.
D. Trong hợp chất, crom có các mức oxi hoá đặc trưng là +2, +3 và +6.
Đáp án: B
Giải thích:
B. Sai vì crom có cấu trúc mạng tinh thể lập phương tâm khối.
Câu 18: Giải thích ứng dụng của crom nào dưới đây là không hợp lí?
A. Crom là kim loại cứng nhất, có thể dùng để cắt thuỷ tinh.
B. Crom là hợp kim cứng và chịu nhiệt hơn nên dùng để tạo thép cứng không gỉ, chịu nhiệt.
C. Crom là kim loại nhẹ, nên được sử dụng các hợp kim dùng trong ngành hàng không.
D. Điều kiện thường, crom tạo được lớp màng oxit mịn, bền chắc nên crom được dùng để mạ bảo vệ thép.
Đáp án: C
Giải thích:
Crom là kim loại nặng, có khối lượng riêng là 7,2g/cm3
Câu 19: Một dung dịch chứa 0,02 mol Cu2+, 0,03 mol K+, x mol Cl– và y mol SO42–. Tổng khối lượng các muối tan có trong dung dịch là 5,435 gam. Giá trị của x và y lần lượt là
A. 0,03 và 0,02.
B. 0,05 và 0,01.
C. 0,02 và 0,05.
D. 0,01 và 0,03.
Đáp án: A
Giải thích:
Bảo toàn điện tích có:
2.0,02 + 0,03 = x + 2y
→ x + 2y = 0,07 (1)
mmuối = mion
= 0,02.64 + 0,03.39 + 35,5x + 96y
= 5,435
→ 35,5x + 96y = 2,985 (2)
Giải hệ phương trình (1) và (2) được x = 0,03 và y = 0,02.
Câu 20: Cho các dung dịch: HCl, NaOH đặc, NH3, KCl. Số dung dịch phản ứng được với Cu(OH)2 là
A. 1.
B. 3.
C. 2.
D. 4.
Đáp án: C
Giải thích:
2HCl + Cu(OH)2 → CuCl2 + 2H2O
4NH3 + Cu(OH)2 → [Cu(NH3)4](OH)2
Câu 21: Nung 6,58 gam Cu(NO3)2 trong bình kín không chứa không khí, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng
A. 2.
B. 3.
C. 4.
D. 1.
Đáp án: D
Giải thích:
2Cu(NO3)2 → 2CuO + 4NO2 (4x) + O2 (x mol)
Áp dụng định luật bảo toàn khối lượng có:
mchất rắn ban đầu = mchất rắn sau + mkhí
→ 6,58 = 4,96 + 46.4x + 32x
→ x = 0,0075 mol
Dẫn khí X vào nước
![]()
= 0,03 : 0,3 = 0,1
→ pH = 1.
Câu 22: Chất nào dùng để phát hiện vết nước trong các chất lỏng?
A. CaSO4 khan.
B. CuSO4 khan.
C. CuSO4.5H2O.
D. Cả A và B.
Đáp án: B
Giải thích:
CuSO4 khan dùng để phát hiện vết nước trong chất lỏng do CuSO4 khan dễ dàng hút nước tạo thành CuSO4.5H2O có màu xanh lam.
Câu 23: Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
A. 0,8 gam.
B. 8,3 gam.
C. 2,0 gam.
D. 4,0 gam
Đáp án: D
Giải thích:
Chỉ có CuO phản ứng với CO
CuO + CO Cu + CO2
Đặt nCuO = nCO = = x (mol)
Áp dụng định luật bảo toàn khối lượng có:
mchất rắn ban đầu + mCO phản ứng
= mchất rắn sau +
→ 9,1 + 28x = 8,3 + 44x
→ x = 0,05 mol
→ mCuO = 0,05.80 = 4 gam.
Câu 24: Cho các mô tả sau:
(1) Hoà tan Cu bằng dung dịch HCl đặc nóng giải phóng khí H2
(2) Ðồng dẫn nhiệt và dẫn điện tốt, chỉ thua Ag
(3) Ðồng kim loại có thể tan trong dung dịch FeCl3
(4) Có thể hoà tan Cu trong dung dịch HCl khi có mặt O2
(5) Ðồng thuộc nhóm kim loại nhẹ (d = 8,98 g/cm3)
(6) Không tồn tại Cu2O; Cu2S
Số mô tả đúng là:
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án: C
Giải thích:
(1) Sai vì Cu không tác dụng với HCl.
(2) Đúng
(3) Đúng, Cu + 2FeCl3 → CuCl2 + 2FeCl2
(4) Đúng, 2Cu + 4HCl + O2 → 2CuCl2 + 2H2O
(5) Sai, đồng thuộc nhóm kim loại nặng
(6) Sai, có tồn tại 2 chất trên
Câu 25: Khi so sánh trong cùng một điều kiện thì Cr là kim loại có tính khử mạnh hơn:
A. Fe.
B. K.
C. Na.
D. Ca.
Đáp án: A
Giải thích:
Crom đứng trước Fe trong dãy hoạt động hóa học → Cr có tính khử mạnh hơn Fe
Câu 26: Nhận xét nào dưới đây không đúng?
A. Hợp chất Cr(II) có tính khử đặc trưng, Cr(III) vừa có tính oxi hoá, vừa có tính khử, Cr(VI) có tính oxi hoá.
B. CrO, Cr(OH)2 có tính bazơ; Cr2O3; Cr(OH)3 lưỡng tính.
C. Cr2+; Cr3+ trung tính; Cr(OH)3 có tính bazơ.
D. Cr(OH)2 Cr(OH)3, CrO3 có thể bị nhiệt phân.
Đáp án: C
Giải thích:
Cr2+, Cr3+ có tính axit nên C không đúng
Câu 27: Trong không khí ẩm, các vật dụng bằng đồng bị bao phủ bởi lớp gỉ màu xanh. Lớp gỉ đồng là
A. (CuOH)2.CuCO3.
B. CuCO3.
C. Cu2O.
D. CuO.
Đáp án: A
Giải thích:
Trong không khí ẩm:
2Cu + CO2 + O2 + H2O → Cu(OH)2.CuCO3
Lớp gỉ đồng là Cu(OH)2.CuCO3
Câu 28: Nhiệt phân hoàn toàn 34,65 gam hỗn hợp gồm KNO3 và Cu(NO3)2, thu được hỗn hợp khí X có tỉ khối so với khí hiđro bằng 18,8. Khối lượng Cu(NO3)2 trong hỗn hợp ban đầu là
A. 9,40 g.
B.11,28 g.
C. 8,60 g.
D. 20,50 g.
Đáp án: A
Giải thích:
Đặt số mol KNO3 và Cu(NO3)2 lần lượt là x, y (mol)
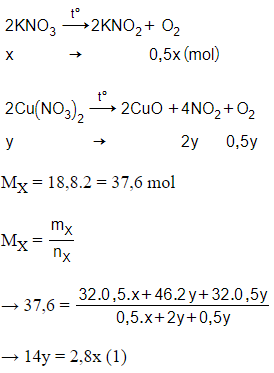
Lại có + = 34,65
→ 101x + 188y = 34,65 (2)
Từ (1) và (2) → x = 0,25; y = 0,05
→ = 0,25.188 = 9,4 gam
Câu 29: Cho phương trình ion:
Cu2+ + 2OH‒ → Cu(OH)2↓.
Phản ứng nào sau đây có phương trình ion thu gọn đã cho?
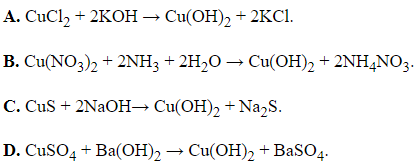
Đáp án: A
Giải thích:
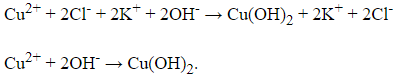
Câu 30: Phát biểu nào nào sau đây không đúng về crom và hợp chất của nó?
A. Màu của dung dịch K2Cr2O7 thay đổi khi cho dung dịch KOH vào.
B. Ancol etylic nguyên chất bốc cháy khi tiếp xúc với CrO3.
C. Kim loại Zn khử được ion Cr3+ trong dung dịch về Cr2+.
D. Cr(OH)2 vừa tan trong dung dịch KOH, vừa tan trong dung dịch HCl.
Đáp án: D
Giải thích:
A. Đúng

B. Đúng. CrO3 là chất oxi hóa mạnh, có khả năng bốc cháy khi tiếp xúc với ancol etylic hoặc nhiều phi kim khác tạo Cr3+
C. Đúng.
Zn + 2Cr3+ → 2Cr2+ + Zn2+
D. Sai. Cr(OH)2 có tính bazơ, tác dụng với axit, không tác dụng KOH.
Các câu hỏi Trắc nghiệm Hóa học lớp 12 có đáp án, chọn lọc khác:
Trắc nghiệm Nhận biết một số ion trong dung dịch có đáp án
Trắc nghiệm Nhận biết một số chất khí có đáp án
Trắc nghiệm Luyện tập: Nhận biết một số chất vô cơ có đáp án
Xem thêm các chương trình khác:
- Trắc nghiệm Sinh học lớp 7 có đáp án
- Trắc nghiệm Toán lớp 7 có đáp án
- Trắc nghiệm Ngữ văn lớp 7 có đáp án
- Trắc nghiệm Sinh học 8 có đáp án
- Trắc nghiệm Toán lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn 8 có đáp án
- Trắc nghiệm Hóa học lớp 8 có đáp án
- Trắc nghiệm Địa Lí lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Tiếng Anh lớp 8 có đáp án
- Trắc nghiệm GDCD lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Lịch sử lớp 8 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Vật Lí lớp 8 có đáp án
- Trắc nghiệm Công nghệ lớp 8 có đáp án
- Trắc nghiệm Tin học lớp 8 có đáp án
- Trắc nghiệm Sinh học lớp 9 có đáp án
- Trắc nghiệm Toán lớp 9 có đáp án
- Trắc nghiệm Ngữ văn 9 có đáp án
- Trắc nghiệm Hóa học lớp 9 có đáp án
- Trắc nghiệm Địa lí lớp 9 có đáp án
- Trắc nghiệm Tiếng Anh lớp 9 có đáp án
- Trắc nghiệm GDCD lớp 9 có đáp án
- Trắc nghiệm Lịch sử lớp 9 có đáp án
- Trắc nghiệm Vật lí lớp 9 có đáp án
- Trắc nghiệm Công nghệ lớp 9 có đáp án
- Trắc nghiệm Sinh học lớp 10 có đáp án
- Trắc nghiệm Toán lớp 10 có đáp án
- Trắc nghiệm Hóa học lớp 10 có đáp án
- Trắc nghiệm Ngữ văn lớp 10 có đáp án
- Trắc nghiệm Vật Lí lớp 10 có đáp án
- Trắc nghiệm Tiếng Anh lớp 10 có đáp án
- Trắc nghiệm Sinh học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Toán lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Hóa học lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Ngữ văn lớp 11 có đáp án
- Trắc nghiệm Tiếng Anh lớp 11 có đáp án
- Trắc nghiệm Vật Lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Địa lí lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm GDCD lớp 11 có đáp án
- Trắc nghiệm Lịch sử lớp 11 có đáp án (Sách mới) | Kết nối tri thức, Cánh diều, Chân trời sáng tạo
- Trắc nghiệm Công nghệ lớp 11 có đáp án
- Trắc nghiệm Giáo dục quốc phòng - an ninh lớp 11 có đáp án
- Trắc nghiệm Tin học lớp 11 có đáp án
