1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 22)
Bộ 1000 câu hỏi ôn tập môn Hóa có đáp án Phần 22 hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa.
1000 câu hỏi ôn tập Hóa (Phần 22)
a. Tính khối lượng của sắt tham gia phản ứng
b. Tính nồng độ mol của dung dịch H2SO4.
Lời giải:
nH2=33,622,4=1,5(mol)
PTHH: Fe + H2SO4 → FeSO4 + H2
Theo PTHH: nH2=nFe=nH2SO4=1,5(mol)
a. mFe = 1,5.56 = 84 (g)
b. ⇒CMH2SO4=1,50,5=3M
B. K;
C. Ca;
D. Ba.
Lời giải:
Đáp án đúng là: B
Gọi hoá trị của kim loại M là n (1≤n≤3)
PTHH:
2M + 2nH2O → 2M(OH)n + nH2↑ (1)
2M(OH)n + 2nH2O + 2nAl → 2M(AlO2)n + 3nH2↑ (2)
Còn lại 0,27 gam chất rắn không tan là khối lượng Al dư, M tan hết
Gọi số mol của kim loại M là x (mol, x >0)
Theo PTHH (1): nH2=n2nM=xn2(mol), nM(OH)n=nM=x(mol)
Theo PTHH (2): nH2=3n2nM(OH)n=3nx2(mol); nAlpu=n.nM(OH)n=nx(mol)
Tổng số mol của H2 là: 4nx2=0,04⇒nx=0,02 (*)
Tổng hỗn hợp A là 1,59 gam → MM.x+27.nx+0,27=1,59(**)
Thay (*) vào (**) ta được: MM.x = 0,78 (***)
Từ (*) ta có: x=0,02n thay vào (***), ta được:
Với n = 1 thì MM = 39 (g/mol)
Vậy M là kali (K).
C. 2,24 lít;
D. 2,88 lít.
Lời giải:
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
MgCO3 + 2HCl → MgCl2 + CO2↑ + H2O
Ta có:
→ 0,2 < nHCl = 2.nhh < 0,24
→ Hỗn hợp CaCO3 và MgCO3 dư, HCl phản ứng hết
Lời giải:
PTHH:
Ta có:
19,05. (56x + 16y) = 10,8. (56x + 71y)
1066,8x + 304,8y = 604,8x + 766,8y
462x = 462y
Vậy CTHH của oxit sắt là FeO.
Câu 5: Hoà tan 100 ml HCl 1M vào 400 ml NaOH 1M thủ được dung dịch X. Tính pH của dung dịch X?
Lời giải:
HCl + NaOH → NaCl + H2O
nHCl = 0,1.1 = 0,1 (mol)
nNaOH = 0,4.1 = 0,4 (mol)
Vì HCl phản ứng với NaOH theo tỉ lệ 1:1 nên với lượng đề bài cho thì HCl phản ứng hết, NaOH còn dư
nNaOH dư = 0,4 – 0,1 = 0,3 (mol)
V = 100 + 400 = 500 (ml) = 0,5 lít
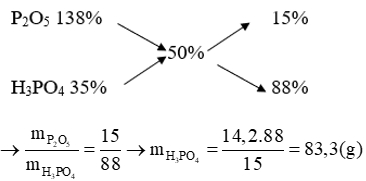
A. 76% và 24%.
B. 67% và 33%.
C. 24% và 76%.
D. 33% và 67%.
Lời giải:
Lời giải
P2O5 + 3H2O → 2H3PO4
142 → 2.98 = 196 (gam)
Coi P2O5 là dung dịch H3PO4 có:
Theo phương pháp đường chéo, ta có:
A. 78,72 g;
B. 30,16 g;
C. 29,72 g;
D. 24 g.
Lời giải
Đáp án đúng là: B
Ta có:
→ Sinh ra muối Na2HPO4 và Na3PO4
Nhận thấy
Bảo toàn khối lượng:
→ 0,2.98 + 0,48.40 = mrắn + 0,48.18 → mrắn = 30,16 (g).
A. 1,32;
B. 1,28;
C. 1,35;
D. 1,16.
Lời giải:
Đáp án đúng là: B
Số mol NO, NO2, N2 lần lượt là 0,06; 0,04; 0,03 mol
Giả sử chỉ tạo muối của các kim loại ta có:
mmuối = mkim loại + tạo muối = 15,35 + 62.(0,06.3 + 0,04 + 0,03.10) = 47,59 g < 82,15g
⇒ mmuối = mkim loại + 62.(006.3+0,04+0,03.10+8. + 80.
⇒ = 0,06 mol
⇒ Sử dụng công thức tính nhanh
= 4.0,06 + 2.0,04 + 12.0,03 + 10.0,06 = 1,28 mol
Lời giải:
Gọi hỗn hợp 3 kim loại là X có hóa trị y, số mol HCl là a.
PTPƯ: 2X + 2yHCl → 2XCly + 2H2↑
Theo ĐLBTKL ta có:
hay 17,5 + 36,5a = 31,7 + 2.0,5a
⇒ 17,5 + 36,5a = 31,7 + a
⇒ 36,5a – a = 31,7 − 17,5
⇒ 34,5a = 14,2
⇒
hay nHCl =0,4 mol
Theo phương trình:
Câu 11: Hòa tan 28 gam Fe bằng dung dịch HCl 2M vừa đủ
Lời giải:
a)
Phương trình hoá học: Fe + 2HCl → FeCl2 + H2
Theo PTHH: nHCl = 2nFe = 2.0,5 = 1 (mol)
b) Dung dịch thu được sau phản ứng: FeCl2
Theo phương trình hóa học :
Vì thể tích dung dịch thu được sau phản ứng không thay đổi đáng kể
→Vdd thu được =VHCl =0,5 (l)
→
Theo định luật bảo toàn khối lượng, ta có:
mmuối = 2,1 + 0,1.36,5 – 0,05.2 = 5,65 (g)
Câu 13: Hòa tan 2,4 gam CuO bằng 100 gam dung dịch H2SO4 29,4%
a) Tính khối lượng H2SO4 tham gia phản ứng
b) Tính C% các chất có trong dung dịch thu được.
Lời giải:
PTHH: CuO + H2SO4 → CuSO4 + H2O
Nên CuO hết, H2SO4 dư
B. 0,585;
C. 2,340;
D. 1,755.
Lời giải:
Đáp án đúng là: A
→nhỗn hợp = 0,01.6 = 0,06 (mol)
Đặt nCaO + nKOH = a và nNaOH = b
→ a + b + 0,01 = 0,06 (1)
mhỗn hợp = 56a + 40b + 0,01.40 = 2,88 (2)
Giải (1) và (2), ta được: a = 0,03; b = 0,02
→ nNaCl = b = 0,02 (mol) → mNaCl = 1,17 (g).
Lời giải:
PTHH:
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
MgO + H2SO4 → MgSO4 + H2O
ZnO + H2SO4 → ZnSO4 + H2O
Theo các PTHH nhận thấy:
Áp dụng ĐL BTKL ta có:
→ m = mmuối = 2,81 + 0,05.98 − 0,05.18 = 6,81 (gam)
a) Xác định thành phần % theo khối lượng mỗi kim loại trong hỗn hợp
b) Tìm thể tích dung dịch H2SO4 đã dùng.
Lời giải:
a) Ta thấy 8,7 gam chất rắn không tan là Ag.
⇒ mZn,Mg = 20 – 8,7 = 11,3 (gam)
Đặt nMg = x(mol); nZn = y (mol) thì:
24x + 65y = 11,3 (1)
PTHH:
Mg + H2SO4 → MgSO4 + H2↑
x → x → x (mol)
Zn + H2SO4 → ZnSO4 + H2↑
y → y → y (mol)
Theo đề cho: = 0,3 (mol)
⇒ x + y = 0,3 (2)
Từ (1) và (2) ta có hệ phương trình :
Do đó :
b) Theo các PT: = x + y = 0,3 (mol)
Lời giải:
Đặt công thức chung của 2 kim loại kiềm A, B là R
PTHH:
Ba + 2H2O → Ba(OH)2 + H2
x x x (mol)
2R + 2H2O → 2ROH + H2
y y y/2 (mol)
Ba(OH)2 + Na2SO4 → BaSO4 + 2NaOH
x x
Theo bài ra ta có:
= x + y/2 = 0,25 (1)
mhh = 137x + MR.y = 23 (2)
0,09 < x < 0,105 (3)
Từ (1) và (2) →
Kết hợp với (3) → 29,7 < R < 33,3
Mà 2 kim loại kiềm ở 2 chu kì liên tiếp nhau nên là Na và K.
Câu 18: Hòa tan 30g hỗn hợp Cu và CuO trong 1,5 lít dung dịch axit HNO3 1M (loãng) thấy thoát 6,72 lít NO (đktc) là sản phẩm khử duy nhất
1. Tính phần trăm khối lượng mỗi chất trong hỗn hợp ban đầu
Lời giải:
Sơ đồ phản ứng:
Bảo toàn electron: 2nCu = 3nNO
mCu = 0,45.64 = 28,8 (g)
b) Ta có:
mCuO = 30 – 28,8 = 1,2 (g)
Bảo toàn nguyên tố Cu:
Mặt khác: ban đầu = 1,5.1 = 1,5 (mol)
Bảo toàn nguyên tố N:
Câu 19: Hòa tan 4,84 gam Mg kim loại bằng dung dịch HCl thấy thoát ra 0,4 gam H2
a) Xác định nguyên tử khối của Mg?
Lời giải:
a) Mg + 2HCl → MgCl2 + H2 (1)
Theo (1) = 0,4/2 = 0,2 mol
Suy ra MMg = 4,84/0,2 = 24,2 g/mol
b) Gọi đồng vị còn lại có số khối là
vì tỉ số 2 đồng vị là 4:1 nên có 1 đồng vị chiếm 80%, 1 đồng vị chiếm 20%
TH1: chiếm 20% suy ra đồng vị còn lại chiếm 80%
Mtrung bình =24.20% + x.80% = 24,2 suy ra x = 24,25 (loại)
TH2: chiếm 80% suy ra đồng vị còn lại chiếm 20%
Mtrung bình=24.80% + x.20% = 24,2 suy ra x = 25
Vậy số khối của đồng vị còn lại là 25.
Câu 20: Hòa tan 4,9 mg H2SO4 vào nước thu dược 1 lít dung dịch. pH của dung dịch thu được là?
Lời giải:
Lời giải:
Gọi kim loại là R
PTHH: Fe + 2HCl → FeCl2 + H2 (1)
R + 2HCl → RCl2 + H2 (2)
Theo PTHH (1), (2), ta có:
Vì MFe = 56 > 40 → MR < 40
Mặt khác 2,4 gam R hoà tan thì dùng không hết 0,5 mol HCl
Vậy 9,6 < MR < 40 → MR = 24 (g/mol)
Vậy R là magie (Mg).
B. 3,36;
C. 4,48;
D. 6,72.
Lời giải:
Đáp án đúng là: A
Bảo toàn số mol electron:
3nFe = 3nNO → nNO = nFe = 0,1 (mol) → VNO = 2,24 lít.
Lời giải:
- Gọi n là hóa trị của kim loại R cần tìm:
2R + 2nHCl → 2RCln + nH2
n =1→ MR = 9 (loại)
n = 2 → MR = 18 (loại)
n = 3 → MR = 27 (Nhôm: Al)
A. 40% Fe, 28% Al, 32% Cu;
B. 41% Fe, 29% Al, 30% Cu;
C. 42% Fe, 27% Al, 31% Cu;
D. 43% Fe, 26% Al, 31% Cu.
Lời giải
Đáp án đúng là: C
Vì Cu không tan trong HCl nên:
⇒mCu = 1,86 gam.
⇒mFe + mAl = 6 − 1,86 = 4,14 gam
Gọi nFe là a (mol), nAl là b (mol).
PTHH: Fe + 2HCl → FeCl2 + H2↑ (1)
2Al + 6HCl → 2AlCl3 + 3H2↑ (2)
Theo đề bài ta có hệ
Gọi công thức chung của 2 kim loại là R
Phản ứng xảy ra:
R + 2HCl → RCl2 + H2
Ta có:
Vì 24 < 35 < 40 và 2 kim loại nhóm IIA liên tiếp nhau nên 2 kim loại thỏa mãn là Mg; Ca.
A. 72,95%.
B. 54,12%.
C. 27,05%.
D. 45,89%.
Lời giải:
Đáp án đúng là: B
Gọi công thức chung của 2 kim loại kiềm là M
2M + 2H2O → 2MOH + H2↑
0,3 ← 0,15 (mol)
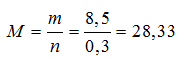
Þ Mx < 28,33 < MY và X, Y là 2 kim loại kiềm kế tiếp
Þ X là kim loại Na, Y là kim loại K.
Na: x ( mol) ; K: y (mol)
Câu 27: Hoà tan 80 gam CuSO4 vào nước thu được 500 ml dung dịch
b) Tính V dung dịch KOH 0,5M đủ để làm kết tủa hết ion
c) Tính V dung dịch BaCl2 0,25M đủ để làm kết tủa hết ion
Lời giải:
0,5……1 (mol)
c,
0,5……0,5 (mol)
a, Tính phần trăm khối lượng của các kim loại có trong hỗn hợp
b, Cho dung dịch KOH dư vào dung dịch X thì thu được bao nhiêu gam kết tủa?
Lời giải:
a, Đặt nMg = a; nAl = b
Ta có, hệ phương trình:
Suy ra: , %mAl = 100% - 40% = 60%
b, Khi cho KOH dư thì Al(OH)3 sẽ tan tạo KAlO2
→ mkết tủa =
Câu 29: Hòa tan 9,4 gam K2O vào 190,6 gam H2O thu được A. Tính nồng độ % dung dịch A.
Lời giải:
Ta có phương trình hóa học
K2O + H2O → 2KOH
Áp dụng định luật bảo toàn khối lượng
→ mdung dịch KOH là 9,4 + 190,6 = 200 (g)
Ta có : mKOH = 0,2.(39 + 16 +1) = 11,2 gam
Bảo toàn electron:
Muối thu được là: MgSO4, Al2(SO4)3, Fe2(SO4)3
Bảo toàn điện tích:
mmuối = mkim loại + = 16,3 + 0,55.96 = 69,1 (g).
Ta có:
Gọi
→ 84a + 100a + 111a + 208a = 37,725
→ a = 0,075
Các phản ứng xảy ra:
Na2O + H2O → 2NaOH
0,075………….0,15
NaHCO3 + NaOH → Na2CO3 + H2O
0,075…….0,075……0,075
2KHCO3 + 2NaOH → Na2CO3 + K2CO3 + 2H2O
0,075……..0,075…….0,0375…..0,0375
K2CO3 + BaCl2 → BaCO3 + 2KCl
0,0375…0,0375….0,0375….0,075
Na2CO3 + BaCl2 → BaCO3 + 2NaCl
0,0375…0,0375….0,0375…..0,075
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
0,075……0,075……0,075…..0,15
Trong
Xem
Bảo toàn khối lượng:
mdd = 37,725 + 4,65 + 130.1 – 0,075.100 + 197.0,075 = 150,1 (g)
B. 33,225g
C. 35,25g
D. 37,25g
Lời giải:
Đáp án đúng là: B
150 ml = 0,15 (lít)
nHCl = V.CM HCl = 0,15.1 = 0,15 (mol)
= V.CM = 0,15.1,5 = 0,225 (mol)
PTHH: Mg + 2HCl → MgCl2 + H2↑ (1)
2Al + 6HCl → 2AlCl3 + 3H2↑ (2)
Mg + H2SO4 → MgSO4 + H2↑ (3)
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑ (4)
Theo PTHH (1) và (2) ta thấy:
Theo PTHH (3) và (4) ta thấy: = 0,225 (mol)
⟹ Tổng mol H2(1)+(2)+(3)+(4) = 0,075 + 0,225 = 0,3 (mol)
Bảo toàn khối lượng ta có:
⟹ 6,3 + 0,15.36,5 + 0,225.98 = mmuối + 0,3.2
⟹ mmuối = 33,225 (g)
B. 22,54;
C. 12,375;
D. 17,71.
Lời giải:
Đáp án đúng là: A
Khi số mol KOH tăng mà vẫn thu được a gam kết tủa => Khi cho 0,22 mol KOH vào thì ZnSO4 còn dư => số mol kết tủa = 0,11 mol
Khi cho 0,28 mol KOH thì ZnSO4 hết và số mol kết tủa vẫn còn là 0,11 mol:
ZnSO4 + 2OH- → Zn(OH)2 ↓
0,11+x 2(0,11+x) 0,11 + x
Zn(OH)2 + 2OH- → + H2O
0,03 – x 0,06 – 2x
Theo giả thiết ta có: (0,11 + x) - (0,03 - x) = 0,11 => x = 0,015
Vậy số mol ZnSO4 ban đầu: 0,11 + 0,015 = 0,125 mol
=> = 0,125.161 = 20,125 (g).
A. 45,3;
B. 55,3;
C. 46,1;
D. 56,1.
Lời giải:
Đáp án đúng là: A
Hỗn hợp gồm các kim loại khi tác dụng với dung dịch HCl loãng đều thể hiện hoá trị II nên gọi chung là R
PTHH: R + 2HCl → RCl2 + H2
Theo PTHH:
Áp dụng định luật bảo toàn khối lượng, ta có:
mkim loại + mHCl = mmuối +
→ mmuối = 16,9 + 0,8.36,5 – 0,4.2 = 45,3 (g).
Lời giải:
2A + 2nHCl → 2ACln + nH2
→ n=1 thì MA = 39 (g/mol)
→ A là Kali (K)
= 0,015.2 = 0,03 (mol)
a, Tính % của mỗi chất trong hỗn hợp ban đầu.
b, Tính a, tính nồng độ mol chất tan trong dung dịch A và khối lượng riêng dung dịch.
Lời giải:
a) Mg + H2SO4 → MgSO4 + H2
MgO + H2SO4 → MgSO4 + H2O
mMg = n.M = 0,1.24 = 2,4 (g)
b) mMgO = 10,4 − 2,4 = 8 (g)
Lời giải:
Áp dụng sơ đồ đường chéo, ta có:
N2O: 44 26,25
28,25
H2: 2 15,75
m↓ = 4,93.2 = 9,86 < mX = 13,18
mmuối = 21,64.2 = 43,28 (g)
Giả sử dung dịch Y không chứa muối amoni
→ Dung dịch Y chứa muối ( x mol)
Y gồm:
mY = 13,18 + 18x + 35,5.0,76 + 23.(0,1 + x) = 43,28 → x = 0,02
mM = mX – mMg = 13,18 – 0,17.24 = 9,1
Bảo toàn electron:
Vậy M là kẽm (Zn).
A. KHCO3, K2CO3
B. NaHCO3, Na2CO3
C. LiHCO3, Li2CO3
D. Cả A, B đều đúng.
Lời giải:
Đáp án đúng là: A
nHCl = 0,3 mol
= 0,075 mol
AHCO3 + HCl → ACl + CO2 + H2O
x x
A2CO3 + 2HCl → 2ACl + CO2 + H2O
y 2y
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
0,075 0,15
Ta có: x + 2y = 0,15
Với 0 < y < 0,075
Mặt khác: Ax + 61x + 2Ay +60y = 13,45
Þ A.(0,15 – 2y) + 61.(0,15 – 2y) + 2Ay + 60y = 13,45
Þ 0,15A - 2Ay + 9,15 - 122y + 2Ay + 60y = 13,45
Þ 0,15A - 4,3 = 62y
Þ
Với y > 0 Þ
Þ A > 28,7 (1)
Với y < 0,075 Þ
Þ A< 59,7 (2)
Từ (1) và (2): 28,7 < A < 59,7
Þ A là kali
Þ CTHH: KHCO3, K2CO3
B. m = 25,45 (g);
C. m = 24,85 (g);
D. m = 36,4 (g).
Lời giải:
Đáp án đúng là: A
Hỗn hợp gồm các kim loại khi tác dụng với dung dịch HCl loãng đều thể hiện hoá trị II nên gọi chung là R
PTHH: R + 2HCl → RCl2 + H2
Theo PTHH:
Áp dụng định luật bảo toàn khối lượng, ta có:
mkim loại + mHCl = mmuối +
→ mmuối = 14,5 + 0,6.36,5 – 0,3.2 = 35,8 (g).
C. 17,7 g;
D. 53,1 g.
Lời giải:
Đáp án đúng là: B
Ta có:
(muối) = ne nhường = ne nhận = 3nNO = 0,9 mol
mmuối = mkim loại + = 15,9 + 0,9.62 = 71,7 (g)
a. Tính khối lượng muối tạo thành trong dung dịch X.
b. Tính khối lượng dung dịch X thu được sau phản ứng.
Lời giải:
a)
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
0,08………………0,04 mol
X: Al2(SO4)3
b) Theo PTHH có:
Khối lượng dung dịch H2SO4 20% là:
Bảo toàn khối lượng:
Þ mdd X = 2,16 + 58,8 – 0,12.2 = 60,72 gam.
Gọi
C. 0,448 lít;
D. 4,48 lít.
Lời giải:
Đáp án đúng là: C
nMg = 0,1 (mol)
Ta có các quá trình:
b. Để trung hoà lượng HCl dư trong dung dịch A cần dùng 100 ml dung dịch NaOH 2M. Tính m.
Lời giải:
a) R + 2HCl → RCl2 + H2
Theo PTHH:
Vậy R là canxi (Ca).
b)
100 (ml) = 0,1 (l)
nNaOH = 0,1.2 = 0,2 (mol)
HCl + NaOH → NaCl + H2O
Theo PTHH: nHCl (dư) = nNaOH = 0,2 (mol)
Tổng số mol HCl ban đầu là: 0,1 + 0,2 = 0,3 (mol)
B. 4,83 gam.
C. 7,33 gam.
D. 7,23 gam.
Lời giải:
Đáp án đúng là: D
Ta có mMuối = mKim loại +
Mà = 0,05 mol.
⇒ mMuối = 2,43 + 0,05×96 = 7,23 gam.
Quy đổi hỗn hợp thành Fe (a mol), Cu (b mol) và O (c mol)
→mX = 56a + 64b + 16c = 4,88 (1)
Bảo toàn electron: 3a + 2b = 2c + 2= 2c + 0,09 (2)
Muối gồm Fe2(SO4)3 (0,5a mol) và CuSO4 (b mol)
mmuối = 400.0,5a + 160b = 13,2 (3)
Giải (1), (2), (3), ta được: a = 0,05; b = 0,02; c = 0,05
→ Fe : O = a : c = 1 : 1 → FeO
X gồm FeO (0,05 mol) và Cu (0,02 mol)
Khối lượng của mỗi chất có trong hỗn hợp X là:
mFeO = 0,05.72 = 3,6 (g); mCu = 0,02.64 = 1,28 (g)
C. 25,95 gam;
D. 77,86 gam.
Lời giải:
Đáp án đúng là: A
Số mol của hiđro bằng:
Lại có:
Khối lượng muối tạo thành bằng: 7,74 + 0,5.36,5 + 0,14.98 – 0,39.2 = 38,93 (gam).
Lời giải:
X gồm cation kim loại (7,83 gam), Cl- (0,1 mol), OH- (0,15 mol)
→ mrắn = 13,93 gam
nX = nHCl + = 0,25 (mol)
→ MX = 31,32
Nếu 2 kim loại kế tiếp thì X gồm Na, K.
Lời giải:
- Nếu R là Mg: %mFe = 87,5%; %mMg = 12,5%
- Nếu R là Ca: %mFe =58,33%; %mCa = 41,63%
Giải thích các bước giải:
Gọi số mol Fe và R là a và b
Ta có: 56a + R.b = 9,6 (1)
Phương trình hóa học:
Fe + 2HCl → FeCl2 + H2
R + 2HCl → RCl2 + H2
Ta có: a + b = 0,2 (2)
Vì khi cho quỳ vào thì hóa đỏ, nên HCl còn dư
→nHCl phản ứng < nHCl = 0,5 mol
Từ (1) và (2) ta có:
→18,4 < R < 56
→R là Mg hoặc Ca
- Nếu R là Mg
a + b =0,2 và 56a + 24b = 9,6
→a = 0,15; b = 0,05
→%mMg = 12,5%
- Nếu R là Ca
a + b = 0,2 và 56a + 40b = 9,6
→a = b = 0,1
→%mCa = 41,63%.
Xem thêm các câu hỏi ôn tập Hóa học chọn lọc, hay khác:
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 18)
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 19)
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 20)
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
