1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 10)
Bộ 1000 câu hỏi ôn tập môn Hóa có đáp án Phần 10 hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa.
1000 câu hỏi ôn tập Hóa (Phần 10)
Câu 1: Cân bằng phương trình hoá học bằng phương pháp thăng bằng electron:
Lời giải:
+2Fe−1S2+ 0O2→t°
Ta có các quá trình:
Lời giải:
Giả sử có 1 mol nguyên tử Mg thì chứa 6,02.1023 nguyên tử Mg
Thể tích của 1 mol nguyên tử Mg là
Ta có: V1 nguyên tử =
Gọi cạnh của hình lập phương là a cm. Vì các nguyên tử Mg là hình cầu nội tiếp trong các hình lập phương nên bán kính của nguyên tử Mg là r = 0,5a (cm)
Ta có thể tích của hình lập phương là a3 = (2r)3 =
Câu 3: Nêu cách điều chế Ca(OH)2?
Lời giải:
Một số cách điều chế Ca(OH)2
CaC2 + 2H2O → C2H2 + Ca(OH)2
CaO + H2O → Ca(OH)2
Ca + 2H2O → Ca(OH)2 + H2
Lời giải:
Dung dịch HCl pH = 1 có
Dung dịch HCl pH = 2 có
Khi trộn 2 dung dịch thu được dung dịch mới có
Thể tích dung dịch mới là V1 + V2 (lít)
Dung dịch mới có pH = 1,26
Câu 5: Viết phương trình dạng phân tử ứng với phương trình ion rút gọn sau :
Lời giải:
a) HCl + NaOH → NaCl + H2O
b) BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
c) NH4Cl + NaOH → NH3↑ + NaCl + H2O
d) 2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
Câu 6: Hoà tan 2,13 gam Al(NO3)3 vào nước được 200 ml dung dịch. Nồng độ của ion trong dung dịch là:
Lời giải:
Câu 7: Hãy tính phân tử khối của phân tử CaSO4?
Lời giải:
Phân tử khối của phân tử CaSO4 là: 40 + 32 + 16. 4 = 136 đvC.
Lời giải:
→ dư → quỳ tím chuyển sang màu đỏ
Câu 9: Viết phương trình phân tử và phương trình ion rút gọn sau:
Lời giải:
Phương trình phân tử:
Ca(HCO3)2 + 2NaOH→ CaCO3↓ + Na2CO3 + H2O
Phương trình ion rút gọn:
Câu 10: Cho 6,5 gam kẽm tác dụng vừa đủ với 200 ml dung dịch HCl
a) Tính nồng độ mol dung dịch axit đã tham gia?
b) Tính thể tích khí hiđro thu được (ở đktc)?
Lời giải:
Phương trình: Zn + 2HCl → ZnCl2 + H2
a) Theo phương trình: nHCl = 2nZn = 2. 0,1 = 0,2 (mol)
b) Theo phương trình:
Lời giải:
Các cách viết:
4 C: Bốn nguyên tử cacbon;
6 Al: Sáu nguyên tử nhôm;
8 Ca: Tám nguyên tử canxi.
Áp dụng:
Bốn nguyên tử nitơ: 4 N;
Mười hai nguyên tử canxi: 12 Ca;
Sáu nguyên tử natri: 6 Na.
Lời giải:
Gọi px; py lần lượt là số proton của X và Y.
nx; ny lần lượt là số nơtron của X và Y.
Theo bài ra ta có hệ phương trình:
Lại có:
Vậy X là Ca, Y là C.
Câu 13: Có 4 chất rắn: KNO3; NaNO3; KCl; NaCl. Hãy nêu cách phân biệt chúng?
Lời giải:
Đem đốt bốn chất rắn trên
– Muối của Na cháy với ngọn lửa màu cam (NaNO3 và NaCl) (nhóm 1)
– Muối của K cháy với ngọn lửa màu tím (KNO3 và KCl) (nhóm 2)
Cho dung dịch AgNO3 vào lần lượt từng mẫu ở hai nhóm 1 và 2 nếu thấy:
– Có kết tủa trắng xuất hiện là NaCl và KCl
– Không có hiện tượng gì là NaNO3 và KNO3
Phương trình:
AgNO3 + NaCl → AgCl↓ + NaNO3
AgNO3 + KCl → AgCl↓ + KNO3
Lời giải:
Nếu H = 100% thì ta có:
Mà
Lời giải:
Câu 16: Viết phương trình ion thu gọn của: K2CO3 + MgSO4
Lời giải:
Phương trình phân tử:
K2CO3 + MgSO4 → K2SO4 + MgCO3↓
Phương trình ion thu gọn:
Câu 17: Nhận biết MgSO4, K2CO3, BaCl2, Na2SO3?
Lời giải:
- Trích các mẫu thử ra ống nghiệm, có đánh số lần lượt
- Dùng dung dịch H2SO4 để nhận biết:
+ Chất nào cho khí mùi hắc thoát ra là Na2SO3:
Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2↑
+ Chất nào cho khí thoát ra là K2CO3:
K2CO3 + H2SO4 → K2SO4 + H2O + CO2↑
+ Chất nào cho kết tủa trắng là BaCl2:
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
+ Chất còn lại, không có hiện tượng gì là MgSO4.
Lời giải:
Gọi số mol Na2CO3 và NaHCO3 phản ứng lần lượt là x (mol) và y (mol).
Phương trình hoá học:
Na2CO3 + 2HCl → 2NaCl + CO2↑ + H2O
x 2x x mol
NaHCO3 + HCl → NaCl + CO2↑ + H2O
y y y mol
Theo bài ra: nkhí = x + y = 0,125 (1)
Lại có:
Từ (1) và (2) ta có: x = 0,05 và y = 0,075.
Þ nHCl = 2x + y = 0,175 mol Þ VHCl = 0,175/1 = 0,175 lít = 175 ml.
Câu 19: Tính số mol của 4 gam khí H2?
Lời giải:
Câu 20: Tính thể tích của hỗn hợp gồm 14 gam nitơ và 4 gam khí NO (ở đktc)?
Lời giải:
Thể tích của hỗn hợp khí ở đktc là:
Câu 21: Nêu ví dụ về vật thể tự nhiên, vật thể nhân tạo?
Lời giải:
- Vật thể tự nhiên là những vật thể có sẵn trong tự nhiên.Ví dụ: Cây ngô, sông, suối,…
- Vật thể nhân tạo là những vật thể do con người tạo ra. Ví dụ: Ấm đun nước, bàn, ghế,…
Lời giải:
Oxide cao nhất của nguyên tố R là RO3. Công thức hợp chất khí với hydrogen của R là RH2. Trong hợp chất khí của R với hydrogen có 5,88% hydrogen về khối lượng nên:
Vậy R là sulfur (S), oxide cao nhất của R là SO3.
Lời giải:
Lấy mỗi lọ ra 1 ít cho vào 3 chén sứ để làm thí nghiệm
Dùng quỳ tím nhúng vào các chén sứ đựng mẫu thử.
- Dung dịch HCl làm quỳ tím chuyển thành màu đỏ
- Dung dịch NaOH làm quỳ tím chuyển thành màu xanh
- Dung dịch NaCl không làm quỳ tím chuyển màu.
Lời giải:
- Lấy mỗi chất 1 ít ra từng ống nghiệm làm mẫu thử, đánh số thứ tự tương ứng
- Cho vào 4 mẫu mỗi mẫu 1 mẩu giấy quỳ tím
+ Nếu mẫu nào quỳ tím hóa đỏ thì lọ đựng HCl
+ Nếu mẫu nào quỳ tím hóa xanh thì lọ đó là NaOH
+ Hai mẫu còn lại là NaNO3 và NaCl
- Cho vào mẫu vài giọt AgNO3.
+ Nếu mẫu nào có kết tủa trắng thì đó là NaCl
NaCl + AgNO3 → NaNO3 + AgCl↓
+ Mẫu còn lại không có hiện tượng gì là NaNO3
Câu 25: Cho các phát biểu sau đây:
(a) Ancol có nhiệt độ sôi cao hơn nhiệt độ sôi của anđehit tương ứng.
(b) Dung dịch AgNO3 trong NH3 có thể oxi hóa axetilen tạo kết tủa vàng.
(c) Để trái cây nhanh chín có thể cho tiếp xúc với khí axetilen.
(d) Cho axetilen phàn ứng với nước có xúc tác HgSO4/H2SO4 thu được duy nhất một ancol.
(e) Trùng hợp etilen thu được teflon.
(f) Dung dịch AgNO3 trong NH3 có thể oxi hóa andehit tạo kết tủa trắng, ánh kim.
Trong số các phát biểu trên, số phát biểu không đúng là:
Lời giải:
Đáp án đúng là: A
Phát biểu (a) đúng. Giữa các phân tử của ancol có liên kết hidro liên phân tử còn giữa các phân tử andehit không có liên kết hidro liên phân tử nên nhiệt độ sôi cao hơn nhiệt độ sôi của andehit tương ứng.
Phát biểu (b) sai. Dung dịch AgNO3 trong NH3 có thể phản ứng với axetilen tạo kết tủa vàng nhưng đó không phải là phản ứng oxi hóa mà là phản ứng thế nguyên tử H.
Phát biểu (c) sai. Để trái cây nhanh chín có thể cho tiếp xúc với khí etilen hay đất đèn (chất sinh khí axetilen).
Phát biểu (d) sai. Cho axetilen phản ứng với nước có xúc tác HgSO4/H2SO4 thu được duy nhất một andehit.
Phát biểu (e) sai. Trùng hợp etilen thu được polietilen còn gọi là Teflon hay poli (tetrafloetilen) là một polime có công thức hóa học là
Phát biểu (f) đúng. Andehit tham gia phản ứng tráng gương tạo Ag có màu trắng, có ánh kim.
Vậy có tất cả 4 phát biểu sai.
Lời giải:
Đáp án đúng là: D
Đặt công thức hợp chất Y là CxHy có phân tử khối MY.
%C = 82,76 ⇒ %H = 100 − 82,76 = 17,24%
Vì khối lượng mỗi nguyên tố tỉ lệ với thành phần phần trăm khối lượng của nó.
Ta có:
Công thức của Y là C4H10.
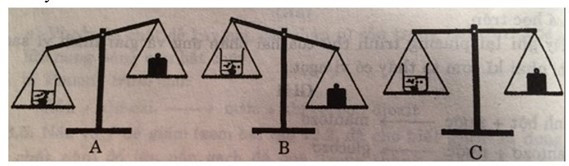
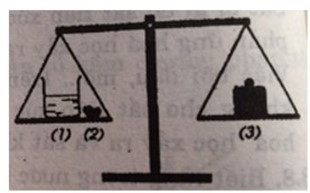
Lời giải:
Sau một thời gian phản ứng, cân ở vị trí B. Vì khi cho đá vôi vào dung dịch axit clohiđric có phản ứng sinh ra khí cacbon đioxit thoát ra ngoài làm cho khối lượng trong cốc sẽ giảm đi.
Lời giải:
Đáp án đúng là: A
gồm
Lời giải:
Lấy mẫu thử và đánh dấu
Cho quỳ tím vào các mẫu thử:
- Mẫu thử làm quỳ tím hoá đỏ là dung dịch axit
- Mẫu thử làm quỳ tím hoá xanh là dung dịch bazơ
- Mẫu thử không làm quỳ tím chuyển màu là dung dịch muối.
Câu 30: Cho các phát biểu sau về anilin:
(a) Anilin là chất lỏng, không màu, rất độc, ít tan trong nước.
(b) Anilin là amin bậc I, có tính bazơ và làm quỳ tím đổi sang màu xanh.
(c) Anilin chuyển sang màu nâu đen khi để lâu trong không khí vì bị oxi hoá bởi oxi không khí.
(d) Anilin là nguyên liệu quan trọng trong công nghiệp phẩm nhuộm, polime, dược phẩm,…
Lời giải:
Đáp án đúng là: B
3 phát biểu đúng là (a), (c), (d)
Phát biểu (b) sai vì anilin không làm quỳ tím đổi màu.
Câu 31: Cho biết 1 nguyên tử Mg có 12e, 12p, 12n.
a) Tính khối lượng 1 nguyên tử Mg?
b) 1 (mol) nguyên tử Mg nặng 24,305 (g). Tính số nguyên tử Mg có trong 1 (mol) Mg.
Lời giải:
Số khối A = p + n = 12 + 12 = 24 đvC
1 đvC = 1,67. 10-24 gam
Khối lượng của 1 nguyên tử Mg là 1,67. 10-24. 24 = 40,08. 10-24 gam
1 mol Mg chứa số nguyên tử là:
Câu 32:
a) Phân tử X có phân tử khối 80 và được tạo nên từ hai nguyên tố Cu và O.
b) Phân tử Y có phân tử khối bằng phân tử khối của X. Y được tạo nên từ hai nguyên tố S,O.
Lời giải:
a) CTHH: CuO
PTKCuO = 64 + 16 = 80 đvC
b) CTHH: SO4
PTKSO4 = 32 + 16. 4 = 96 đvC
c) Phân tử Z có PTK = 80. 1,225 = 98
Gọi số nguyên tử S là X
Số nguyên tử H gấp đôi số nguyên tử của S → H có 2X nguyên tử
Số nguyên tử O gấp đôi số nguyên tử H → O có 4X nguyên tử
Gọi CTHH là H2XSXO4X, ta có:
1. 2X + 32. X + 16. 4X = 98 → X = 1
Vậy CTHH là H2SO4.
Lời giải:
Đáp án đúng là: A
Bảo toàn electron:
Giải hệ (1) và (2)
nAl = 0,2 (mol); nMg = 0,1 (mol)
Lời giải:
Phản ứng xảy ra: 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu
Gọi số mol Al phản ứng là x (mol; x > 0)
→mthanh nhôm tăng = mCu – mAl
→ 64. 1,5x – 27x = 76,9 – 70 = 6,9 → x = 0,1
→ mCu = 64. 1,5x = 9,6 (gam)
Lời giải:
Đáp án đúng là: A
Bảo toàn nguyên tố H: 5,5 = 5,33 + 4.nglixerol + nY – 0,33
→ nglixerol = 0,125 – 0,25. nY
Bảo toàn khối lượng: 104 + 0,66. 40 = 119,8 + (0,125 – 0,25.nY).92 + 18nY
→ nY = 0,18
→ nglixerol = 0,125 – 0,25nY = 0,08
→ = 0,21
Câu 36: Cho các thí nghiệm sau:
(a) Cho a mol bột Fe vào dung dịch chứa a mol AgNO3 và a mol Fe(NO3)3.
(b) Cho dung dịch chứa a mol K2Cr2O7 vào dung dịch chứa a mol NaOH.
(c) Cho dung dịch chứa a mol NaHSO4 vào dung dịch chứa a mol BaCl2.
(d) Cho dung dịch chứa a mol KOH vào dung dịch chứa a mol NaH2PO4.
(e) Cho a mol khí CO2 vào dung dịch chứa 1,5a mol KOH.
(f) Cho dung dịch chứa a mol HCl vào dung dịch chứa 2a mol KAlO2.
(g) Cho a mol Fe(OH)2 vào dung dịch chứa a mol H2SO4 loãng.
(h) Cho a mol Na2O vào dung dịch chứa a mol BaCl2 và a mol NaHCO3.
Số thí nghiệm thu được dung dịch chứa hai chất tan sau khi các phản ứng xảy ra hoàn toàn là:
Lời giải:
Đáp án đúng là: A
Thí nghiệm thu được dung dịch chứa 2 chất tan là: (c); (d); (e); (f); (h).
(a) Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
Fe + 2Fe(NO3)3 → 3Fe(NO3)2
→ Dung dịch sau phản ứng chứa Fe(NO3)2.
(b) K2Cr2O7 + 2NaOH → K2CrO4 + Na2CrO4 + H2O
→ Dung dịch sau phản ứng chứa K2CrO4; Na2CrO4; K2Cr2O7.
(c) NaHSO4 + BaCl2 → BaSO4↓ + NaCl + HCl
→ Dung dịch sau phản ứng chứa NaCl; HCl.
(d) 2KOH + 2NaH2PO4 → K2HPO4 + Na2HPO4 + 2H2O
→ Dung dịch sau phản ứng chứa K2HPO4; Na2HPO4.
(e) 2CO2 + 3KOH → K2CO3 + KHCO3 + H2O
→ Dung dịch sau phản ứng chứa K2CO3; KHCO3.
(f) KAlO2 + HCl + H2O → KCl + Al(OH)3
→ Dung dịch sau phản ứng chứa KCl; KAlO2.
(g) Fe(OH)2 + H2SO4 loãng → FeSO4 + 2H2O
→ Dung dịch sau phản ứng chứa FeSO4.
(h) Na2O + H2O → 2NaOH
NaOH + NaHCO3 →Na2CO3 + H2O
Na2CO3 + BaCl2 → BaCO3↓ + 2NaCl
→ Dung dịch sau phản ứng chứa NaCl; NaOH.
Câu 37: Cho từ từ dung dịch HCl cho đến dư vào dung dịch Na2CO3. Hiện tượng xảy ra?
C. đầu tiên không có hiện tượng gì sau đó mới có khí bay ra;
D. có kết tủa trắng xuất hiện.
Lời giải:
Đáp án đúng là: C
HCl + Na2CO3 → NaHCO3 + NaCl
→ Chưa thấy hiện tượng
HCl + NaHCO3 → NaCl + H2O + CO2↑
→ Có khí bay ra.
Lời giải:
Đáp án đúng là: B
X đơn chức và tác dụng với NaOH theo tỉ lệ 1:1 nên X là axit hoặc este (trừ este của phenol)
Có 6 cấu tạo thỏa mãn X:
+ Axit đơn chức: CH3 - C6H4 - COOH (3 đồng phân o, m, p)
+ Axit đơn chức: C6H5 - CH2 - COOH
+ Este đơn chức: C6H5COOCH3; HCOO - CH2 - C6H5
Lời giải:
mNa = 62 – 16 = 46 (g)
Vậy trong 1 phân tử hợp chất có 2 nguyên tử Na và 1 nguyên tử O.
Câu 40: Cân bằng PTHH sau: Al + AgNO3 → Al(NO3)3 + Ag
Lời giải:
Al + 3AgNO3 → Al(NO3)3 + 3Ag
Giải thích:
- Cân bằng nhóm (NO3) ở hai vế bằng cách thêm hệ số 3 trước AgNO3.
Al + 3AgNO3 → Al(NO3)3 + Ag
- Cân bằng số nguyên tử Ag ở hai vế bằng cách thêm hệ số 3 trước Ag.
Al + 3AgNO3 → Al(NO3)3 + 3Ag
- Kiểm tra, phản ứng đã được cân bằng:
Al + 3AgNO3 → Al(NO3)3 + 3Ag
A. X chu kì 3, nhóm IIA, Y chu kì 2, nhóm IIIA;
B. X chu kì 3, nhóm IIA, Y chu kì 3, nhóm IIIA;
C. X chu kì 2, nhóm IIIA, Y chu kì 3, nhóm IIIA;
Lời giải:
Đáp án đúng là: B
Giả sử ZX, ZY là số proton của X và Y (ZX < ZY)
Cấu hình electron của X: 1s22s22p63s2, X ở chu kì 3 nhóm IIA
Cấu hình electron của Y: 1s22s22p63s23p1,Y ở chu kì 3 nhóm IIIA
Lời giải:
Đáp án đúng là: B
Câu 43: Nguyên tố A có tổng số hạt là 34 hạt. Tìm số hạt mỗi loại trong A, A là nguyên tố nào?
Lời giải:
Gọi: Số hạt proton = số hạt electron = p
Số hạt nơtron = n
Ta có :
2p + n = 34 ⇔ n = 34 - 2p
Mặt khác :
p ≤ n ≤ 1,5p
⇔ p ≤ 34 - 2p ≤ 1,5p
⇔ 9,7 ≤ p ≤ 11,3
Với p = 10 thì A là nguyên tố Neon suy ra n = 34 - 10.2 = 14 loại vì phân tử khối p + n = 10 + 14 = 28 ≠≠ 20
Với p = 11 thì A là nguyên tố Natri suy ra n = 34 - 11.2 = 12 chọn vì phân tử khối p + n = 11 + 12 = 23
Vậy A là natri (Na).
Câu 44: Cho sơ đồ phản ứng:
FexOy + H2SO4 → Fex(SO4)y + H2O
Với x ≠ y thì giá trị thích hợp của x và y lần lượt là:
Lời giải:
Đáp án đúng là: B
Fe có hóa trị II và III còn có nhóm (SO4) có hóa trị II
Mà x # y → x = 2 và y = 3 là hợp lí.
Phương trình hóa học sau:
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Câu 45: Lập PTHH và cho biết tỉ lệ số nguyên tử, phân tử giữa các chất trong phản ứng: FeCl2 + Cl2 → FeCl3
Lời giải:
2FeCl2 + Cl2 → 2FeCl3
Giải thích cách lập phương trình hoá học:
- Viết sơ đồ phản ứng: FeCl2 + Cl2 → FeCl3
- Làm chẵn số nguyên tử Cl ở vế phải bằng cách thêm hệ số 2 trước FeCl3:
FeCl2 + Cl2 → 2FeCl3
- Cân bằng số nguyên tử Fe ở hai vế bằng cách thêm hệ số 2 trước FeCl2:
2FeCl2 + Cl2 → 2FeCl3
- Kiểm tra, phản ứng đã cân bằng:
2FeCl2 + Cl2 → 2FeCl3
Tỉ lệ: Số phân tử FeCl2 : Số phân tử Cl2 : Số phân tử FeCl3 = 2 : 1 : 2
Câu 46: Hòa tan 4,8 gam Mg vào dung dịch HCl vừa đủ thu được V lít khí H2 (ở đktc). Giá trị của V là:
D. 44,8.
Lời giải:
Đáp án đúng là: A
→
Vậy giá trị của V là 4,48.
D. 5.
Lời giải:
Đáp án đúng là: C
Theo giả thiết ở đây: X là este no, mạch hở có 4 nguyên tử C, tạo bởi axit và ancol.
→ X có thể là este no đơn chức, hoặc este no, hai chức
- Este no, đơn chức C4H8O2:
HCOOCH(CH3)2, HCOO(CH2)2CH3, CH3COOC2H5, C2H5COOCH3
- Este no, hai chức C4H6O4:
CH3OOC – COOCH3, HCOOCH2 – CH2OOCH.
Lời giải:
Gọi x, n là số mol, hóa trị của R ( x> 0, )
Ta có PTHH: 2R + 2nHCl → 2RCln + nH2
Biện luận:
x = 1 → MR = 28 (g/mol) (Loại)
x = 2 → MR = 56 (g/mol) (Nhận)
x = 3 → MR = 84 (g/mol) (Loại)
Vậy R là sắt (Fe).
Câu 49: Phân tử khối của hợp chất Pb(NO3)2 bằng:
Lời giải:
Đáp án đúng là: C
Phân tử khối của hợp chất Pb(NO3)2 bằng: 207 + (14 + 16. 3). 2 = 331 đvC.
Lời giải:
Đáp án đúng là: C
Dung dịch X chứa ; (x mol); (y mol)
Bảo toàn điện tích: x + 2y = 0,35
Bảo toàn nguyên tố C: x + y = 0,2 + 0,1
Giải hệ: x = 0,25; y = 0,05
Nên
Xem thêm các câu hỏi ôn tập Hóa chọn lọc, hay khác:
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)