1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 3)
Bộ 1000 câu hỏi ôn tập môn Hóa có đáp án Phần 3 hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa.
1000 câu hỏi ôn tập Hóa học (Phần 3)
Lời giải:
Bảo toàn khối lượng có: nO2=23,2-16,832=0,2
Trường hợp 1:
Gọi kim loại M có hoá trị n ( ) nên oxit của kim loại M sẽ là M2On
Phương trình phản ứng:
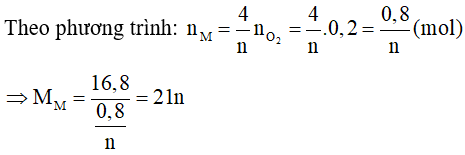
Ta có:
|
n |
1 |
2 |
3
|
|
MM |
21 (loại) |
42 (loại) |
63 (loại) |
Vậy không có kim loại M nào thoả mãn.
Trường hợp 2: Kim loại là Fe
Bảo toàn khối lượng có:
3Fe + 2O2 Fe3O4.
0,3 ⟵ 0,2 mol
Vậy mFe = 0,3.56 = 16,8 trùng khối lượng đề bài cho.
Vậy kim loại M là Fe.
Lời giải:
Đáp án đúng là: D
P + 5HNO3 → H3PO4 + 5NO2↑ + H2O
a….5a…………a (mol)
S + 6HNO3 → H2SO4 + 6NO2↑ + 2H2O
b…..6b……….b (mol)
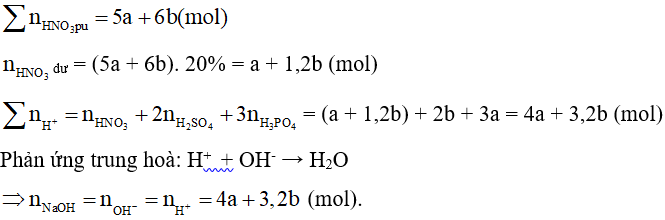
Câu 3: Tính hoá trị của C trong CO2 biết oxi hoá trị là II?
Lời giải:
Gọi hoá trị của C trong CO2 là a
Theo quy tắc hoá trị, ta có: a. 1 = II. 2 → a = IV
Vậy hóa trị của C trong hợp chất CO2 là IV.
Lời giải:
Đáp án đúng là: B
Phương trình phản ứng: P2O5 + 4NaOH → 2Na2HPO4 + H2O
Theo phương trình:
Câu 5: Viết 8 phản ứng khác nhau điều chế CO2?
Lời giải:
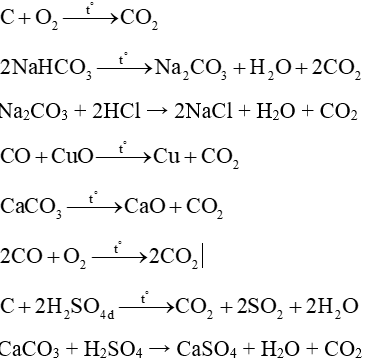
Câu 6: Cân bằng phương trình hoá học sau theo phương pháp thăng bằng electron: .
Lời giải:
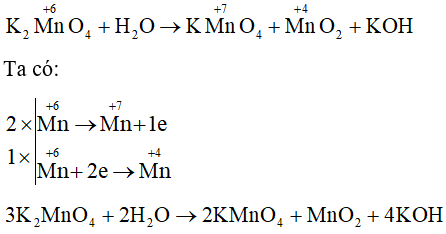
Câu 7: Khi delta H (lượng nhiệt phản ứng) < 0 thì phản ứng đó toả nhiệt hay thu nhiệt?
Lời giải:
Khi delta H (Lượng nhiệt phản ứng) < 0 thì phản ứng đó toả nhiệt.
Câu 8: Công thức cấu tạo của phân tử HCl là:
Lời giải:
Đáp án đúng là: A
Công thức cấu tạo của phân tử HCl là H – Cl.
Lời giải:
Đáp án đúng là: C
Khối lượng giảm là tổng khối lượng của NO2 và O2:
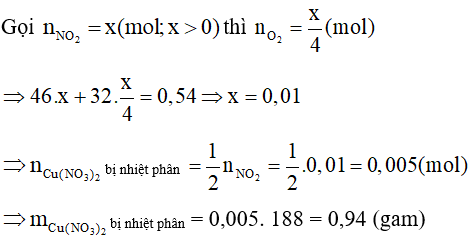
Câu 10: Nhóm HPO4 có hoá trị là mấy?
Lời giải:
Nhóm photphat (PO4) có hoá trị là III
Nhóm HPO4 có thêm 1 nguyên tử H nên hoá trị của (HPO4) là: 3 – 1 = 2
Vậy nhóm HPO4 có hoá trị là II.
a) Tính % khối lượng mỗi kim loại trong hỗn hợp X ban đầu.
Lời giải:
a)
Phương trình hoá học:
2Al + 6HCl → 2AlCl3 + 3H2
mAl = 0,1. 27 = 2,7 (g)
→ %mCu = 100% – 45,76% = 54,24%
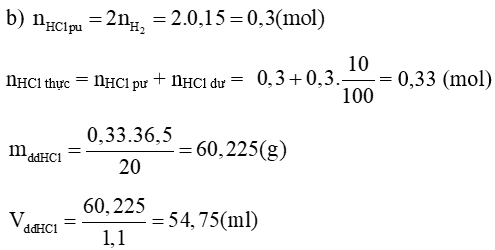
a) Tính khối lượng dung dịch HCl tham gia phản ứng.
b) Tính nồng độ phần trăm các chất trong dung dịch ban đầu.
Lời giải:
a) Na2CO3 + HCl → NaCl + NaHCO3 (1)
K2CO3 + HCl → KCl + KHCO3 (2)
NaHCO3 + HCl → NaCl + CO2 + H2O (3)
KHCO3 + HCl → KCl + CO2 + H2O (4)
Ca(OH)2 + NaHCO3 → NaOH + CaCO3 + H2O (5)
Ca(OH)2 + KHCO3 → KOH + CaCO3 + H2O (6)
Ta có:
Theo PTHH (1) và (6), ta có:
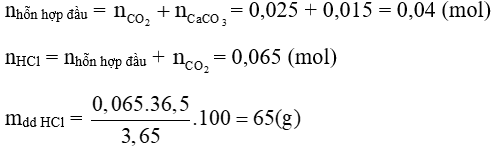
b) Gọi số mol của Na2CO3 và K2CO3 lần lượt là x mol và y mol
Ta có hệ phương trình:
mhỗn hợp ban đầu = 4,56 + 45,44 = 50 (g)
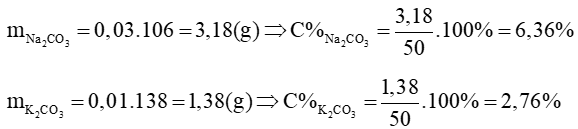
c) Gọi số mol của Na2CO3 và K2CO3 cần thêm vào lần lượt là a mol và b mol
Vì C% bằng nhau nên ta có: 3,18 + 106a = 1,38 + 138b (*)
Theo C% ta có:
Từ (*) và (**) giải ra được: a = 0,015; b = 0,0246
Vậy khối lượng mỗi muối cần thêm vào là:
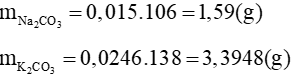
Câu 13: Thể tích dung dịch NaOH 2M tối thiểu để hấp thụ hết 4,48 lít khí CO2 (đktc) là:
Lời giải:
Đáp án đúng là: B
Vì dùng dung dịch NaOH tối thiểu để hấp thụ CO2 nên:
Phương trình phản ứng: NaOH + CO2 → NaHCO3
Vdd NaOH =
Câu 14: Hiện tượng xảy ra khi cho 1 lá nhôm vào dung dịch H2SO4 đặc, nguội?
B. Khí không màu và không mùi thoát ra
Lời giải:
Đáp án đúng là: D
Chú ý: Một số kim loại như Al, Fe, Cr … không tác dụng với H2SO4 đặc, nguội
Lời giải:
Ở 12oC: S = 33,5 gam
Cứ 100 gam nước hoà tan 33,5 gam CuSO4 tạo thành 133,5 gam dung dịch bão hoà
Cứ x gam nước hoà tan y gam CuSO4 tạo thành 1335 gam dung dịch bão hoà
→ x = 1000 gam nước; y = 335 gam CuSO4
Gọi a là số gam CuSO4 (a > 0) cần thêm để được dung dịch bão hoà ở 90oC
Ta có: = 1000 (g)
= (335 + a) (g)
Theo bài ra, ta có:
Vậy khối lượng CuSO4 cần thêm là 465 gam.
Câu 16: Cho các nhận định sau về protein, nhận định nào đúng?
A. Protein được cấu tạo từ các loại nguyên tố hóa học: C, H, O;
B. Protein mất chức năng sinh học khi cấu trúc không gian bị phá vỡ;
C. Protein ở người và động vật được tổng hợp bới 20 loại axit amin lấy từ thức ăn;
D. Protein đơn giản gồm nhiều chuỗi pôlipeptit với hàng trăm axit amin.
Lời giải:
Đáp án đúng là: B
Protein chỉ thực hiện được chức năng ở cấu trúc không gian (cấu trúc bậc 3 hoặc bậc 4).
Khi cấu trúc không gian 3 chiều (protein ở dạng bậc 3 hoặc bậc 4) bị phá vỡ (do nhiệt độ, pH….) thì làm cho chúng mất đi chức năng sinh học.
Câu 17: Tính tổng số mol có trong hỗn hợp khí sau: 0,44 gam CO2; 0,04 gam H2; 0,56 gam N2.
Lời giải:
Tổng số mol của các khí trong hỗn hợp:
Câu 18: Dẫn ra các phương trình hóa học chứng minh nitơ có tính oxi hóa và có tính khử.
Lời giải:
Các phương trình hóa học chứng minh nitơ có tính oxi hóa và có tính khử.
- Nitơ có tính oxi hoá:
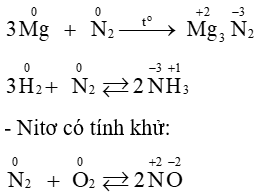
Lời giải:
Đáp án đúng là: B
Zn + 2HCl → ZnCl2 + H2 ↑
Khí H2 nhẹ hơn không khí, cháy trong không khí với ngọn lửa màu xanh nhạt.
Câu 20: Xác định hoá trị của Fe trong Fe3O4?
Lời giải:
Fe3O4 được coi như là hỗn hợp của FeO và Fe2O3 theo tỉ lệ 1:1. Cho nên hoá trị của Fe trong hợp chất đó là có cả II và III.
Hoá trị trung bình của Fe trong hợp chất trên là
Câu 21: Cân bằng phương trình hoá học: Fe + HCl + Fe3O4 → FeCl2 + H2O
Lời giải:
Fe + 8HCl + Fe3O4 → 4FeCl2 + 4H2O
a) dd (2) tạo kết tủa trắng với dd (1), (3), (4).
b) dd (5) tạo kết tủa trắng với dd (1), (3), (4).
c) dd (2) không tạo kết tủa với dd (5).
d) dd (1) không tạo kết tủa với dd (3), (4).
e) dd (6) không phản ứng với dd (5).
f) dd (5) được trung hòa bởi HCl.
g) dd (3) tạo kết tủa với HCl và tan khi bị đun nóng.
Lời giải:
f, dd (5) được trung hoà bởi HCl nên (5) là NaOH.
g, dd (3) tạo kết tủa với HCl, tan kết tủa khi đun nóng nên (3) là Pb(NO3)2.
d, dd (1) không tạo kết tủa với Pb(NO3)2 nên (1) là Ba(NO3)2.
Ba(NO3)2 không tạo kết tủa với (4) nên (4) là CaCl2.
a, dd (2) kết tủa trắng với Ba(NO3)2, Pb(NO3)2, CaCl2 nên (2) là (NH4)2SO4.
→ Còn lại (6) là Na2CO3.
Câu 23: Nhận biết các dung dịch bằng phương pháp hoá học: NaOH, Ca(NO3)2, H2SO4, K2SO4.
Lời giải:
- Cho các chất tác dụng với quỳ tím:
+ Chất nào làm quỳ tím hoá đỏ là H2SO4.
+ Chất nào làm quỳ tím hoá xanh là NaOH.
+ Không làm quỳ tím đổi màu là: Ca(NO3)2 và K2SO4 (nhóm I).
- Cho 2 chất nhóm I tác dụng với BaCl2:
Xuất hiện kết tủa là K2SO4; còn lại không hiện tượng là Ca(NO3)2.
Phương trình: K2SO4 + BaCl2 → 2KCl + BaSO4↓.
Câu 24: Nhận biết các dung dịch bằng phương pháp hoá học: HNO3, Ca(OH)2, H2SO4, KCl.
Lời giải:
Cho quỳ tím vào từng mẫu thử
+ Quỳ hóa xanh: Ca(OH)2
+ Quỳ hóa đỏ: H2SO4, HNO3 (nhóm I)
+ Quỳ không đổi màu: KCl
Cho dung dịch BaCl2 vào 2 mẫu làm quỳ hóa đỏ (nhóm I)
+ Kết tủa: H2SO4
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
+ Không hiện tượng: HCl.
Câu 25: Cho 1,89g Zn(NO3)2 tác dụng với dung dịch NaOH 1M. Thể tích dung dịch NaOH tối thiểu để không còn kết tủa là?
Lời giải:
Đề bài yêu cầu tính thể tích dung dịch NaOH tối thiểu để không còn kết tủa nên xảy ra 2 phản ứng hoá học sau:
Zn(NO3)2 + 2NaOH → Zn(OH)2↓ + 2NaNO3
2NaOH + Zn(OH)2 → Na2ZnO2 + 2H2O
Theo phương trình trên:
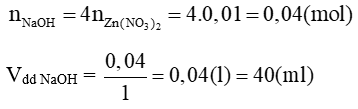
Lời giải:
Đáp án đúng là: D
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
