1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 20)
Bộ 1000 câu hỏi ôn tập môn Hóa có đáp án Phần 20 hay nhất được biên soạn và chọn lọc giúp bạn ôn luyện và đạt kết quả cao trong bài thi môn Hóa.
1000 câu hỏi ôn tập Hóa (Phần 20)
Lời giải
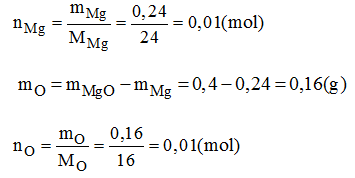
Vậy trong 1 phân tử hợp chất có 0,01 mol nguyên tử Mg; 0,01 mol nguyên tử O. Có nghĩa là 1 mol nguyên tử Mg kết hợp với 1 mol nguyên tử O.
→ Công thức hóa học đơn giản của magie oxit là: MgO.
A. CH2 = CH2;
B. (CH3)2C = C(CH3)2;
C. CH2 = C(CH3)2;
D. CH3CH = CHCH3.
Lời giải
Đáp án đúng là: D
Đặt CTPT của anken là CnH2n (n ≥ 2)
Ta có: n=nCO2nanken=0,20,05=4 . Vậy anken có CTPT là C4H8.
Cho A tác dụng với dung dịch HBr chỉ cho một sản phẩm duy nhất nên A là CH3CH = CHCH3.
A. C2H4 và C3H6;
B. C3H6 và C4H8;
C. C2H6 và C3H8;
D. C3H8 và C4H10.
Lời giải
Đáp án đúng là: B
100mlX{C3H9NCxHy+O2→750ml{N2CO2H2OH2SO4→350ml{N2CO2
Nếu hiđrocacbon là ankan:
Vankan + Vamin = VH2O−(VCO2+VN2)=400−350=50ml≠100ml → Loại
Nếu hiđrocacbon là anken CnH2n
Vamin=VH2O−(VCO2+VN2)=400−350=50ml
Bảo toàn nguyên tố H: 50.9 + 50.2n = 2VH2O = 2.400 = 800 → n = 3,5
Vậy hai anken là C3H6 và C4H8.
Lời giải
nCH4=11,222,4=0,5(mol)
Phương trình phản ứng: CH4+2Ot°→2CO2+2H2O
Theo phương trình:
nO2=2nCH4=2.0,5=1(mol);nCO2=nCH4=0,5(mol)VO2=1.22,4=22,4(l)VCO2=0,5.22,4=11,2(l)
Câu 5: Đốt cháy hoàn toàn 13,5 gam etylamin, thu được H2O, N2 và x mol CO2. Giá trị của x là:
A. 0,6;
B. 0,3;
C. 0,4;
D. 0,2.
Lời giải
Đáp án đúng là: A
nC2H5NH2=13,545=0,3(mol)
Bảo toàn nguyên tố C: C2H5NH2 → 2CO2
→ x = 0,3.2 = 0,6 (mol).
Câu 6: Đốt hoàn toàn 2,24 lít khí H2 (đktc) trong không khí, tính khối lượng nước thu được?
Lời giải
nH2=2,2422,4=0,1(mol)
PTHH: 2H2+O2to→2H2O
→nH2O=nH2=0,1(mol)→mH2O=0,1.18=1,8(g)
A. C2H3O2Na;
B. C2H5O2Na;
C. C3H5O2Na;
D. C3H7O2Na.
Lời giải
Đáp án đúng là: A
Vì sản phẩm cháy gồm Na2CO3, CO2 và H2O nên trong A chắc chắn có C, H, Na, có thể có O.
Ta có:
nNa2CO3=0,025 (mol) → nNa = 0,05 (mol)
Vì trong A chỉ có một nguyên tử Na → nA = 0,05 mol
nCO2=0,075 (mol) ; nH2O=0,075 (mol)⇒{nC (A)=nNa2CO3+nCO2=0,1nH (A)=2nH2O=0,15nO (A)=mA−mC−mH−mNa16=0,1
Gọi công thức phân tử của A là CxHyOzNa
x=nCnA=0,10,05=2y=nHnA=0,150,05=3z=nOnA=0,10,05=2
Vậy CTPT của A là C2H3O2Na.
A. Fe;
B. Al;
C. Cr;
D. Mg.
Lời giải
Đáp án đúng là: C
nCl2=2,721622,4=0,1215(mol)
PTHH: 2R+3Cl2t°→2RCl3
→nR=23nCl2=23.0,1215=0,081(mol)⇒MR=4,2120,081=52(g/mol)
Vậy R là crom (Cr).
Câu 9: Đốt cháy hoàn toàn 4,48 lít C3H8 (đktc) thu được V lít CO2 (đktc) và m gam nước. Tính m và V.
A. m = 14,4 gam, V = 13,44 lít;
B. m = 13,4 gam, V = 13,44 lít;
C. m = 13,44 gam, V = 14,4 lít;
D. m = 13,54 gam, V = 14,4 lít.
Lời giải
Đáp án đúng là: C
C3H8+5O2to→3CO2+4H2O0,2 → 0,6 0,8
m = 0,8.18 = 14,4 gam
V = 0,6.22,4 = 13,44 lít.
Lời giải
Gọi n là hoá trị của M (n∈N*)
2MS+(0,5n+2)O2t°→M2On+2SO2
M2On + 2nHNO3 → 2M(NO3)n + nH2O
Gọi số mol của MS là x
→nM(NO3)n=nMS=x(mol)→nHNO3=nx(mol)→mHNO3=63nx(g)→mddHNO3=500nx3(g)
Bảo toàn khối lượng:
mdd muối = mM2On+mddHNO3=0,5x.(2MM+16n)+500nx3(g)
Ta có: mM(NO3)2=x.(MM+62n)(g)
→x.(MM+62n)0,5x.(2MM+16n)+500nx3=41,72%→MM+62nMM+8n+500n3=41,72%
Thay giá trị của n = 1; 2; 3 thoả mãn n = 3 suy ra MM = 56 g/mol suy ra M là sắt (Fe).
→nFeS=4,456+32=0,05(mol)=x
mdd muối = 29 gam (thay M;n;x)
→ mdd sau khi tách = 29 – 8,08 = 20,92 (g)
→mFe(NO3)3 còn lại = 34,7%.20,92 = 7,26 (g)
→nFe(NO3)3 còn = 0,03 (mol)
→nFe(NO3)3 tách ra = 0,05 – 0,03 = 0,02 (mol)
Rắn có dạng Fe(NO3)3.bH2O →nFe(NO3)3.bH2O = 0,02 (mol)
→242+18b=8,080,02=404→b=9→Fe(NO3)3.9H2O
A. C2H7O.
B. C2H7N.
C. C3H9O2N.
D. C4H10N2O3.
Lời giải
nCO2 = nBaCO3 =39,4197=0,2 (mol)
mdd giảm = mBaCO3–
Xét 6,75 gam A phản ứng tạo 0,075 mol N2
→ Vậy 4,5 gam A thì tạo 0,05 mol N2
→ nN(A) = 0,1 mol
Ta có : mA = mC + mH + mO + mN → nO = 0
→ nC : nH : nN = 0,2 : 0,7 : 0,1 = 2 : 7 : 1
→ CTĐG nhất và cũng là CTPT của A là C2H7N.
Câu 12: Đốt cháy hết 48 gam lưu huỳnh (S) trong oxi (O2) thu được 96 gam lưu huỳnh đioxit (SO2).
a, Viết công thức về khối lượng của phản ứng đã xảy ra
b, Tính khối lượng oxi đã phản ứng.
Lời giải
a. Phương trình:
Áp dụng định luật bảo toàn khối lượng:
b. Thay vào trên, ta có:
48 + = 96
→ = 96 – 48 = 48 (g).
Câu 13: Đốt cháy hoàn toàn 5,1 gam một este X cần vừa đủ 7,28 lít O2 (đktc). CTPT của X là:
A. C3H6O2;
B. C2H4O2;
C. C4H8O2;
D. C5H10O2.
Lời giải
Đáp án đúng là: D
Đặt công thức của este là CnH2nO2
Vậy CTPT của X là C5H10O2.
A. C2H6O;
B. C3H8O;
C. C2H4O2;
D. C4H10O.
Lời giải
Đáp án đúng là: C
Gọi công thức phân tử của Y có dạng: CxHyOz
Ta có x : y : z = nC : nH : nO = 0,2 : 0,4 : 0,2 = 1 : 2 : 1
Vậy công thức đơn giản nhất của Y là: (CH2O)n
Có MY = 60 (g/mol) → 30.n = 60 → n = 2.
Vậy công thức phân tử của Y là: C2H4O2.
A. CH4 và C2H4;
B. C2H6 và C3H6;
C. C2H6 và C2H4;
D. CH4 và C3H6.
Lời giải
Đáp án đúng là: A
Đặt công thức phân tử của ankan X là CnH2n+2, công thức phân tử của anken Y là CmH2m (điều kiện n≥1, m≥2)
Bảo toàn nguyên tố C ta có:
Suy ra n + 2m =5
Vì n≥1, m≥2 nên chỉ có n = 1, m = 2 thỏa mãn. Vậy X là CH4 và Y là C2H4.
a) Viết phương trình hoá học của các phản ứng xảy ra?
b) Tính khối lượng dung dịch NaOH đã dùng?
c) Tính nồng độ phần trăm của muối trong dung dịch thu được sau phản ứng?
Lời giải
a) Phương trình phản ứng:
4P + 5O2 2P2O5 (1)
P2O5 + 4NaOH → 2Na2HPO4 + H2O (2)
b)
→
Theo phương trình:
Khối lượng NaOH = 0,4.40 = 16 g
Khối lượng dung dịch NaOH
Theo phương trình:
Theo định luật bảo toàn khối lượng:
Lời giải
Bảo toàn nguyên tố C:
Khối lượng bình tăng:
Bảo toàn nguyên tố H:
mC + mH = 0,3.12 + 0,6 = 4,2 < mX
Vậy trong X có O
Tỉ lệ: nC : nH : nO = 0,3 : 0,6 : 0,3 = 3 : 6 : 3 = 1 : 2 : 1
Vậy công thức đơn giản nhất là CH2O.
Lời giải
P tính theo sản phẩm P2O5, O2 còn dư
→ mP = 0,4.31 = 12,4 (g).
A. Anken.
B. Ankan.
C. Ankadien.
D. Ankin.
Lời giải
Đáp án đúng là: B
Có → ankan.
a) Lập các phương trình hóa học
b) Tính thể tích mỗi khí trong hỗn hợp A.
c) Tính % thể tích mỗi khí trong hỗn hợp A.
Lời giải
a.
b. Theo phương trình:
c.
A. 1,12;
B. 1,344;
C. 1,68;
D. 1,792.
Lời giải
Đáp án đúng là: C
Ta thấy hỗn hợp X đều chứa ancol no, đơn chức nên gọi CTTQ của X là CnH2n+1OH.
Có
Theo phương trình, ta có:
Theo phương trình, ta có:
Theo phương trình, ta có:
Câu 22: Đốt cháy hoàn toàn m gam một amin X bằng lượng không khí vừa đủ thu được 17,6 gam CO2 và 12,6 gam H2O và 69,44 lít nitơ. Giả thiết không khí chỉ gồm nitơ và oxi, trong đó oxi chiếm 20% thể tích. Các thể tích đo ở đktc. Amin X có công thức phân tử là:
A. C2H5NH2;
B. C3H7NH2;
C. CH3NH2;
D. C4H9NH2.
Lời giải
Đáp án đúng là: A
Nhận thấy đáp án đều là các amin no đơn chức mạch hở nên ta tính ngay được số mol amin bằng việc áp dụng công thức tính nhanh:
→ mamin = mC + mH + mN = 0,4.12 + 0,7.2 + 0,2.14 = 9 (g)
Lời giải
Amin no, đơn chức, mạch hở có công thức tổng quát là CnH2n+3N (n≥1)
Tỉ lệ khối lượng của CO2 với H2O là 44 : 27 nên coi khối lượng của CO2 là 44 gam, khối lượng của H2O là 27 gam.
→nC : nH = 1 : 3
⇒ 2n + 3 = 3n ⇒ n = 3
Vậy công thức của amin là C3H9N.
Lời giải
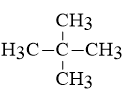
Gọi CTTQ của A là CnH2n+2
Ta có:
Vậy CTPT của A là C5H12
Vì khi clo hóa A theo tỉ lệ 1 : 1 chỉ thu được 1 môn duy nhất , do đó :
CTCT của X là
Câu 25: Đốt cháy hoàn toàn một hidrocacbon X thu được 8,96 lít khí CO2 (đktc) và 9 gam nước. Xác định CTPT của X.
A. C4H10;
B. C5H12;
C. C4H8;
D. C5H10.
Lời giải
Đáp án đúng là: A
→ C : H = 0,4 : 1 = 4 : 10
→ X là C4H10.
B. C2H6O.
C. C2H6O2.
D. Không thể xác định.
Lời giải:
Đáp án đúng là: B
Các phản ứng xảy ra khi cho sản phẩm cháy vào bình đựng dung dịch Ba(OH)2:
CO2 + Ba(OH)2 → BaCO3 + H2O (1)
2CO2 + Ba(OH)2 → Ba(HCO3)2 (2)
Ba(HCO3)2 BaCO3 + CO2 + H2O (3)
Ta có:
Theo giả thiết khối lượng dung dịnh giảm 5,5 gam nên ta có:
19,7 − 0,2.44 − = 5,5 ⇒ = 5,4 gam ⇒ nH = 2. = 0,6 mol.
Bảo toàn nguyên tố oxi:
→ nC : nH : nO = 0,2 : 0,6 : 0,1 = 2 : 6 : 1
Vậy CTPT của X là C2H6O.
- Đốt hỗn hợp gồm C và S trong oxi dư thu được hỗn hợp khí A.
- Cho 1/2 A lội qua dung dịch NaOH thu được dung dịch B và khí C. Cho khí B đi qua hỗn hợp chứa CaO và MgO nung nóng được chất rắn D và khí E. cho khí E lội qua dung dịch Ca(OH)2 thu được kết tủa F và dung dịch G. Thêm dung dịch KOH vào dung dịch G lại thấy kết tủa F xuất hiện. Đun nóng G cũng thấy kết tủa F xuất hiện.
- Cho 1/2 A còn lại cho đi qua xúc tác V2O5 và đun nóng được khí M. Dẫn M đi qua dung dịch BaCl2 thấy có kết tủa N xuất hiện.
Hãy xác định A, B, C, ... M, N là những chất gì, viết PTHH.
Lời giải:
- Đốt hỗn hợp C và S trong O2 dư
C + O2 CO2 (1)
C + CO2 2CO (2)
S + O2 SO2 (3)
- Hỗn hợp khí A gồm: CO2; SO2; O2 dư; CO
- Cho 1/2 A lội qua dung dịch NaOH
2NaOH + CO2 → Na2CO3 + H2O (4)
NaOH + CO2 → NaHCO3 (5)
2NaOH + SO2 → Na2SO3 + H2O (6)
NaOH + SO2 → NaHSO3 (7)
- Khí B gồm: O2 dư; CO
Dung dịch C gồm Na2CO3; Na2SO3; NaHCO3; NaHSO3; NaOH dư (nếu có)
- Cho khí B qua hỗn hợp chứa CuO; MgO nung nóng:
CO + CuO Cu + CO2 (8)
- Chất rắn D: MgO; Cu; CuO dư (nếu có)
- Khí E: CO2; O2 dư
- Cho khí E lội qua dung dịch Ca(OH)2
CO2 + Ca(OH)2 → CaCO3 + H2O (9)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (10)
Kết tủa F: CaCO3
Dung dịch G: Ca(HCO3)2
Thêm KOH vào dung dịch G :
2KOH + Ca(HCO3)2 → K2CO3 + CaCO3 + 2H2O (11)
Kết tủa F: CaCO3
- Đun nóng G:
Ca(HCO3)2 CaCO3 + CO2 + H2O (12)
Kết tủa F: CaCO3
- Cho 1/2 A còn lại qua xúc tác V2O5 nung nóng:
(13)
(14)
Khí M gồm: CO2; O2 dư; SO3; SO2 dư (nếu có)
- Dẫn khí M qua dung dịch BaCl2:
SO3 + BaCl2 + H2O → BaSO4 + 2HCl (15)
Kết tủa N: BaSO4.
a. Xác định các chất có kí hiệu A, C, F, G, H, X, Y?
b. Viết các phương trình hoá học của các phản ứng xảy ra.
Lời giải:
a. Đốt khí A trong oxi thiếu ta được chất rắn C màu vàng → A là H2S và C là S.
Khí X có màu vàng lục → X là Cl2
Khí X tác dụng với khí A tạo ra C và F nên F là HCl.
b. Các phương trình hoá học xảy ra:
Cho A tác dụng với dung dịch của chất G tạo ra chất kết tủa H màu đen nên G là Pb(NO3)2, H là PbS.
4Cl2 + 4H2O + H2S → H2SO4 + 8HCl
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
Pb(NO3)2 + H2S → PbS↓ + 2HNO3.
A. Sắt cháy tạo thành khói trắng dày đặt bám vào thành bình.
B. Không thấy hiện tượng phản ứng.
C. Sắt cháy sáng tạo thành khói màu nâu đỏ.
D. Sắt cháy sáng tạo thành khói màu đen.
Lời giải:
Đáp án đúng là: C
Sắt cháy trong clo tạo khói màu nâu đỏ chính là của FeCl3.
PTHH:
C. 15 gam;
D. 21,6 gam.
Lời giải:
Đáp án đúng là: C
Phenly benzoat: C6H5 – COO – C6H5
neste = 0,05 (mol); nNaOH = 0,15 (mol)
C6H5 – COO – C6H5 + 2NaOH → C6H5COONa + C6H5ONa + H2O
Ban đầu: 0,05 0,15 mol
Phản ứng: 0,05 → 0,1 → 0,05 → 0,05 mol
Sau p/ư: 0,05 0,05 0,05 0,05 mol
mrắn = mNaOH dư + = 0,05. (40 + 144 + 116) = 15 (g).
Lời giải:
Hỗn hợp nước bột sắn dây được gọi là huyền phù
Cần chuẩn bị: phễu, lưới lọc (hoặc vải lọc), chậu.
Đầu tiên, khuấy đều nước bột sắn dây (nước bột sắn cần trắng ngần) rồi chờ để bột sắn dây lắng xuống dưới, rồi từ từ bỏ phần nước bột sắn dây cho đến khi thấy gần đến phần bột thì thôi. Đem phần tinh bột đi phơi nắng đến khô.
Lời giải:
Nước muối là hỗn hợp đồng nhất.
Em cần chuẩn bị: Đèn cồn, cốc sứ nung, kiềng 3 chân.
Em dùng phương pháp cô cạn: Đun nước muối đến khi nước bay hơi hết, thì sẽ thu được muối.
Câu 33: Este có tác dụng với dung dịch HCl không?
Lời giải:
Este có tác dụng với dung dịch HCl, vì este bị thuỷ phân trong môi trường axit.
Ví dụ:
A. CH3COOH và C3H5OH;
B. C2H3COOH và CH3OH;
C. HCOOH và C3H5OH;
D. HCOOH và C3H7OH;
Lời giải:

Câu 35: Để điều chế muối clorua, ta chọn những cặp chất nào sau đây?
B. HCl, Na2SO4.
C. H2SO4, BaCl2.
D. AgNO3, HCl.
Lời giải:
Đáp án đúng là: D
Na2SO4 không phản ứng với KCl
HCl Không phản ứng với Na2SO4
BaCl2 + H2SO4 → BaSO4↓ + 2HCl
AgNO3 + HCl → AgCl↓ + HNO3
Câu 36: Vì sao Al, Fe không tác dụng được với HNO3 và H2SO4 đặc, nguội?
Al, Fe không tác dụng được với HNO3 và H2SO4 đặc, nguội là do 2 kim loại đó bị thụ động trong 2 dung dịch trên.
Câu 37: Viết chuỗi phương trình:
Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe
Lời giải:
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl
Câu 38: Hoàn thiện sơ đồ phản ứng:
Fe → FeO → FeCl2 → Fe(OH)2 → Fe2O3 → FeCl3 → Fe(OH)3
Lời giải:
FeO + 2HCl → FeCl2 + H2O
FeCl2 + 2NaOH → Fe(OH)2↓ + 2NaCl
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
FeCl3 + 3NaOH → Fe(OH)3↓ + 3NaCl.
Câu 39: Fe và NaCl có cùng tồn tại trong một dung dịch không?
Lời giải:
Fe và NaCl có cùng tồn tại trong một dung dịch vì Fe và NaCl không phản ứng với nhau
Câu 40: Cân bằng phương trình sau:
Fe(OH)2 + KMnO4 + H2SO4 → Fe2(SO4)3 + MnSO4 + K2SO4 + H2O
Lời giải:
10Fe(OH)2 + 2KMnO4 + 18H2SO4 → 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 28H2O
Câu 41: Nung Fe(OH)3 trong không khí và chân không thì sản phẩm là?
Nung Fe(OH)3 trong không khí và chân không thì sản phẩm là Fe2O3.
Fe2(SO4)3 + Cl2 → Phản ứng không xảy ra.
Câu 43: Fe2O3 + CO → Fe3O4 + CO2
Cân bằng phương trình, ghi rõ số oxi hoá và quá trình oxi hoá khử.
Quá trình oxi hoá khử:
Phản ứng xảy ra
3Fe2O3 + CO 2Fe3O4 + CO2
Lời giải:
Câu 45: Cân bằng các phản ứng sau theo phương trình thăng bằng electron
Lời giải:
Fe2O3 + 3H2 2Fe + 3H2O
Câu 46: Fe2(SO4)3 + HCl có phản ứng không? Nếu có thì viết phương trình hóa học.
Lời giải:
Fe2(SO4)3 + HCl không phản ứng vì sản phẩm không có chất kết tủa, bay hơi, hay chất điện li yếu.
Câu 47: Vì sao Fe2(SO4)3 không tác dụng với HNO3 đặc nóng?
Vì đã có hoá trị cao nhất của Fe, gốc là gốc axit mạnh nên không phản ứng.
Câu 48: Cho các ion , Ag+, Na+, , . Các ion nào sau đây tồn tại đồng thời trong dung dịch?
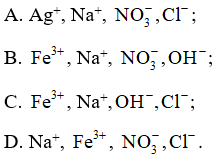
Lời giải:
Đáp án đúng là: D
Loại A vì có xảy ra phản ứng:
Loại B, C vì có xảy ra phản ứng:
Câu 49: Cho FeO tác dụng với dung dịch HCl dư, sinh ra chất nào sau đây?
C. FeCl3;
D. H2.
Lời giải:
Đáp án đúng là: A
Phản ứng xảy ra là: FeO + 2HCl → FeCl2 + H2O
Câu 50: Hệ số cân bằng của H2SO4 trong phản ứng: FeS + H2SO4 đặc → Fe2(SO4)3 + SO2 + H2O là:
A. 8;
B. 10;
C. 9;
D. 12.
Lời giải:
Đáp án đúng là: B
Cân bằng: 2FeS + 10H2SO4 đặc → Fe2(SO4)3 + 9SO2 + 10H2O
Xem thêm các câu hỏi ôn tập Hóa học chọn lọc, hay khác:
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 15)
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 16)
1000 câu hỏi ôn tập môn Hóa có đáp án (Phần 17)
Xem thêm các chương trình khác:
- Các dạng bài tập Tiếng Anh thông dụng nhất
- 3000 câu hỏi ôn tập môn Tiếng Anh có đáp án
- Toàn bộ kiến thức về cụm động từ | Định nghĩa và cách dùng
- 500 đoạn văn Tiếng Anh thông dụng nhất và cách làm
- 1000 câu hỏi ôn tập môn Công nghệ có đáp án
- 1000 câu hỏi ôn tập Giáo dục công dân
- 15000 câu hỏi ôn tập môn Toán có đáp án
- Wiki Toán | Khái niệm, định lí, tính chất, dạng bài, công thức
- Tuyển tập đề thi + chuyên đề ôn thi Toán Kangaroo các cấp độ (có đáp án 2024)
- 3000 câu hỏi ôn tập môn Vật lí có đáp án
- Tổng hợp Dạng bài - Công thức môn Vật lí
- 2000 câu hỏi ôn tập môn Tin học có đáp án
- 3000 câu hỏi ôn tập môn Lịch sử có đáp án
- 3000 câu hỏi ôn tập môn Địa lí có đáp án
- 2000 câu hỏi ôn tập môn Sinh học có đáp án
- Tổng hợp Dạng bài - Công thức môn Sinh học
- Tổng hợp về các tác giả văn học
- 3000 câu hỏi ôn tập môn Ngữ văn có đáp án
- Tổng hợp kiến thức Ngữ Văn
- Tuyển tập truyện dân gian, truyền thuyết, cổ tích,... Việt Nam
- Tổng hợp các đề đọc - hiểu có đáp án chi tiết
- Trò chơi Powerpoint | Game Powerpoint
- Tổng hợp bài thu hoạch BDTX Giáo viên mầm non (2025) theo Thông tư 12
- Tổng hợp bài thu hoạch BDTX Giáo viên tiểu học (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THCS (2025)
- Tổng hợp bài thu hoạch BDTX Giáo viên THPT (2025)
